地高辛对缺氧诱导的乳腺癌细胞上皮间质转化和侵袭的影响*
2016-06-06李伯和
李伯和, 袁 磊
(漯河医学高等专科学校,河南 漯河 462002)
地高辛对缺氧诱导的乳腺癌细胞上皮间质转化和侵袭的影响*
李伯和,袁磊△
(漯河医学高等专科学校,河南 漯河 462002)
[摘要]目的: 本研究旨在探究地高辛对缺氧诱导乳腺癌细胞上皮间质转化、迁移和侵袭能力的影响,并探讨其分子机制。方法:选取人乳腺癌MCF-7细胞作为研究对象,采用CoCl2模拟化学缺氧条件,采用细胞划痕实验测量细胞迁移率,采用Transwell侵袭实验检测细胞侵袭力,采用Western blot方法检测人乳腺癌MCF-7细胞缺氧诱导因子-1α(HIF-1α)、Snail、E-cadherin和vimentin蛋白表达的变化。结果:缺氧使MCF-7细胞从多角形上皮形态转变成梭形间质细胞形态,细胞间隙增大,而在地高辛作用下缺氧的MCF-7细胞未发生明显的上皮间质转化。细胞划痕实验和Transwell侵袭实验结果显示,经CoCl2处理的MCF-7细胞的迁移和侵袭能力均显著增强(P<0.01),地高辛可抑制CoCl2诱导的细胞迁移和侵袭(P<0.01)。与control组相比,CoCl2组细胞的HIF-1α、Snail和vimentin蛋白表达水平显著升高(P<0.01),E-cadherin的蛋白表达水平显著降低(P<0.01);CoCl2+digoxin组细胞的HIF-1α、E-cadherin和vimentin蛋白表达水平与control组相比差异均无统计学显著性,Snail蛋白表达水平虽略高于control组(P<0.05),但与CoCl2组细胞相比显著降低(P<0.01)。结论:地高辛可通过下调HIF-1α和Snail蛋白表达抑制缺氧诱导的MCF-7细胞上皮间质转化和侵袭。
[关键词]地高辛; 上皮间质转化; 缺氧诱导因子-1α; 细胞侵袭; MCF-7细胞
在实体肿瘤的发生发展过程中,由于肿瘤细胞的快速增殖以及肿瘤组织自身血供不足,导致实体肿瘤组织内部普遍处于缺氧状态[1]。长期处于缺氧环境会促使肿瘤细胞外基质的结构发生改变、细胞间黏附作用下降、细胞运动性和侵袭性增强[2]。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是广泛表达于脊椎动物细胞内的一种调控缺氧应答的转录因子[3]。在缺氧状态下,肿瘤细胞高表达HIF-1α,参与肿瘤细胞的存活、增殖、侵袭和转移、放化疗耐药等过程[4-5]。地高辛(digoxin)是一种从毛花洋地黄中提纯制得的强心苷,可选择性与心肌细胞膜Na+/K+-ATP酶结合而抑制其活性,用于治疗充血性心力衰竭和某些室上性心律失常。近年来越来越多的证据显示,地高辛对多种肿瘤具有抑制作用[6-7]。本研究以人乳腺癌MCF-7细胞为研究对象,探究地高辛对CoCl2诱导的MCF-7迁移和侵袭的影响及其分子生物学机制。
材料和方法
1材料
人乳腺癌MCF-7细胞由本校分子医学实验中心提供。胎牛血清(fetal bovine serum,FBS)和RPMI—1640培养基购自HyClone;地高辛(digoxin)、氯化钴(CoCl2)和4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自Sigma;E-cadherin、vimentin、HIF-1α、Snail和β-actin抗体购自Santa Cruz;Transwell小室购自Corning。
2方法
2.1细胞培养与实验分组人乳腺癌MCF-7细胞用含10% FBS的RPMI-1640培养基,置于37 ℃、5% CO2培养箱中培养。待细胞汇合度达到80%后,将细胞随机分为3组:(1)对照(control)组:将细胞置于无血清RPMI-1640培养基中培养24 h;(2)CoCl2组:将细胞置于含有200 μmol/L CoCl2的无血清RPMI-1640培养基中培养24 h;(3)CoCl2+digoxin组:将细胞置于含有200 μmol/L CoCl2和100 nmol/L地高辛的无血清RPMI-1640培养基中培养24 h。倒置相差显微镜下观察细胞形态变化。
2.2细胞划痕实验取对数生长期细胞以每孔1×106个细胞接种于6孔板,置于37 ℃、5% CO2细胞培养箱中培养,待细胞长到融合成单层状态时,将细胞置于无血清培养基中培养24 h,用无菌的100 μL移液器枪头在底部划线,吸去细胞培养液,用PBS冲洗细胞3次,按上述实验分组分别加入相应的培养基,置于37 ℃、5% CO2细胞培养箱中培养,在0和24 h用倒置显微镜进行拍照,用ImageJ软件测量划痕面积,计算平均迁移距离(S),每孔测量5处,取平均值,每组设3复孔。迁移率(migration rate,MR;%)=S实验组/S对照组×100%。
2.3Transwell侵袭实验将Matrigel基质胶与RPMI-1640培养基按1∶6稀释,取50 μL均匀铺到Transwell小室上室内,将小室放入24孔板中,37 ℃恒温孵育3 h使其成凝胶状。取对数生长期细胞,按上述实验分组,用配置好的各实验组培养基制备2.5×108/L的细胞悬液,取200 μL加入上室内,在24孔板中加入600 μL含10% FBS的RPMI-1640培养基,置于37 ℃、5% CO2细胞培养箱中培养24 h。取出小室,用棉签擦去上室内的细胞,经4%多聚甲醛固定和DAPI染色后,于荧光显微镜下取5个视野拍照计数,取平均值,每组设3复孔。侵袭率(invasion rate,IR;%)=侵袭细胞数实验组/侵袭细胞数对照组×100%。
2.4Western blot检测蛋白水平裂解各组细胞提取总蛋白,用BCA法定量后,进行SDS-PAGE电泳并转移至PVDF膜。封闭液(5% BSA/TBST)封闭1 h,加入Ⅰ抗(1∶1 000稀释),4 ℃孵育过夜,TBST洗膜3次,加入Ⅱ抗(1∶1 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,胶片用凝胶成像系统携带的白色光源拍照,用ImageJ软件测定各蛋白条带灰度值。
3统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),并用Bonferroni校正的t检验进行组间两两比较。以P<0.05为差异有统计学显著性。
结果
1地高辛抑制CoCl2诱导的MCF-7细胞上皮间质转化(epithelial-mesenchymal transiton,EMT)
在倒置相差显微镜下可见,对照组细胞呈多角形上皮形态, 细胞之间紧密相接。经200 μmol/L CoCl2作用24 h后,细胞形态转变为间质细胞形态,表现为细胞形态拉长呈梭形,细胞间隙增大。CoCl2+digoxin组细胞依然呈上皮形态,未发生明显的EMT,见图1。
2地高辛抑制CoCl2诱导的MCF-7细胞迁移
细胞划痕实验结果显示,CoCl2组细胞迁移率为155.97%±10.43%,显著高于control组(P<0.01);CoCl2+digoxin组细胞迁移率为113.96%±9.06%,与control组相比无统计学差异,这表明地高辛可抑制CoCl2诱导的细胞迁移,见图2。
3地高辛抑制CoCl2诱导的MCF-7细胞侵袭
Transwell实验结果显示,CoCl2组细胞侵袭率为233.80%±15.49%,显著高于control组(P<0.01);CoCl2+digoxin组细胞侵袭率为112.68%±11.27%,与control组相比差异无统计学显著性,这表明地高辛可抑制CoCl2诱导的细胞侵袭,见图3。
4CoCl2对HIF-1α、Snail、E-cadherin和vimentin蛋白表达的影响
Western blot结果显示,与control组相比,CoCl2组细胞HIF-1α、Snail和vimentin蛋白表达水平显著升高(P<0.01),E-cadherin蛋白表达水平显著降低(P<0.01);CoCl2+digoxin组细胞HIF-1α、E-cad-herin和vimentin蛋白表达水平均与control组相比差异无统计学显著性, Snail蛋白表达水平虽略高于control组(P<0.05),但与CoCl2组细胞相比显著降低(P<0.01),见图4、5。
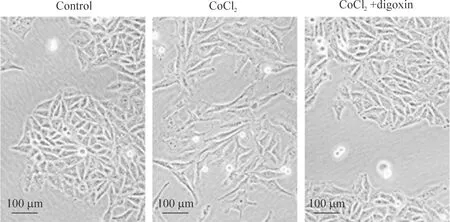
Figure 1.Digoxin inhibited CoCl2-induced epithelial-mesenchymal transition in MCF-7 cells.
图1地高辛抑制CoCl2诱导的MCF-7细胞上皮间质转化
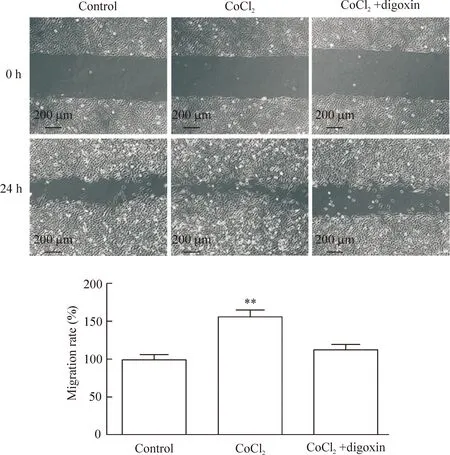
Figure 2.Digoxin inhibited CoCl2-induced migration of MCF-7 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图2地高辛抑制CoCl2诱导的MCF-7细胞迁移
讨论
缺氧在肿瘤的迁移侵袭过程中发挥着重要作用,其中的一个重要机制就是肿瘤细胞发生EMT[8]。EMT是指细胞通过去分化由多边形上皮样形态转变为梭形间叶性细胞形态,获得更具运动能力表型的过程。本研究采用CoCl2处理MCF-7细胞模拟缺氧,导致MCF-7细胞发生EMT,而地高辛可显著抑制CoCl2诱导的EMT,如图1所示。缺氧也使得MCF-7细胞的迁移和侵袭能力均显著增强,该作用也同样被地高辛所阻断。以上结果表明,地高辛对缺氧所导致的MCF-7细胞侵袭能力的增强具有显著的抑制作用。
EMT的一个主要特征为E-cadherin表达减少。E-cadherin是一种钙依赖性细胞黏附分子,在维持正常上皮细胞形态和细胞极性中发挥重要作用[9]。
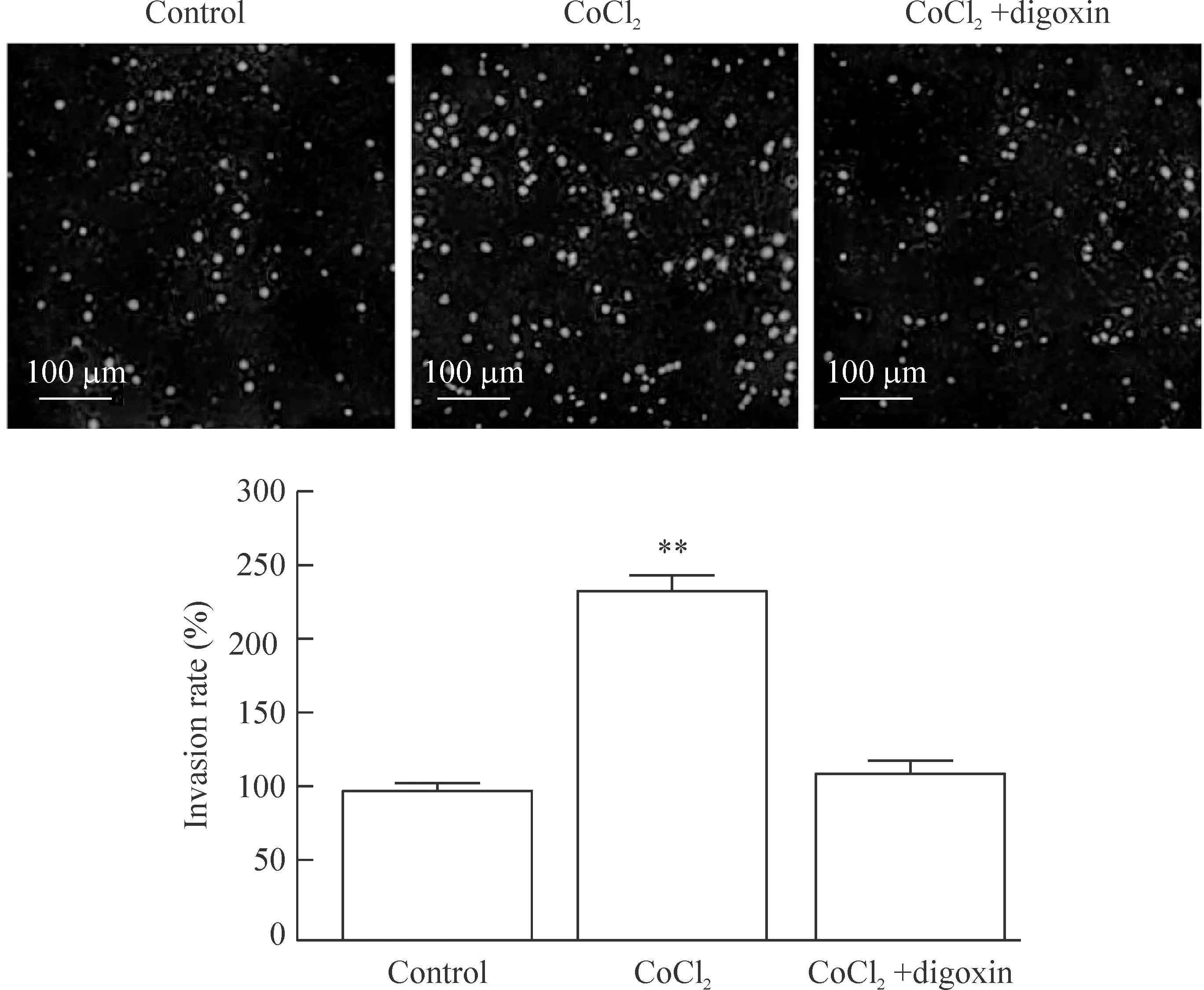
Figure 3.Digoxin inhibited CoCl2-induced invasion of MCF-7 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图3地高辛抑制CoCl2诱导的MCF-7细胞侵袭
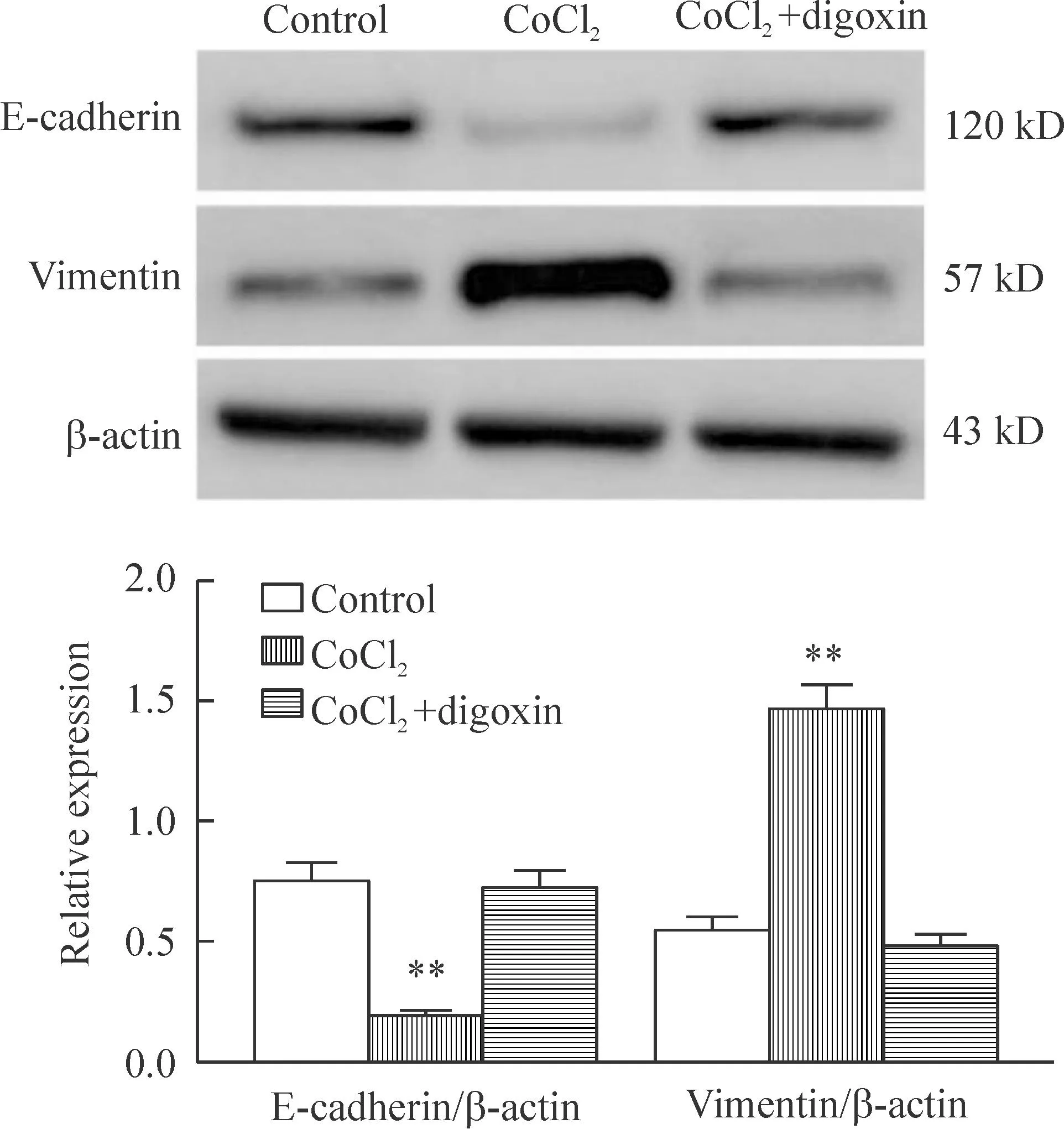
Figure 4.The effect of digoxin on the protein levels of E-cadhe-rin and vimentin in the MCF-7 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图4地高辛对MCF-7细胞E-cadherin和vimentin蛋白水平的影响
EMT的另一个主要特征为以细胞角蛋白为主细胞骨架转化为以vimentin为主的细胞骨架[10]。vimentin是中间丝蛋白的一种,与微管和肌动蛋白微细丝一起组成细胞骨架。本研究结果显示,缺氧可使MCF-7细胞E-cadherin蛋白表达水平显著降低,vimentin蛋白表达水平显著升高,而地高辛可阻断缺氧对MCF-7细胞E-cadherin蛋白和vimentin蛋白表达的影响。
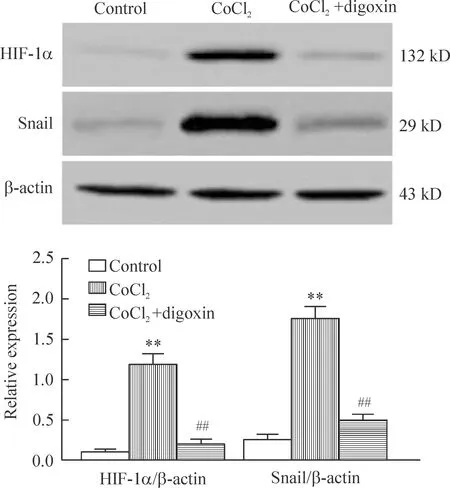
Figure 5.The effect of digoxin on the protein levels of HIF-1α and Snail in the MCF-7 cells. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsCoCl2group.
图5地高辛对MCF-7细胞HIF-1α和Snail蛋白水平的影响
为探究地高辛抑制缺氧诱导EMT的机制,我们观察了地高辛对缺氧条件下MCF-7细胞Snail蛋白表达水平的影响。Snail属转录因子Snail家族成员,该家族包括Snail1(Snail)、Snail2(Slug)和Snail3(Smuc),其羧基末端高度保守,含有4~6个锌指结构,其中Snail羧基末端含有4个锌指结构。Snail可特异性地与E-cadherin启动子中的E-box作用元件相结合而抑制E-cadherin蛋白的表达[11],同时Snail也可上调vimentin蛋白表达[12],在调控EMT过程中发挥着关键性作用[13]。本研究发现缺氧可使MCF-7细胞Snail蛋白表达水平显著升高,该作用可被地高辛抑制。
HIF-1也是缺氧诱导肿瘤细胞发生EMT的重要因子[8, 14]。HIF-1是由HIF-1α和HIF-1β两个亚单位组成的异源二聚体。HIF-1α是HIF-1的功能亚基,由826个氨基酸残基构成,其C端有一个富含脯氨酸-丝氨酸-苏氨酸(Pro/Ser/Thr)的氧依赖降解结构域(oxygen-dependent degradation domain,ODD)。在常氧条件下,HIF-1α的ODD中Pro402和Pro564被脯氨酸羟化酶结构域蛋白(prolyl hydroxylase domain protein,PHD)羟化,被羟化的HIF-1α与肿瘤抑制蛋白(von Hippel-Lindau syndrome protein,pVHL)结合后经泛素-蛋白酶体途径降解。缺氧条件下PHD失活,HIF-1α因不能被羟基化而降解受阻,HIF-1α与HIF-1β在核内形成二聚体HIF-1,HIF-1与靶基因启动子或增强子的缺氧反应元件(hypoxia response element,HRE)结合从而调节其转录表达。HIF-1可直接上调Snail基因表达[15]。Wong等[16]在人三阴乳腺癌细胞MDA-MB-231中发现地高辛可在转录水平显著抑制缺氧诱导的HIF-1α表达。与此相一致,本研究结果显示,地高辛可显著下调缺氧诱导的HIF-1α蛋白表达。
综上所述,缺氧可通过富集HIF-1α上调Snail蛋白表达,导致MCF-7细胞发生EMT,使其迁移和侵袭能力显著增强。地高辛则可通过下调HIF-1α和Snail蛋白表达抑制缺氧诱导的MCF-7细胞上皮间质转化和侵袭。
[参考文献]
[1]Finger EC, Giaccia AJ. Hypoxia, inflammation, and the tumor microenvironment in metastatic disease[J]. Cancer Metastasis Rev, 2010, 29(2):285-293.
[2]Chang J, Erler J. Hypoxia-mediated metastasis[J]. Adv Exp Med Biol, 2014,772:55-81.
[3]Brocato J, Chervona Y, Costa M. Molecular responses to hypoxia-inducible factor 1α and beyond[J]. Mol Pharmacol, 2014, 85(5):651-657.
[4]Li S, Wei Q, Li Q, et al. Down-regulating HIF-1α by lentivirus-mediated shRNA for therapy of triple negative breast cancer[J]. Cancer Biol Ther, 2015, 16(6):866-875.
[5]Miyake S, Kitajima Y, Nakamura J, et al. HIF-1α is a crucial factor in the development of peritoneal dissemination via natural metastatic routes in scirrhous gastric cancer[J]. Int J Oncol, 2013, 43(5):1431-1440.
[6]Gayed BA, O’Malley KJ, Pilch J, et al. Digoxin inhibits blood vessel density and HIF-1a expression in castration-resistant C4-2 xenograft prostate tumors[J]. Clin Transl Sci, 2012, 5(1):39-42.
[7]Wei D, Peng JJ, Gao H, et al. Digoxin downregulates NDRG1 and VEGF through the inhibition of HIF-1α under hypoxic conditions in human lung adenocarcinoma A549 cells[J]. Int J Mol Sci, 2013, 14(4):7273-7285.
[8]Lu X, Kang Y. Notch Signaling: Hypoxia and hypoxia-inducible factors: master regulators of metastasis[J]. Clin Cancer Res, 2010, 16(24):5928-5935.
[9]Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013, 116:317-336.
[10]Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy[J]. Cell Mol Life Sci, 2011, 68(18):3033-3046.
[11]Lin Y, Dong C, Zhou BP. Epigenetic regulation of EMT: the Snail story[J]. Curr Pharm Des, 2014, 20(11):1698-1705.
[12]Smith BN, Burton LJ, Henderson V, et al. Snail promotes epithelial mesenchymal transition in breast cancer cells in part via activation of nuclear ERK2[J]. PLoS One, 2014, 9(8):e104987.
[13]Kaufhold S, Bonavida B. Central role of Snail1 in the re-gulation of EMT and resistance in cancer: a target for therapeutic intervention[J]. J Exp Clin Cancer Res, 2014, 33:62.
[14]Gilkes DM, Semenza GL. Role of hypoxia-inducible factors in breast cancer metastasis[J]. Future Oncol, 2013, 9(11):1623-1636.
[15]Xu X, Tan X, Tampe B, et al. Snail is a direct target of hypoxia-inducible factor 1α (HIF1α) in hypoxia-induced endothelial to mesenchymal transition of human coronary endothelial cells[J]. J Biol Chem, 2015, 290(27):16653-16664.
[16]Wong CC, Zhang H, Gilkes DM, et al. Inhibitors of hypoxia-inducible factor 1 block breast cancer metastatic niche formation and lung metastasis[J]. J Mol Med, 2012, 90(7):803-815.
(责任编辑: 林白霜, 罗森)
Effect of digoxin on hypoxia-induced epithelial-mesenchymal transition and invasion in human breast carcinoma MCF-7 cells
LI Bai-he, YUAN Lei
(LuoheMedicalCollege,Luohe462002,China.E-mail:fzyx_yl@163.com)
[ABSTRACT]AIM: To investigate the effect of digoxin on hypoxia-induced epithelial-mesenchymal transition (EMT), migration and invasion in human breast carcinoma MCF-7 cells. METHODS: MCF-7 cells were treated in vitro with a chemical hypoxia inducer cobalt chloride (CoCl2) to imitate hypoxia. Cell migration was observed by wound healing assay, and cell invasion was measured by Transwell invasion assay. The protein levels of hypoxia-inducible factor-1α (HIF-1α), Snail, E-cadherin and vimentin in MCF-7 cells were detected by Western blot. RESULTS: Digoxin inhibited CoCl2-induced EMT and reversed the mesenchymal phenotype. CoCl2 enhanced the abilities of migration and invasion (P<0.01), significantly decreased the expression of E-cadherin and increased the expression of HIF-1α, Snail and vimentin (P<0.01), but these effects were blocked by digoxin. CONCLUSION: Digoxin inhibits CoCl2-induced EMT and invasion most likely via HIF1-α-Snail signaling pathway.
[KEY WORDS]Digoxin; Epithelial-mesenchymal transition; Hypoxia-inducible factor-1α; Cell invasion; MCF-7 cells
[文章编号]1000- 4718(2016)05- 0852- 05
[收稿日期]2015- 11- 13[修回日期] 2015- 12- 28
*[基金项目]河南省科技厅科技发展计划项目(No. 142102310466);漯河医学高等专科学校自然科学研究计划项目(No. 2014-S-LMC09)
通讯作者△Tel: 0395-2969424; E-mail: fzyx_yl@163.com
[中图分类号]R737.9; R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.014
杂志网址: http://www.cjpp.net
