HBsAg阳性肝癌患者预后及病理因素与ALK基因表达的相关性研究*
2016-06-06刘建化金浩生田红霞张绪超
刘建化, 金浩生, 田红霞, 张绪超, 马 冬△
(广东省人民医院/广东省医学科学院 1胃肠肿瘤内科, 2肝胆外科, 3肺癌研究所,广东 广州 510180)
HBsAg阳性肝癌患者预后及病理因素与ALK基因表达的相关性研究*
刘建化1,金浩生2,田红霞3,张绪超3,马冬1△
(广东省人民医院/广东省医学科学院1胃肠肿瘤内科,2肝胆外科,3肺癌研究所,广东 广州 510180)
[摘要]目的: 检测ALK基因在HBsAg阳性肝细胞癌患者中的表达,并分析其与临床特征及预后的相关性。方法: 收集我院2005~2010年261例术后经病理确诊的HBsAg阳性肝癌患者肿瘤组织及癌旁组织标本,采用免疫组织化学法和FISH法对标本石蜡切片进行分析,检测ALK表达情况,并探讨其对HBsAg阳性肝癌患者临床病理因素和预后的影响。结果: 在肿瘤组织中,免疫组织化学法和FISH法分别检测到ALK阳性表达率为44.8%和32.6%。免疫组化结果进一步显示ALK蛋白表达与患者性别、肿瘤数目和微转移密切相关(P<0.05),而与患者的年龄、AFP水平、肿瘤大小、临床分期等无关;ALK阳性患者总生存期和无进展生存期均明显低于阴性患者(P<0.01);多因素分析显示,ALK表达和微转移是对患者无进展生存期具有统计学显著性的预后因素。结论: ALK在HBsAg阳性肝癌组织表达状态与肝癌的生长和转移关系密切,可以作为反映肝癌生物学行为和判断预后的有效指标。
[关键词]ALK基因; HBsAg; 肝细胞癌
原发性肝细胞癌(以下简称肝癌)是最常见的恶性肿瘤之一,全世界每年新发病例约为78.2万,其中男性肝癌发病率位居第5位而女性居第9位[1]。我国属于肝癌高发国家,年发病及死亡病例数均占到全球50%,严重危及人民健康,而慢性乙型肝炎病毒(hepatitis B virus,HBV)感染所致的慢性肝炎和肝硬化则是最主要致病因素[2]。肝癌预后差,其传统治疗方法包括介入、化疗、放疗等,效果均不理想,近年来随着对肿瘤发病机制及其生物学行为研究的不断深入,特异性高且不良反应轻的分子靶向药物日益成为研究焦点。索拉非尼是一种口服的多靶点、多激酶抑制剂,美国食品药品监督管理局于2007年批准用于晚期肝癌的一线治疗,可延长晚期肝癌患者生存时间,具有良好的临床疗效和安全性;但近年来索拉非尼导致的原发或继发耐药逐渐增多,生存期延长有限,寻找肝癌新的治疗靶点显得尤为重要。
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)属于胰岛素受体超家族,编码一个跨膜受体酪氨酸激酶;它的激活影响肿瘤细胞的增殖分化与凋亡,在肿瘤发生、发展中起着重要作用[3]。ALK基因异常通常包括基因易位、扩增、点突变以及过表达,其中染色体易位形成的ALK融合基因是恶性肿瘤中最常见的ALK畸变。目前研究已证实[4]ALK可与ATIC、TFG、CLTC、EML4、NPM等多种基因发生融合,ALK融合基因触发ALK激酶持续活性,成为癌基因依赖途径。针对ALK融合基因的小分子抑制剂克唑替尼(crizotinib)已经作为ALK阳性非小细胞肺癌(non-small cell lung cancer,NSCLC)一线治疗首选,其较高的客观有效率更是开创了靶向治疗里程碑。迄今为止,ALK基因异常在多种实体瘤中已有报导,比如乳腺癌[5]、结肠癌[6]等,同时证实ALK基因异常与恶性肿瘤发展有相关性。但目前鲜有研究探索肝癌中ALK基因的表达情况及临床意义。
本文基于免疫组化和FISH方法,以确诊为HBsAg阳性肝癌患者的石蜡包埋组织切片为研究对象,检测肝癌中ALK基因的表达,并评价其临床病理特征,探讨其能否作为判断预后及指导靶向药物治疗的一项辅助检测手段。
材料和方法
1材料
收集2005年6月~2010年10月广东省人民医院共261例经病理学证实的HBsAg阳性肝癌组织标本和距离病灶边缘2 cm的癌旁组织标本,所有患者术前均未接受化疗和放疗;所有病理标本均经10%甲醛固定,石蜡包埋,有明确的起始时间(手术时期)、终点时间及终点状态(生存、死亡),死亡患者有明确的死亡时间、死因记录。研究对象纳入标准:(1)血清学检查HBsAg阳性,病理学诊断为肝细胞癌;(2)有充足的病理学标本,临床资料齐备;(3)每个患者均已签知情同意书,其中男性225例(86.2%),女性36例(13.8%),年龄21~82岁,平均52岁。存活组81例,中位生存期45.0月;死亡组180例,中位生存期35.0月。总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)分别定义为随机分组开始至死亡/随访结束以及局部复发/远处转移/随访结束。肝癌微转移是指肿瘤进程中播散并存活于血循环、骨髓等组织器官的微小肿瘤细胞灶,本研究根据病理科采用PCR技术对肝癌、癌旁组织和患者外周血检测的AFP mRNA结果判定:AFP的mRNA可作为肝细胞癌标记基因,即检测到AFP的mRNA说明肿瘤细胞存在,患者出现微转移。肿瘤的临床病理分期依据2002年国际抗癌联盟所定的肝癌TNM分期法。
2试剂
兔抗人ALK单克隆抗体购自CST;Ⅱ抗SP免疫组化试剂盒购自北京中杉公司;LSI ALK双色分离探针购自Vysis;胃蛋白酶反应液购自Sigma。
3实验方法
3.1免疫组化每个蜡块取4 μm厚连续切片,将切片放于二甲苯中脱蜡,乙醇梯度水化处理,3%的过氧化氢去离子水消除内源性过氧化物酶,EDTA(pH 8.0)修复液常规修复以充分暴露抗原位点。待其自然冷却后,加封闭液室温封闭15 min,兔抗人ALK(1∶50)4 ℃孵育过夜,磷酸盐缓冲液(PBS)漂洗3次,每次5 min,后加 II 抗室温孵育15 min,PBS 漂洗3次,每次5 min,加链霉卵白素室温孵育15 min,磷酸盐缓冲液(PBS)漂洗3次,每次5 min,DAB显色10 min,终止显色,苏木素复染,盐酸乙醇固定,中性树胶封片,观察。实验结果由2位病理科医生在双盲情况下观察组织标本的着色程度所得,ALK蛋白阳性表现为细胞浆内呈现棕褐色染色,高倍镜下(×200)随机取4个不同视野,评分如下:≥10%肿瘤细胞中无染色为(-),微弱的胞浆染色为(+),中度光滑的胞浆染色为(++),重度颗粒状胞浆染色为(+++)。
3.2FISH作为诊断ALK基因状态的金标准,我们对261例病理切片标本进行FISH检测。具体实验步骤按照说明书进行:切片脱蜡、脱水,肿瘤区域滴加4 g/L胃蛋白酶反应液(1∶10 000),消化15 min;再脱水,室温晾干;随后切片加入5 μL稀释的ALK探针,变性,放入预热的杂交盒中过夜;次日清洗、干燥,滴加适量DAPI复染剂到杂交区域,观察结果。ALK易位阳性定义为:计数100个完整细胞,其中≥15%细胞红绿信号分离或者出现单红信号。然而目前ALK拷贝数增加尚无明确定义,本文参考了Pietrantonio等[7]在结肠癌研究中的结果判定标准:计数细胞中≥10%的细胞里出现3~5 ALK拷贝数称为ALK拷贝数增加,出现≥6 ALK拷贝数称为ALK基因扩增。
4统计学处理
鱼类的性成熟受遗传和环境的双重影响,对某一物种来说,既具备相对的稳定性,又表现出一定的可塑性[20]。从云南鳅的基础生物学特征研究中得出,草海云南鳅最小性成熟的年龄为1+龄,雄鱼最小体长为 1.22 cm,体重 0.21 g;雌鱼最小体长 3.01 cm,体重0.41 g。在未达到性成熟之前,雄鱼和雌鱼在外部形态上无显著差异,较难区分,性成熟后可以根据成熟的雌鱼腹部膨大突出,能够看到卵巢鼓起的轮廓,个体比雄鱼小,生殖孔出现淡淡的红色等特征可以区分雌雄。
应用SPSS 10.0软件包进行统计学分析。ALK蛋白表达情况与其临床病例关系的比较采用2检验,生存率采用Kaplan-Meier法计算,生存期差别的比较采用Log-Rank时序检验。Cox比例风险模型评估影响患者生存的各变量,以P<0.05为差异有统计学意义。
结果
1免疫组织化学检测到ALK蛋白在HBsAg阳性肝癌组织中的表达
在261例HBsAg阳性肝癌组织标本中检测出117例呈ALK蛋白阳性,表现为不同程度的棕色胞浆染色,其阳性率为44.8%,而癌旁组织中未检测到ALK表达或仅有微弱表达,见图1。
2FISH检测ALK状态
在所有261例HBsAg阳性肝癌和癌旁标本中,均未检测到ALK易位或扩增,然而有85例肝癌标本检测出ALK基因拷贝数增加(这里称之为FISH阳性),阳性率为32.6%,而癌旁组织标本呈阴性。在85例FISH阳性的肝癌标本中,82例的IHC检测也为阳性,见图1。
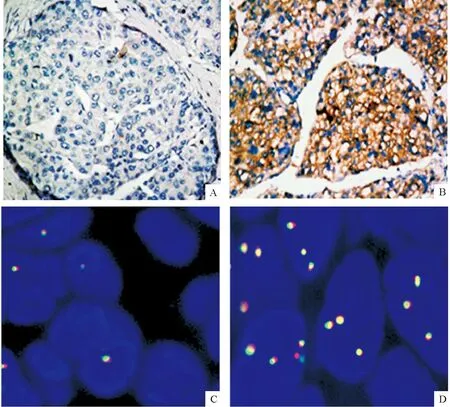
Figure 1.Anaplastic lymphoma kinase (ALK) expression in HBsAg-positive hepatocellular carcinoma samples (×200). A: negative ALK staining in para-carcinoma cells detected by immunohistochemistry (IHC); B: cytoplasmic staining in the tumor cells detected by IHC; C: negativeALKgene copy number gain in para-carcinoma tissue detected by fluorescenceinsituhybri-dization (FISH) analysis; D: positiveALKgene copy number gain in tumor detected by FISH.
图1IHC和FISH检测ALK在HBsAg阳性肝癌患者中的状态
3ALK蛋白表达与临床病理关系
本研究探讨了ALK表达与HBsAg阳性肝癌患者的临床病理联系,相对于DNA和RNA,蛋白表达更稳定,其结果更有可比性,所以我们的数据分析均基于IHC检测结果,见表1。Crosstabs分析及Chi-Square Tests分析可见ALK蛋白表达与患者性别、肿瘤数目和微转移密切相关(P<0.05);即男性、多发肿瘤(肿瘤数目≥2个)、有微转移患者的ALK阳性表达率明显高于女性、单发肿瘤、无微转移患者。而与患者的年龄、AFP水平、肿瘤大小、临床分期等无关。
表1ALK与HBsAg阳性肝癌患者的临床病理关系
Table 1.Correlation between HBsAg-positive patients’ clinicopathological features and the protein expression of anaplastic lymphoma kinase (ALK)
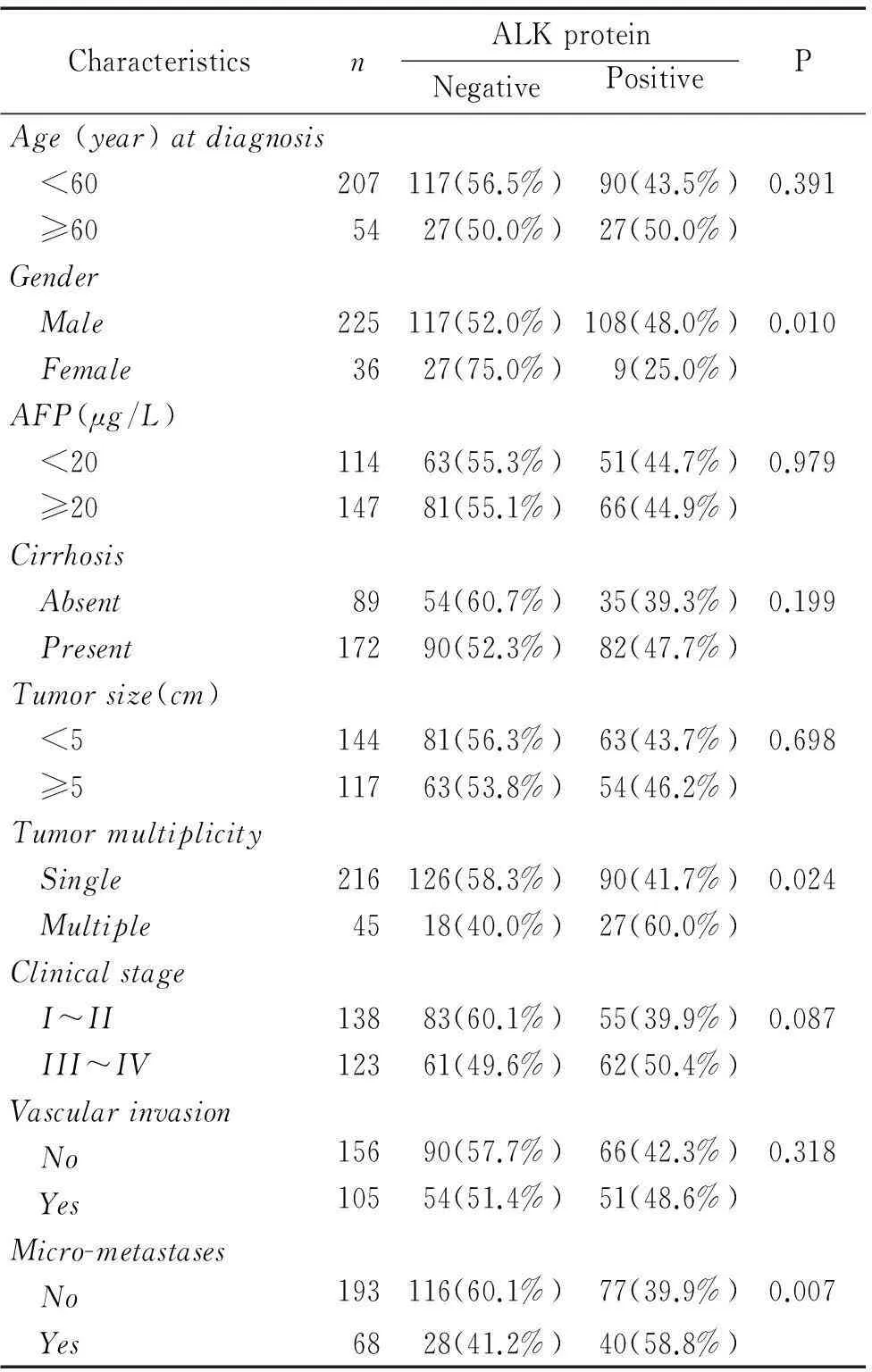
CharacteristicsnALKproteinNegativePositivePAge(year)atdiagnosis <60207117(56.5%)90(43.5%)0.391 ≥605427(50.0%)27(50.0%)Gender Male225117(52.0%)108(48.0%)0.010 Female3627(75.0%)9(25.0%)AFP(μg/L) <2011463(55.3%)51(44.7%)0.979 ≥2014781(55.1%)66(44.9%)Cirrhosis Absent8954(60.7%)35(39.3%)0.199 Present17290(52.3%)82(47.7%)Tumorsize(cm) <514481(56.3%)63(43.7%)0.698 ≥511763(53.8%)54(46.2%)Tumormultiplicity Single216126(58.3%)90(41.7%)0.024 Multiple4518(40.0%)27(60.0%)Clinicalstage I~II13883(60.1%)55(39.9%)0.087 III~IV12361(49.6%)62(50.4%)Vascularinvasion No15690(57.7%)66(42.3%)0.318 Yes10554(51.4%)51(48.6%)Micro-metastases No193116(60.1%)77(39.9%)0.007 Yes6828(41.2%)40(58.8%)
AFP: alpha-fetoprotein.
截止到2013年6月1日随访结束,69.0%(180/261)的HBsAg阳性肝癌患者死亡,均死于肿瘤复发或转移,中位随访时间36.0月(0.6~78月),11例(4.2%)患者失访。本研究进一步评估了ALK基因对HBsAg阳性肝癌患者预后生存的影响。结果显示ALK阴性患者的OS和PFS均明显高于ALK阳性患者(P<0.05),见图2。
5影响HCC预后的Cox分析
利用Cox比例风险模型对可能影响HBsAg阳性肝癌预后的多因素进行分析, 包括年龄、性别、AFP水平、肝硬化、肿瘤大小、肿瘤数目、临床分期、血管侵犯、微转移、ALK蛋白表达,结果见表2。单因素和多因素分析结果表明,ALK蛋白表达是HBsAg阳性肝癌患者PFS的独立预后因子(P<0.05),然而对患者的OS无显著影响。
讨论
肝癌是一种临床和病理都异质性极高的恶性肿瘤,其发生、发展、转移与多种基因突变、细胞信号传导通路和新生血管增生异常等密切相关,尽管目前的临床研究已经取得很大进展,但其发病机理尚不完全清楚,总生存率提高甚微。因此加强肝癌病因学研究,找出其发生发展过程中起关键作用的相关基因,探索分子靶向治疗的潜在靶点至关重要。目前研究中较为肯定的可以作为肝癌分子靶点相关基因包括EGFR、TGF-β、c-MET等[8]。近年来,ALK基因已经引起广泛关注,其异常与人类肿瘤的恶性转化密切相关,特别是ALK抑制剂治疗EML4-ALK阳性NSCLC的高有效率更成为肿瘤治疗上一个里程碑,大量研究对多种实体瘤中ALK基因状态进行探讨。我们希望在此基础上,通过进一步检测ALK基因与肝癌发生发展和预后关系,根据其在肝癌中的作用,找出新的分子诊断、靶向治疗和预后判定新方法,从而在基因水平实现肝癌个体化治疗。
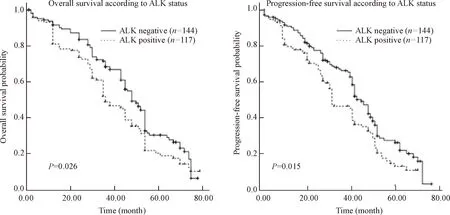
Figure 2. Kaplan-Meier survival curves of HBsAg-positive hepatocellular carcinoma samples.
图2HBsAg阳性肝癌患者的OS和PFS生存曲线
表2261例HBsAg阳性肝癌患者PFS的Cox分析
Table 2. Univariate and multivariate analysis of progression-free-survival (PFS) in 261 HBsAg-positive hepatocellular carcinoma patients

CovariateUnivariateanalysisMultivariateanalysisHR(95%CI)PHR(95%CI)PAge(year)atdiagnosis <60vs≥601.097(0.771-1.562)0.606Gender Malevsfemale0.950(0.607-1.485)0.820AFP(μg/L) <20vs≥200.979(0.728-1.317)0.889Cirrhosis Absentvspresent1.067(0.775-1.469)0.693Tumorsize(cm) <5vs≥51.087(0.810-1.459)0.577Tumormultiplicity Singlevsmultiple1.002(0.682-1.470)0.993Clinicalstage I~IIvsIII~IV1.477(1.095-1.992)0.011Vascularinvasion Novsyes1.113(0.854-1.450)0.430Micro-metastases Novsyes2.179(1.584-2.997)<0.0012.007(1.336-3.014)0.001ALKprotein Positivevsnegative1.432(1.064-1.926)0.0181.369(1.006-1.865)0.046
ALK: anaplastic lymphoma kinase; AFP: alpha-fetoprotein; HR: hazard ratios; 95% CI: 95% confidential interval.
本研究对261例HBsAg阳性肝癌患者组织标本的ALK基因状态进行检测,旨在观察肝癌中是否普遍存在ALK表达或者基因变异(包括易位、扩增、突变),并探讨其与临床病理及预后之间的关系。IHC和FISH检测分别显示ALK蛋白高表达(44.8%),ALK基因拷贝数增加(32.6%),并且2种检测结果具有一致性;85例FISH阳性标本中,82例IHC检测也为阳性,而FISH检测特异性更高(97.9%),这与Wu等[9]的研究结果相似。然而值得注意的是,ALK蛋白高表达或者ALK基因拷贝数增加并不意味着存在ALK基因易位。有研究发现[10],在NSCLC患者中,ALK基因拷贝数增加或扩增比较普遍,但是ALK基因易位却罕见,仅占全部患者的3%~5%;类似的结果在鼻咽癌中也得到证实[11]。最近,一项回顾性研究[12]也观察到ALK基因拷贝数增加在肝癌患者中比较常见(阳性率13.15%),但是不存在ALK基因变异。这里,我们的实验均未检测到ALK基因位点易位、扩增、突变,与上述研究结果一致,同样也提示ALK基因在HBsAg阳性肝癌中上调,是肝癌一个新的分子标志物。
本研究进一步探讨了ALK蛋白与HBsAg阳性肝癌临床病理参数之间的关系,结果表明ALK蛋白表达与患者性别、肿瘤数目和微转移密切相关,也就是说,ALK在男性、多发肿瘤、存在微转移的患者中明显高于女性、单发肿瘤、无微转移者,提示ALK在肝癌发生、发展、浸润、转移过程中起到重要作用,ALK阳性的肝癌有可能具有更强的侵袭性。过去几年,大量的实验模型系统已经充分证实ALK基因过表达与肿瘤浸润转移相关基因相互作用,在转录或翻译水平调控肿瘤的侵袭,最终导致器官浸润、肿瘤扩散[13]。此外,邵春奎等[14]也曾报道ALK蛋白在肝癌过表达,并与肿瘤发展相关,但是该研究涉及病例数仅有2例,未做进一步统计分析。我们的实验数据表明ALK过表达在HBsAg阳性肝癌发展、转移中起着至关重要的作用。
众所周知,原癌基因激活和肿瘤抑制子失活是恶性肿瘤发生、发展基础,确切地说,ALK癌基因由它内源性配体肝素结合细胞因子(midkine,MK)和多效生长因子(pleiotrophin,PTN)激活,这两个配体在肿瘤细胞中促进有丝分裂和血管生成。激活的ALK基因高表达于肝癌细胞中,触发一个下游信号级联复杂系统,包括PI3K/AKT和MAPK旁路,引起一系列细胞生物学变化,介导调控细胞增殖、运动和凋亡。因此,ALK基因在驱动体内、外肿瘤发生发展过程中具有重要作用[7, 13]。最近Hasan等[13]研究阐明成神经细胞瘤里,作用于肿瘤进程中关键性增殖通路的MYC蛋白同时调控ALK基因,使遗传稳定性发生改变,干扰细胞正常活动而发生肿瘤,这在另一方面证实ALK基因等致癌作用。有趣的是,Di Paolo等[15]也观察到在成神经细胞瘤中,使用RNA干扰敲除ALK,不论是否存在基因融合,都会导致肿瘤细胞增殖下调、凋亡上调,最终抑制患者肿瘤生长,延长生存。综上所述,ALK基因参与了HBsAg阳性肝癌的发展、转移过程,可作为临床监测病情的一个重要指标。
近年来,研究已证实[15],多种人类恶性肿瘤中ALK基因过表达常预示预后不良,如乳腺癌、基底细胞癌、成纤维细胞瘤等。同样,本研究发现在HBsAg阳性肝癌中,ALK蛋白阳性组的OS和PFS明显低于阴性组,且COX分析也表明ALK蛋白表达是影响患者PFS的不良预后因素。但是Jia等[12]关于肝癌的研究中,所得结果却与我们相反,其数据显示ALK基因拷贝数增加可以预测HBsAg阴性肝癌患者预后生存,然而对HBsAg阳性患者无影响。这种差异可能原因是入组患者遗传背景不同以及研究方法有异。总之,ALK蛋白表达上调是HBsAg阳性肝癌患者预后不良的标志。
由于本研究属于回顾性分析,研究过程中部分患者临床资料失访,特别是肝癌术后未再入院治疗的病人,不可避免引起潜在偏差。因此,我们需要进行更多的体内外试验证实上述结果。此外,是否ALK抑制剂能够有效治疗ALK蛋白过表达的HBsAg阳性肝癌患者尚未明确,有待进一步研究。
综上所述,ALK基因有可能成为HBsAg阳性肝癌患者转移和预后不良的一个新的预测因子,影像学诊断联合ALK基因检测有助于判断新发肝癌病例预后,ALK有可能成为肝癌治疗中新的分子靶点。
[参考文献]
[1]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2]李想. 乙肝肝硬化并发原发性肝癌的危险因素分析[J]. 临床医学, 2015, 35(10):48-50.
[3]林小梅,莫娟梅,邹敏,等.EGFR突变的非小细胞肺癌患者EML4-ALK融合基因的检测及其临床特征分析[J]. 中国病理生理杂志, 2012, 28(6):1135-1139.
[4]Shaw AT, Solomon B. Targeting anaplastic lymphoma kinase in lung cancer[J]. Clin Cancer Res, 2011, 17(8):2081-2086.
[5]Siraj AK, Beg S, Jehan Z, et al. ALK alteration is a frequent event in aggressive breast cancers[J]. Breast Can-cer Res, 2015, 17:127.
[6]Ying J, Lin C, Wu J, et al. Anaplastic lymphoma kinase rearrangement in digestive tract cancer: implication for targeted therapy in Chinese population[J]. PLoS One, 2015, 10(12):e0144731.
[7]Pietrantonio F, Maggi C, Di Bartolomeo M, et al. Gain ofALKgene copy number may predict lack of benefit from anti-EGFR treatment in patients with advanced colorectal cancer andRAS-RAF-PI3KCAwild-type status[J]. PLoS One, 2014, 9(4):e92147.
[8]金文实,王冰,崔韶辉,等. 肝癌基因治疗的研究进展[J]. 医学综述, 2012, 18(7):1023-1025.
[9]Wu YC, Chang IC, Wang CL, et al. Comparison of IHC, FISH and RT-PCR methods for detection ofALKrearrangements in 312 non-small cell lung cancer patients in Taiwan[J]. PLoS One, 2013, 8(8):e70839.
[10]Salido M, Pijuan L, Martínez-Avilés L, et al. IncreasedALKgene copy number and amplification are frequent in non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(1):21-27.
[11]Schoppmann SF, Streubel B, Birner P. Amplification but not translocation of anaplastic lymphoma kinase is a frequent event in oesophageal cancer[J]. Eur J Cancer, 2013, 49(8):1876-1881.
[12]Jia SW, Fu S, Wang F, et al.ALKgene copy number gain and its clinical significance in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(1):183-192.
[13]Hasan MK, Nafady A, Takatori A, et al. ALK is a MYCN target gene and regulates cell migration and invasion in neuroblastoma[J]. Sci Rep, 2013, 3:3450.
[14]邵春奎,苏祖兰,冯智英,等.ALK基因蛋白在肿瘤细胞和正常细胞中表达的意义[J]. 癌症, 2002, 21(1):58-62.
[15]Di Paolo D, Ambrogio C, Pastorino F, et al. Selective therapeutic targeting of the anaplastic lymphoma kinase with liposomal siRNA induces apoptosis and inhibits angiogenesis in neuroblastoma[J]. Mol Ther, 2011, 19(12):2201-2212.
(责任编辑: 林白霜, 罗森)
Status and clinical significance ofALKgene expression in HBsAg-positive hepatocellular carcinoma patients
LIU Jian-hua1, JIN Hao-sheng2, TIAN Hong-xia3, ZHANG Xu-chao3, MA Dong1
(1Department of Gastrointestinal Oncology, Cancer Center,2Department of Hepatobiliary Surgery,3Medical Research Center, Lung Cancer Institute, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510180, China. E-mail: madong8005@126.com)
[ABSTRACT]AIM: To detect the status of anaplastic lymphoma kinase (ALK) in the HBsAg-positive hepatocellular carcinoma (HCC) patients, and to investigate the relationship between ALK gene expression or clinical features or prognosis.METHODS: The surgical patients with HBsAg-positive HCC (n=261) were followed up for at least 2 years. The expression of ALK was examined by the methods of immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) in their archival paraffin embedded tissue specimens, and it was statistically analyzed whether ALK gene abnormalities were associated with patients’ clinical features. RESULTS: Over-expression of ALK protein and ALK gene copy number gain were 44.8% observed by IHC and 32.6% by FISH. The expression of ALK was highly correlated with gender, tumor multiplicity and micrometastasis (P<0.05), but not with age, AFP, tumor size, clinical stage, etc. The survival rate in the patients with positive ALK expression was much lower than that in the patients with negative ALK expression (P<0.01). Multivariate analysis indicated that ALK expression and micrometastasis were both significant prognostic factors of HCC. CONCLUSION: Over-expression of ALK in HBsAg-positive HCC tissues increases the possibilities of growth and metastasis, and ALK may serve as fairly a good indicator for biologic behavior and prognosis of HCC.
[KEY WORDS]ALK gene; HBsAg; Hepatocellular carcinoma
[文章编号]1000- 4718(2016)05- 0841- 06
[收稿日期]2016- 01- 26[修回日期] 2016- 03- 21
*[基金项目]广州市科技攻关基金资助项目(No. 2011B031800285)
通讯作者△Tel: 020-81884713-80521; E-mail: madong8005@126.com
[中图分类号]R363; R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.012
杂志网址: http://www.cjpp.net
