升麻苷H-1 对脑缺血大鼠纹状体氨基酸类神经递质含量的影响*
2016-06-06武密山赵素芝高维娟韩红伟师旭亮
武密山, 赵素芝, 高维娟, 王 茹, 韩红伟, 师旭亮
(1河北中医学院基础医学院方剂学教研室,河北 石家庄 050200; 2石家庄市长安区胜北社区卫生服务中心,河北 石家庄 050041; 3河北省心脑血管病中医药防治重点实验室,河北 石家庄 050091)
升麻苷H-1 对脑缺血大鼠纹状体氨基酸类神经递质含量的影响*
武密山1△,赵素芝2,高维娟3,王茹1,韩红伟1,师旭亮1
(1河北中医学院基础医学院方剂学教研室,河北 石家庄 050200;2石家庄市长安区胜北社区卫生服务中心,河北 石家庄 050041;3河北省心脑血管病中医药防治重点实验室,河北 石家庄 050091)
[摘要]目的: 研究脑缺血大鼠脑纹状体区域细胞外液中氨基酸类神经递质的表达变化,以探讨升麻苷H-1神经保护作用的机制。方法:SD 大鼠随机分为假手术组、脑缺血组、升麻苷H-1高、中、低剂量组和金纳多组。用线栓法造成右侧大脑中动脉闭塞(MCAO),建立局灶脑缺血模型,假手术组和脑缺血组分别给予生理盐水腹腔注射,升麻苷H-1高、中、低剂量组和金纳多组分别给予不同剂量的药物腹腔注射,每天1 次,连续7 d。采用脑微透析技术在大鼠脑纹状体区域内进行微透析活体采样,将微透析液注入高效液相-电化学检测器,检测样品中谷氨酸(Glu)、天门冬氨酸(Asp)、甘氨酸(Gly)和γ-氨基丁酸(GABA)的含量。结果: 与假手术组相比,脑缺血组的兴奋性氨基酸Glu和Asp在脑缺血后2 h浓度升高(P<0.05)。升麻苷H-1高剂量组、金纳多组分别与脑缺血组相比,Glu和Asp在脑缺血后2 h显著降低(P<0.05);升麻苷H-1低、中剂量组分别与脑缺血组相比,Glu和Asp在脑缺血后2 h 没有显著降低(P>0.05)。与假手术组相比,脑缺血组的抑制性氨基酸神经递质GABA 和Gly在脑缺血后3 h浓度降低(P<0.05)。升麻苷H-1高剂量组、金纳多组分别与脑缺血组相比,GABA 和Gly在脑缺血后3 h显著升高(P<0.05);升麻苷H-1低、中剂量组分别与脑缺血组相比,GABA 和Gly在脑缺血后3 h 没有显著升高。结论:升麻苷H-1可以抑制脑缺血时兴奋性氨基酸的过度释放,并增加抑制性氨基酸的浓度。升麻苷H-1不仅能透过血脑屏障,同时可调节脑缺血兴奋性氨基酸神经递质的功能紊乱,可能对缺血脑组织神经元有一定的保护作用。
[关键词]脑缺血; 升麻苷H-1; 微透析; 天门冬氨酸; 谷氨酸; 甘氨酸; γ-氨基丁酸
缺血性脑血管病(ischemic cerebrovascular diseases,ICVD)是老年人中枢神经系统常见病[1]。由于脑部血供不足,相应的局部脑组织缺血缺氧坏死,引起神经损伤,表现为大脑皮层和海马神经元损伤和死亡、脑组织坏死软化,从而产生相应脑功能缺损的临床症状。中枢神经系统(central nervous system,CNS)中作为神经递质的游离氨基酸分两类:即兴奋性氨基酸递质,如谷氨酸(glutamic acid,Glu)、天门冬氨酸(asparagic acid,Asp),以及抑制性氨基酸递质,如γ-氨基丁酸(γ-aminobutyric acid,GABA)、甘氨酸(glycine,Gly)。这两类物质对维持神经系统兴奋性和抑制性的平衡起着至关重要的作用,它们的含量与脑缺血密切相关。临床上许多药物由于不能通过血脑屏障(blood-brain barrier,BBB),因此达不到控制脑血管病的作用。毛茛科植物大三叶升麻具有清热解毒、升举阳气、发表透疹的功效,主治风热头痛、齿痛、咽喉痛、子宫脱垂等,具有抑制核苷酸转运、抗病毒、抗肿瘤、抗神经细胞凋亡、调节神经内分泌功能、抗骨质疏松、消炎等多种生理活性[2]。升麻根茎中含有三萜及其苷类、苯丙酸类、色酮类等化合物[3]。阿魏酸和异阿魏酸等苯丙酸衍生物具有抗炎活性,为其质量控制指标[4-5],是升麻清热解毒的有效成分。近年的研究表明,升麻中所含的升麻三萜皂苷H-1在升麻中的含量较高,易检出[6]。本实验用线栓法造成右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO),建立局灶脑缺血大鼠模型,通过微透析(microdialysis,MD)[7]技术观察脑缺血大鼠纹状体内氨基酸类神经递质(Glu、Asp、Gly和γ-GABA)的含量变化及升麻苷H-1的干预,为其调节脑内氨基酸类神经递质并保护脑缺血后脑组织神经元的作用提供实验依据。
材料和方法
1材料
1.1药品与试剂升麻苷H-1自制,经紫外光谱、红外光谱、质谱、1H核磁共振和13C核磁共振确认结构为升麻苷H-1[8],如图1所示。经高效液相色谱(high-performance liquid chromatography, HPLC) 峰面积归一化法计算纯度>98.70%。实验所用升麻样品购自石家庄市乐仁堂,经药用植物教研室王建华教授鉴定。金纳多(ginkgo)即银杏叶提取物注射液,德国威玛舒培博士药厂产品,主要用于脑部、周围血流循环障碍,每支金纳多含有银杏叶提取物17.5 mg,其中银杏黄酮苷4.2 mg。γ-氨基丁酸、天门冬氨酸、甘氨酸和谷氨酸标准品(Sigma);磷酸氢二钠(J.T.Baker);乙腈(Fisher);其它试剂均为分析纯。将Ring′s试液(含149 mmol/L NaCl,3 mmol/L KCl,1.2 mmol/L CaCl2,0.8 mmol/L MgCl2,pH 6.7)作为脑内微透析灌流液,由本实验室配制。

Figure 1.Chemical structure of cimicifugoside H-1.
图1升麻苷H-1的化学结构式
1.1.1升麻苷H-1提取液的制备(1)色谱条件与系统适应性测试:H&E XP ODS-A 色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈-水-磷酸(35∶65∶0.4),流速1.0 mL/min;检测波长203 nm,柱温26 ℃,进样量20 μL,采集时间60 min。在色谱图中升麻苷H-1 的保留时间为26 min,与相邻峰的分离度均大于1.5,理论塔板数为17 000。(2)升麻苷H-1提取液的制备:精密称取升麻苷H-1 10 mg,加生理盐水制成每1 mL 含升麻苷H-1 10 mg的溶液,摇匀,即得,低剂量升麻苷H-1含量为10 g/L。
1.1.2人工脑脊液(artifical cerebrospinal fluid, aCSF)的配制分别取:NaCl 7.36 g,CaCl20.12 g,NaHCO32.31 g,MgCl20.17 g,KCl 0.18 g,Na2SO40.07 g,KH2PO40.07 g,加入1 000 mL 蒸馏水,溶解后调pH 7.38,再经孔径0.2 μm水系微孔滤膜抽滤即得,冰箱内冷藏备用。
1.2仪器与设备脑微透析探针、CMA/12探针套管、CMA/150 低温样品自动收集器和CMA-400型针管式微量注射泵(CMA);BAS 4100 型大鼠脑立体定位仪;牙科钻(Silite);Agilent 1200 型HPLC 仪(Agilent)。
1.3实验动物健康SD 雄性大鼠48只,体重340~360 g,由河北省实验动物中心提供,许可证号为SCXK(冀)2003-1-003。
2方法
2.1实验分组将大鼠随机分为6 组(n=8):假手术(sham)组:生理盐水1.5 mL·kg-1·d-1;脑缺血(cerebral ischemia,CI)组:生理盐水1.5 mL·kg-1·d-1;金纳多(ginkgo)组:5 mL·kg-1·d-1;升麻苷H-1低剂量(SMGL)组:1.5 mL·kg-1·d-1;升麻苷H-1中剂量(SMGM)组:3 mL·kg-1·d-1; 升麻苷H-1高剂量(SMGH)组:6 mL·kg-1·d-1。各组动物均腹腔注射给药7 d。
2.2模型建立与微透析样品采集采用朱继等[9]改进的Longa线拴法制作大鼠MCAO模型。假手术组分离右侧颈总动脉后,不结扎,只注射生理盐水,不再做其它干预措施;金纳多和升麻苷H-1不同剂量用药组分别按照分组设定的要求给药。大鼠用10%水合氯醛按3.5 mL/kg腹腔注射麻醉后,置脑立体定位仪上,下垫恒温垫,上耳杆,固定门齿,切开头皮,暴露头骨,参照George Paxinos 《大鼠脑立体定位图谱》将探针导管植入左侧纹状体(坐标AP:+0.2 mm;ML:-3.0mm;DV:-3.5 mm)[10],根据坐标位置颅骨钻孔,在脑立体定向仪下旋转垂直臂将微透析探针导轨植入脑纹状体区,并在颅骨外钻孔周围区域呈三角形对称拧入3颗螺钉后,用牙托粉将导轨与螺丝钉固定成一体,插入微透析探针,稳定平衡90 min,开启微透析灌流系统,以aCSF为灌流液,调节微量注射泵控制流速恒定为1.5 μL/min,4 ℃下收集脑微透析液,每隔 30 min 收集1管微透析液。每管微透析液收集完毕后均立即置于-20 ℃ 冰箱保存,在透析结束后转存-80 ℃ 冰箱,择日测定。探针在使用前做回收率测定,用于折算微透析液中各氨基酸类神经递质的浓度。
2.34种氨基酸标准液的标准曲线精密称取Asp、Glu、Gly和γ-GABA 标准对照品各5.0 mg,各用0.1 mol/L的盐酸溶液定容在10 mL的容量瓶中,振荡混匀,得0.5 g/L标准储备溶液,再分别精密量取2 mL标准储备液,用50%的甲醇置50 mL的容量瓶定容成20 mg/L的4种氨基酸混合标准液,然后用50% 的甲醇稀释制成质量浓度为10、5、2.5、1、0.5、0.25、0.125、0.062 5、0.031 25和0.015 625 mg/L的混合氨基酸系列标准溶液。
分别用不同浓度的氨基酸标准液直接在HPLC仪上进行测定,色谱条件与测量样品时一致,每个浓度的标准液连续进样检测3 次。以进样量的神经递质浓度为横坐标、峰面积为纵坐标,利用回归方程计算标准曲线,Asp、Glu、Gly和γ-GABA的标准曲线与线性相关系数分别为:Y=112.87X+9.34(r=0.998 51),Y=121.21X+4.87(r=0.998 72),Y=222.75X+34.43(r=0.998 47),Y=213.42X+25.85(r=0.998 72)。
2.4HPLC-电化学检测器(electrochemical detector,ECD)分析流动相配置:测定流动相每升含0.1 mol/L 乙二胺四乙酸二钠1 mL,0.15 mol/L柠檬酸-柠檬酸钠缓冲液828 mL,1-烷基硫酸钠0.281 g,甲醇150 mL。设定流动相流速为0.7 mL/min,柱温箱温度为28 ℃。ECD工作电压为200 mV、400 mV和600 mV,分别为2、3和4 通道;增益为2 nA。进样量为25 μL。
3统计学处理
根据以上建立的分析方法,以标准曲线计算每只动物给药后每个样品各个时点的测定值浓度,统计每组动物的透析浓度采用均数±标准差(mean±SD)表示,所测数据使用SPSS 13.0 统计软件进行分析,采用组间t检验并进行方差分析比较,以P<0.05为差异有统计学意义。
结果
1升麻苷H-1不同剂量组对脑缺血大鼠纹状体区兴奋性氨基酸(Glu和Asp)浓度变化的比较
与假手术组相比,脑缺血组Glu和Asp在脑缺血后2 h浓度达到最高(P<0.05),之后逐渐回降。升麻苷H-1高剂量组、金纳多组分别与脑缺血组相比,Glu和Asp在脑缺血后2 h 显著降低(P<0.05);升麻苷H-1低、中剂量组分别与脑缺血组相比,Glu和Asp在脑缺血后2 h 没有显著降低,见图2、3。
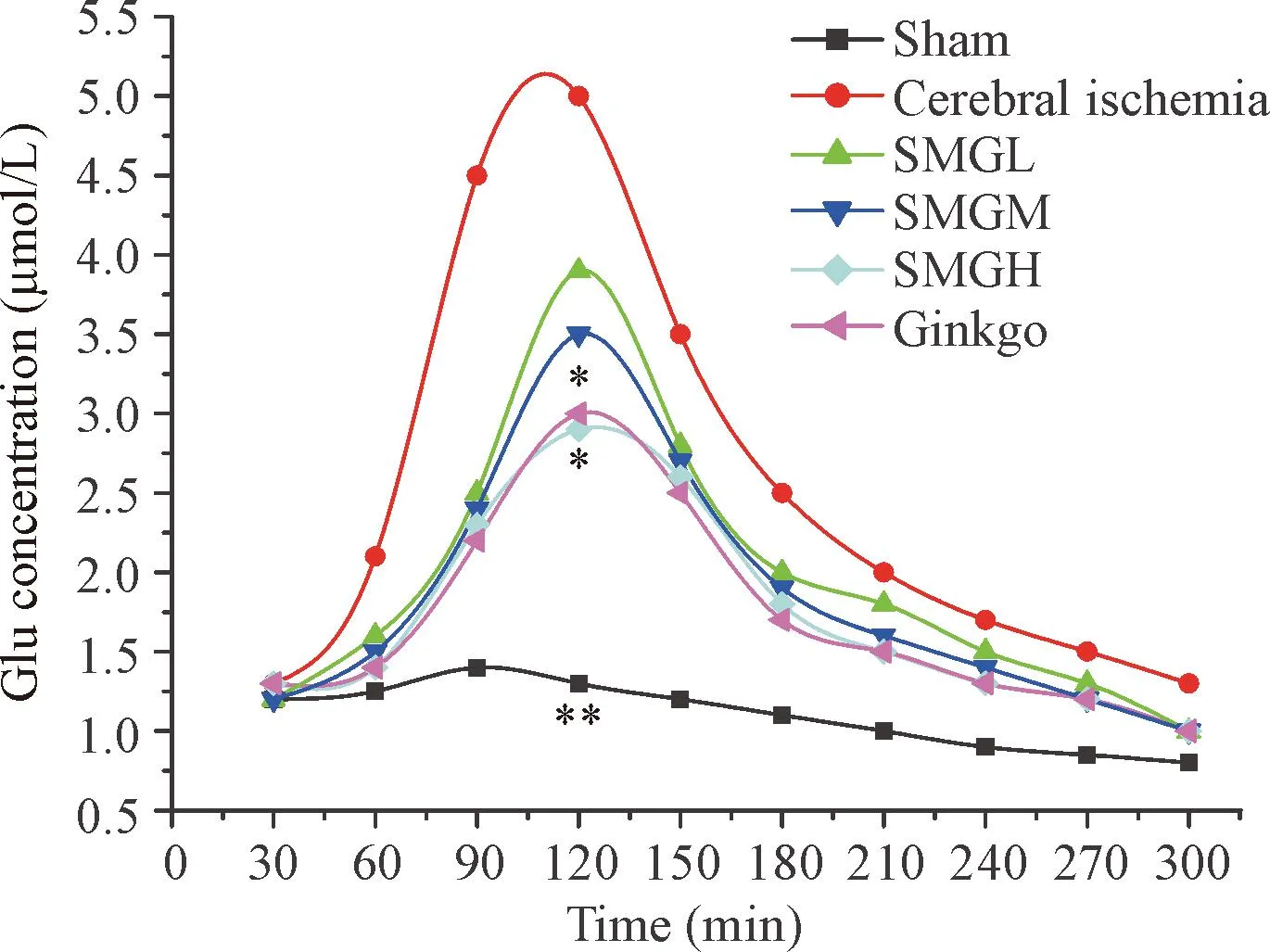
Figure 2.Effects of cimicifugoside H-1 at different doses on the content of glutamic acid (Glu) in striatum of rats with cerebral ischemia. Mean±SD.n=8.*P<0.05,**P<0.01vscerebral ischemia group at 2 h.
图2升麻苷H-1不同剂量组对脑缺血大鼠纹状体区Glu浓度随时间变化的影响
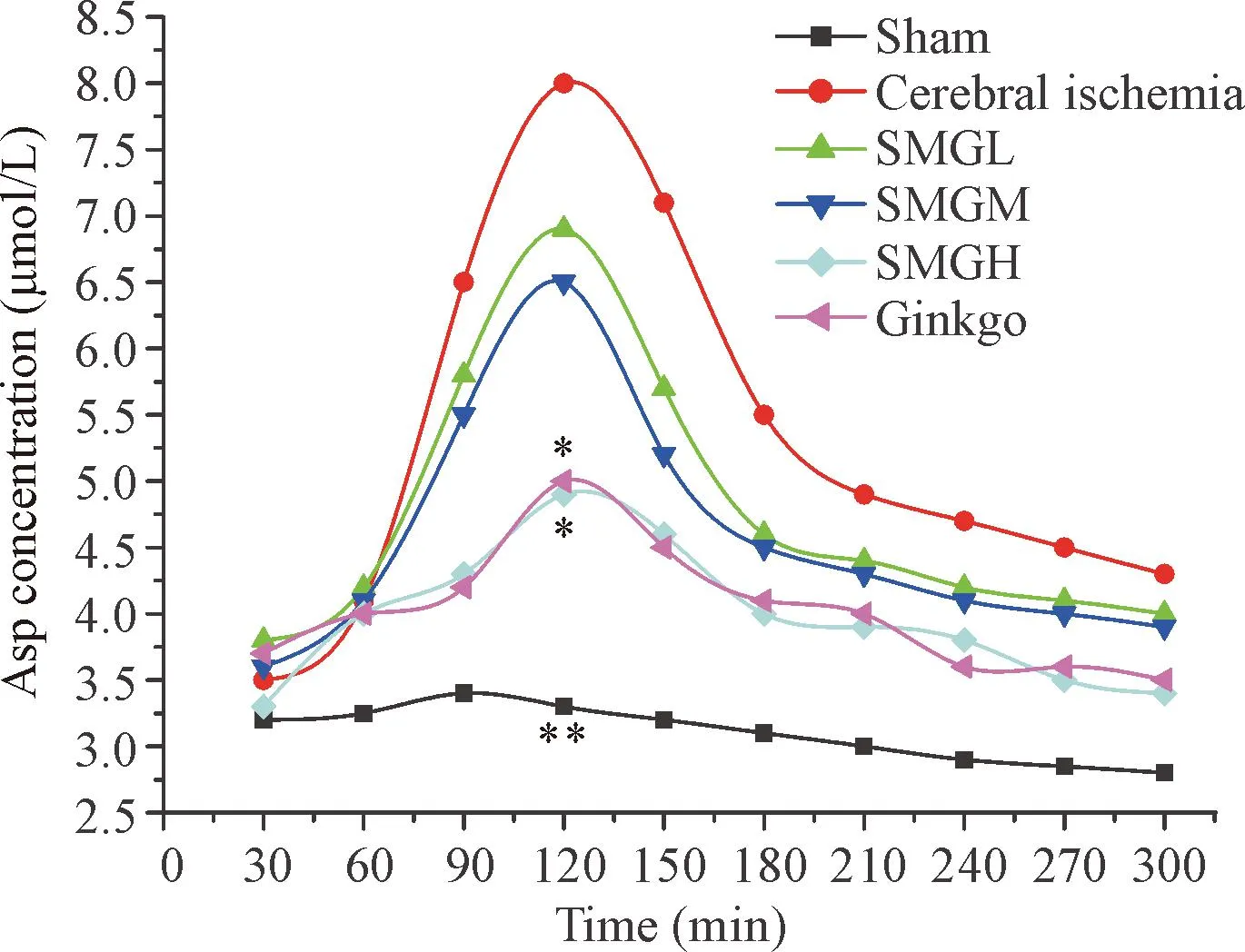
Figure 3.Effects of cimicifugoside H-1 at different doses on the content of aspartic acid (Asp) in striatum of rats with cerebral ischemia. Mean±SD.n=8.*P<0.05,**P<0.01vscerebral ischemia group at 2 h.
图3升麻苷H-1不同剂量组对脑缺血大鼠纹状体区Asp浓度随时间变化的影响
2升麻苷H-1不同剂量组对脑缺血大鼠纹状体区抑制性氨基酸(GABA 和Gly)浓度变化的比较
与假手术组相比,脑缺血组GABA 和Gly在脑缺血后3 h浓度降到最低(P<0.05),之后逐渐回升。升麻苷H-1高剂量组、金纳多组分别与脑缺血组相比,GABA 和Gly在脑缺血后3 h 显著升高(P<0.05);升麻苷H-1低、中剂量组分别与脑缺血组相比,GABA 和Gly在脑缺血后3 h 没有显著升高,见图4、5。
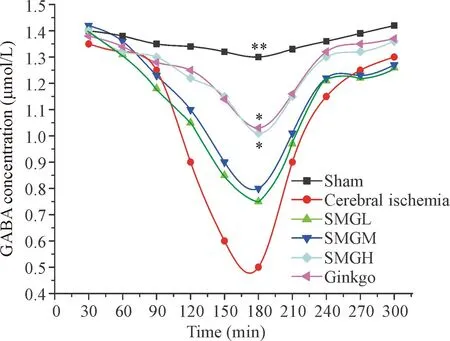
Figure 4.Effects of cimicifugoside H-1 at different doses on the content of γ-aminobutyric acid (GABA) in striatum of rats with cerebral ischemia. Mean±SD.n=8.*P<0.05,**P<0.01vscerebral ischemia group at 3 h.
图4升麻苷H-1不同剂量组对脑缺血大鼠纹状体区GABA浓度随时间变化的影响
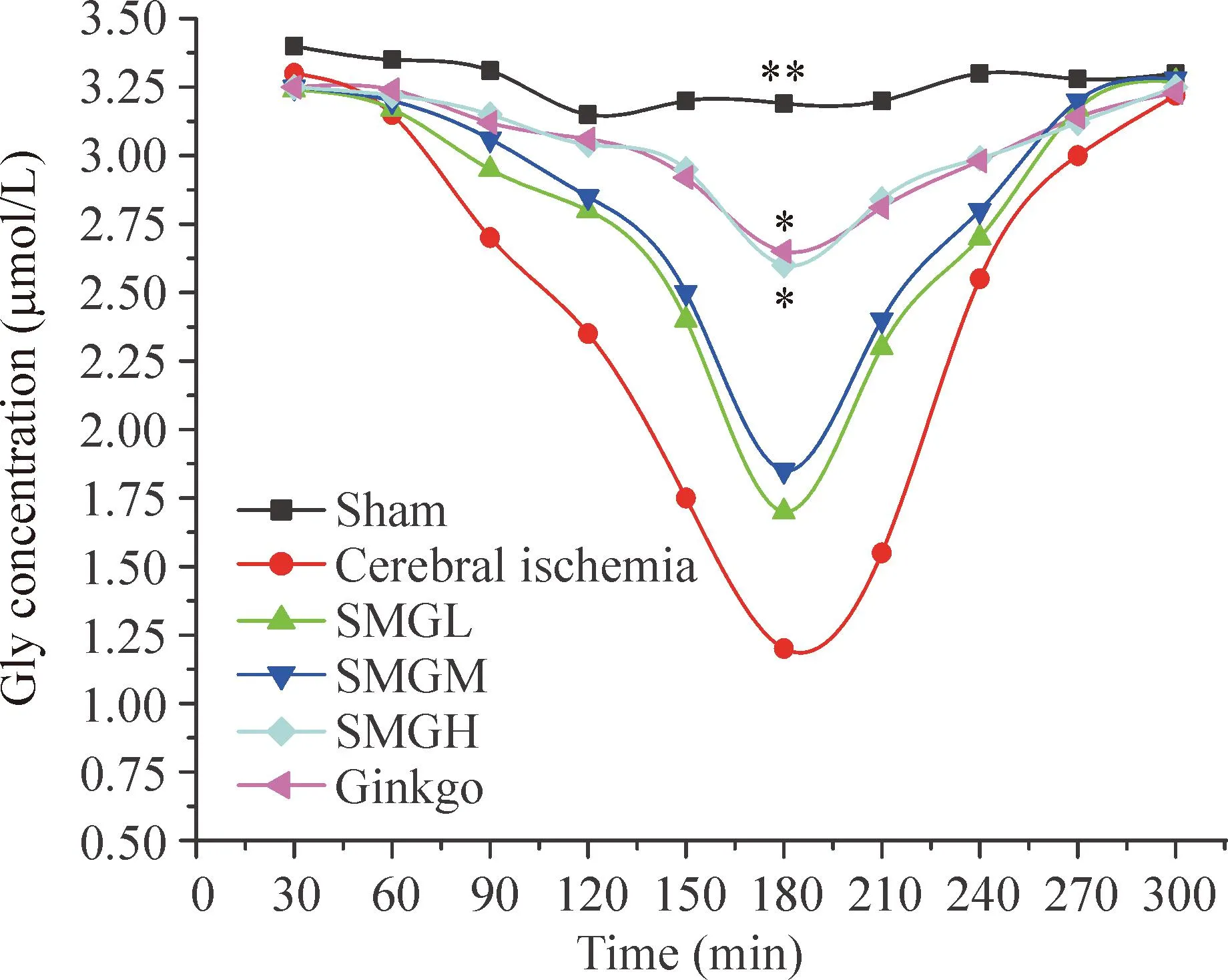
Figure 5.Effects of cimicifugoside H-1 at different doses on the content of glycine (Gly) in striatum of rats with cerebral ischemia. Mean±SD.n=8.*P<0.05,**P<0.01vscerebral ischemia group at 3 h.
图5升麻苷H-1不同剂量组对脑缺血大鼠纹状体区Gly浓度随时间变化的影响
讨论
中枢神经系统内广泛分布着大量的氨基酸,它们在感觉信息传导和完成运动指令等突触的神经递质传递中发挥重要作用。谷氨酸、γ-氨基丁酸、甘氨酸和天门冬氨酸是脑内主要的氨基酸(其中GABA主要是三羧酸循环中的Glu在谷氨酸脱羧酶诱导下生成的),根据其对突触后神经元的兴奋或抑制作用,可分为兴奋性氨基酸和抑制性氨基酸两类。
兴奋性氨基酸Glu和Asp对缺血性脑损伤起重要作用[11]。生理条件下,Glu 主要作为兴奋性突触的神经递质,同时又是GABA 的前体物质。若Glu浓度过高,则产生神经毒性,神经元及神经胶质细胞膜上的Glu 转运体在Glu毒性发生之前能很快清除突触释放的Glu[12]。Glu 发挥作用主要是通过两类受体介导。一类是离子型受体(iGluRs),属于配体门控性离子通道,介导快信号传递,根据激动剂不同分为3种受体,即N-甲基-D-天冬氨酸(N-methy-D-aspartate,NMDA)、α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid,AMPA)和海人藻酸。NMDA 受体对Ca2+有通透性,多存在于由皮质到纹状体的投射神经元中;AMPA 受体对Na+、K+及Ca2+有通透性,多存在于底丘脑核、苍白球内、外侧部等核团中。另一类是代谢型受体(mGluRs),属于G蛋白偶联受体,需要第二信使的介导。mGluRs目前已发现8 个亚型:mGluR1~mGluR8,按其受体蛋白的序列同源性,可分为3 组,第1组包括mGluR1和mGluR5,作用是抑制超极化电流,使神经元兴奋性增高;第2组包括mGluR2与mGluR3,激活G蛋白门控的内向整流K+通道使神经元发生超极化,兴奋性降低;第3组包括mGluR4和mGluR6,7,8,可通过突触调制改变Glu 自身及GABA 的释放及突触的可塑性,间接改变神经元的电活动。脑缺血后,首先出现Ca2+依赖性的氨基酸神经递质释放,而后能量丧失可使细胞膜内外离子浓度比例失衡,胞内Na+及胞外K+浓度的升高使非Ca2+依赖性的Glu 转运体功能翻转[13],使神经元及胶质细胞Glu外溢,胞外含量上升;除了缺血中心出现组织坏死,缺血区域周围的神经细胞也出现缓慢坏死;Glu过度释放通过激动NMDA、AMPA受体和代谢性谷氨酸受体,影响离子通道;不适当的Ca2+内流引起神经细胞坏死或者凋亡,造成脑缺血损害。
抑制性氨基酸GABA和Gly对脑缺血损伤后果有明显影响[14]。GABA受体可分为促离子型受体(GABAa 受体)与促代谢型受体(GABAb 受体)。GABAa受体是一种配体门控的Cl-通道,位于中枢突触后膜,通过与GABA 结合,增加Cl-在神经细胞膜内外的流动,兴奋时Cl-内流增加,诱发去极化,兴奋性下降,产生早抑制性突触后电位。GABAb 为G 蛋白偶联受体,兴奋时K+通道增加,减少Ca2+内流。抑制性氨基酸的增加可抑制神经元兴奋,减少由于兴奋性氨基酸造成的神经细胞损伤。
BBB是影响中枢神经系统药物作用的主要障碍。毛茛科植物大三叶升麻,入脾、胃、肺、大肠经,在补中益气汤中作为向上升提的药引子“升清阳之气”,使下陷之清阳上升而恢复其本位。脑为至清至高之清灵之体,脑为气血精华汇集之处。从中药升降浮沉的作用趋势看:升浮药向上、升阳、开窍均可“归经入脑”。升麻是否能升清阳而“归经入脑”?
金纳多是治疗脑缺血有效药物,与升麻苷同属于苷类,有可比性,故用作对照治疗。本实验发现,升麻苷H-1不仅能透过BBB,还可以抑制脑缺血时兴奋性氨基酸的过度释放,减少由于兴奋性氨基酸造成的神经细胞损伤,同时增加抑制性氨基酸的浓度,抑制神经元兴奋,对缺血脑组织神经元有一定的保护作用。详细的药理学机制仍需进一步研究。
[参考文献]
[1]张仲明,江波. 脑缺血治疗药物的研究进展[J].中国现代应用药学杂志,2006,23(1): 24-27.
[2]吴德松,卿晨.升麻药理学活性研究进展[J].医学综述,2009,15(6):918-920.
[3]林玉萍,邱明华,李忠荣. 升麻属植物的化学成分与生物活性研究[J].天然产物研究与开发,2002,14(6): 58-68.
[4]刘颖,张小茜.升麻质量标准的研究[J].中草药,2005,36(9):1402-1404.
[5]潘瑞乐,陈迪华,沈连钢.高效液相色谱法测定中药升麻中阿魏酸和异阿魏酸的含量[J].药物分析杂志,2000,20(6):396-398.
[6]姚梅芬,王岳峰,李展,等. 反相高效液相色谱法测定升麻药材中升麻苷H-1 的含量[J].天然产物研究与开发,2011,23(4):696-699.
[7]余自成,陈红专. 微透析技术在药物代谢和药代动力学研究中的应用[J].中国临床药理学杂志,2001,17(1):76-80.
[8]Koeda M, Aoki Y, Sakurai N, et al. Studies on the Chinese crude drug “shoma.” IX. Three novel cyclolanosta-nol xylosides, cimicifugosides H-1, H-2 and H-5, from cimicifuga rhizome[J]. Chem Pharm Bull (Tokyo), 1995,43(5):771-776.
[9]朱继,万东,唐文渊. 改良线栓法制备大鼠局灶脑缺血模型[J].第四军医大学学报,2008,29(8):685-687.
[10]Nie B, Chen K, Zhao S, et al. A rat brain MRI template with digital stereotaxic atlas of fine anatomical delineations in paxinos space and its automated application in voxel-wise analysis[J]. Hum Brain Mapp, 2013,34(6):1306-1318.
[11]Olney JW. Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate[J]. Science, 1969,164(3880): 719-721.
[12]Schousboe A. Transport and metabolism of glutamate and GABA in neurons are glial cells[J]. Int Rev Neurobiol, 1981,22:1-45.
[13]Asai S, Iribe Y, Kohno T, et al. Real time monitoring of biphasic glutamate release using dialysis electrode in rat acute brain ischemia[J]. Neuroreport, 1996,7(5):1092-1096.
[14]赵彤,王福庄,黄燕华,等.GABA 对大鼠海马脑片缺氧损伤的保护作用[J]. 中国应用生理学杂志,2003,19(1):16-19.
(责任编辑: 卢萍, 罗森)
Effect of cimicifugoside H-1 on amino acid neurotransmitters in striatum of rats with cerebral ischemia
WU Mi-shan1, ZHAO Su-zhi2, GAO Wei-juan3, WANG Ru1, HAN Hong-wei1, SHI Xu-liang1
(1DepartmentofFormulaology,BasicMedicineCollege,HebeiUniversityofChineseMedicine,Shijiazhuang050200,China;2Chang’anDistrictShengbeiCommunityHealthCenterofShijiazhuang,Shijiazhuang050041,China;3HebeiKeyLaboratoryofChineseMedicineonCardio-CerebrovascularDisease,Shijiazhuang050091,China.E-mail:wumishan6@sina.com)
[ABSTRACT]AIM: To study the neuroprotective effect of cimicifugoside H-1 and to explore the mechanism involved by determining the variation of amino acid neurotransmitters in extracellular fluid in the striatum of rats with cerebral ischemia. METHODS: The rats were randomly divided into sham-operated, cerebral ischemia, high-, middle- and low-dose cimicifugoside H-1, and ginkgo groups. Focal cerebral ischemia model was established by middle cerebral artery occlusion (MCAO) with sutures. Normal saline was intraperitoneally injected into the rats in sham-operated group and cerebral ischemia group, while ginkgo and different doses of cimicifugoside H-1 were injected into the rats in ginkgo group and high-, middle- and low-dose cimicifugoside H-1 groups, respectively, once a day for 7 d. The striatal fluids were gained in vivo by brain microdialysis. The contents of aspartic acid, glutamic acid, glycine and γ-aminobutyric acid were tested by high-performance liquid chromatography electrochemical detector system. RESULTS: Compared with sham-operated group, the contents of excitatory amino acids (aspartic acid and glutamic acid) were significantly increased 2 h after cerebral ischemia (P<0.05). Compared with cerebral ischemia group, the contents of aspartic acid and glutamic acid were significantly decreased 2 h after cerebral ischemia in high-dose cimicifugoside H-1 and ginkgo groups (P<0.05). Compared with cerebral ischemia group, the contents of aspartic acid and glutamic acid did not show significant decrease 2 h after cerebral ischemia in middle- and low-dose cimicifugoside H-1 groups. Compared with sham-operated group, the contents of inhibitory amino acid (γ-aminobutyric acid and glycine) were significantly decreased 3 h after cerebral ischemia in cerebral ischemia group (P<0.05). Compared with cerebral ischemia group, the contents of γ-aminobutyric acid and glycine were significantly increased 3 h after cerebral ischemia in high-dose cimicifugoside H-1 and ginkgo groups (P<0.05). Compared with cerebral ischemia group, the contents of γ-aminobutyric acid and glycine did not show significant decrease 3 h after cerebral ischemia in middle- and low-dose cimicifugoside H-1 groups. CONCLUSION: Cimicifugoside H-1 restrains the excessive releases of excitatory amino acids and increases the contents of inhibitory amino acids during cerebral ischemia. It doesn’t only penetrate through the blood brain barrier, but also regulates the disorder of excitatory amino acid during cerebral ischemia, thus showing the protective function to cerebral neuron during cerebral ischemia.
[KEY WORDS]Cerebral ischemia; Cimicifugoside H-1; Microdialysis; Aspartic acid; Glutamic acid; Glycine; γ-Aminobutyric acid
[文章编号]1000- 4718(2016)05- 0831- 05
[收稿日期]2015- 11- 12[修回日期] 2016- 02- 12
*[基金项目]国家自然科学基金资助项目(No.81073074;No.30472200);河北省自然科学基金资助项目(No.H 2013206005);河北省高等学校科学技术研究重点项目(No.ZD2015053);河北省高等学校高层次人才科学研究项目(No.GCC2014013)
通讯作者△Tel: 0311-89926738; E-mail: wumishan6@sina.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.010
杂志网址: http://www.cjpp.net
