N-乙酰半胱氨酸联合阿奇霉素对慢性阻塞性肺疾病模型大鼠氧化应激的影响*
2016-06-06罗裕文陈宜泰黄玉霞
李 允, 李 硕, 罗裕文, 陈宜泰, 黄玉霞, 王 凯, 陈 新
(南方医科大学珠江医院呼吸内科, 广东 广州 510282)
N-乙酰半胱氨酸联合阿奇霉素对慢性阻塞性肺疾病模型大鼠氧化应激的影响*
李允,李硕,罗裕文,陈宜泰,黄玉霞,王凯,陈新△
(南方医科大学珠江医院呼吸内科, 广东 广州 510282)
[摘要]目的: 探讨N-乙酰半胱氨酸(NAC)联合阿奇霉素(AZI)对慢性阻塞性肺疾病(COPD) 模型大鼠氧化应激的影响。方法: 将60只雄性Wistar大鼠随机分为5组,即正常对照(control)组、模型(model)组、AZI治疗组、NAC治疗组和联合治疗组(AZI+NAC组)。采用烟熏联合气管内滴入脂多糖的方法诱导大鼠COPD模型。 NAC组和AZI组大鼠每日烟熏前30 min分别给予NAC和AZI灌胃,AZI+NAC组则给予NAC和AZI联合灌胃。第31天行肺功能检测后处死大鼠,提取支气管肺泡灌洗液(BALF)进行细胞计数,并采用ELISA法测定BALF中白细胞介素-8(IL-8)、白细胞介素-17(IL-17)和肿瘤坏死因子-α(TNF-α)的含量。制作肺组织切片及肺匀浆,测定肺匀浆超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)水平。结果: 与control组对比,其余4组均出现肺功能的下降,组织病理提示炎症细胞浸润、肺泡破坏等表现。与control组比较,其余4组BALF中白细胞总数、单核巨噬细胞、中性粒细胞和淋巴细胞均显著增高(P<0.05);与model组、AZI组、NAC组比较,AZI+NAC组BALF中白细胞总数、中性粒细胞和淋巴细胞均显著下降(P<0.05)。与model组对比,AZI组、NAC组和AZI+NAC组IL-8、IL-17、TNF-α和MDA含量均显著降低(P<0.05),SOD和GSH-Px活性均显著增高(P<0.05);与AZI组和NAC组比较,AZI+NAC组IL-8、IL-17、TNF-α和MDA含量均下降,SOD和GSH-Px活性均增高,差异有统计学显著性(P<0.01)。结论: NAC和AZI均能减轻COPD模型大鼠肺部炎症和氧化损伤,两者联合能增强抗氧化作用,可能更适合COPD的临床治疗。
[关键词]慢性阻塞性肺疾病; N-乙酰半胱氨酸; 阿奇霉素; 氧化应激; 促炎细胞因子
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的慢性呼吸道疾病,氧化/抗氧化失衡在其发病机制中起重要作用[1-2]。因此,调节氧化应激可能改变疾病的病程,有望成为COPD治疗的新靶点。目前研究发现,长期小剂量应用大环内酯类抗生素[3-5][如阿奇霉素(azithromycin,AZI)、红霉素等]或较大剂量的黏液溶解剂诸如N-乙酰半胱氨酸(N-acetylcysteine,NAC)[6-8]均能有效减少COPD急性加重的频率,延缓患者肺功能减退,提高患者的活动耐力及生活质量,而其确切的作用机制尚不清楚,可能与抑制吞噬细胞(如中性粒细胞)的氧化爆发,抑制炎性细胞炎性介质、细胞因子的释放,增加抗氧化物的水平,纠正氧化/抗氧化系统失衡有关。我们设想,在治疗COPD时,联合应用AZI和NAC这2种不同种类的药物,可能发挥协同作用,增强抗炎作用和抗氧化能力,进一步提高临床疗效,但目前尚缺乏相关实验性研究。为证实上述猜想,本实验通过烟熏及气道内滴注脂多糖的方法构建COPD大鼠模型,观察联合药物干预对炎症介质如TNF-α、IL-8、IL-17以及反映氧化损伤的超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)的影响。
材料和方法
1材料
1.1动物雄性Wistar大鼠60只,6~8周龄,体质量(200±20)g,由南方医科大学实验动物中心提供,动物合格证号:2014-0014。饲养条件:每日光照12 h,常温,健康状况良好。将大鼠按照随机数字表分为5组,即正常对照组(control组)、模型组(model组)、阿奇霉素治疗组(AZI组)、NAC治疗组(NAC组)和联合治疗组(AZI+NAC组),每组12只。实验过程中,model组和NAC组各死亡1只。
1.2药物、试剂及仪器阿奇霉素(辉瑞制药有限公司);NAC(海南赞邦制药有限公司);脂多糖(河南辅仁怀庆堂制药);红旗渠牌烤烟型香烟(焦油和尼古丁含量分别为每支14 mg和 1.1 mg,河南安阳卷烟厂)。TNF-α、IL-8和IL-17酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉博士德生物工程有限公司)。GSH-Px测试盒、SOD试剂盒及MDA试剂盒均购自南京建成生物工程研究所。小动物肺功能测定仪(北京悦宏达责任有限公司);自制有机玻璃熏烟箱(50 cm×50 cm×40 cm)。
2方法
2.1COPD模型的建立 大鼠放置于有机玻璃舱内熏香烟,每天2次,每次1.5~2 h(2次间隔6 h以上),每次点烟器中放置20根香烟,每5根香烟轮流点燃并燃烧充分。第2~13 天、15~30天连续被动吸烟,第1、14天气管内滴入LPS。滴入LPS的操作方法如下:将大鼠用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,仰卧固定于操作台上,正中切开颈前皮肤,钝性分离皮下组织,暴露气管,以拔除针芯的16号静脉套管针,快速插入气管,取溶于注射用生理盐水的LPS(1 g/L)200 μL,通过静脉套管针分别快速注入model组、AZI组、NAC组和AZI+NAC组大鼠气管内,注药完毕后迅速将大鼠直立并旋转10 s,使药液在肺内分布均匀,然后拔出套管针。每日上午烟熏前30 min,NAC组给予NAC(400 mg/kg)灌胃;AZI组给予阿奇霉素(400 mg/kg)灌胃;AZI+NAC组则给予NAC和阿奇霉素联合灌胃,直至第30天。
2.2肺功能的测定在实验结束后次日(第31天),测定大鼠第0.3 s用力呼气量(forced expiratory volume in 0.3 second, FEV0.3)与用力肺活量(forced vital capacity, FVC)比值、动态顺应性(dynamic compliance, Cdyn)和呼气阻力(expiratory resistance, Re)。因FEV0.3与FEV0.3/FVC的测定需要实验动物的配合,故采用外加压力法迫使大鼠深呼气和深吸气,将大鼠仰卧位置于呼吸仪的密闭体描箱内,描记一段平静呼吸后,在呼气末用注射器经三通管迅速以相当于潮气量的5倍量充气(相当于深吸气),然后立即脱开,连接负压(-35 cmH2O)抽气(相当于深呼气),所引起的容积变化,经微机处理后即得出各项肺功能指标。
2.3大鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)提取及BALF中细胞计数、炎症介质测定肺功能测定结束后,处死大鼠,分离出大鼠气管和双肺,结扎右肺门,在气管下段作一小T形切口,将气管插管缓缓插入,直至抵达左主支气管下端分叉处。用注射器吸取3 mL 0.9%氯化钠溶液,通过导管以较小的压力将盐水缓慢注人肺内,可见大鼠左肺逐渐变得膨隆、苍白,立即缓慢回抽灌洗液,再将所得液体缓缓注回肺内,如此反复3次,回抽出至少2 mL的BALF,盛入15 mL的塑料离心管(置于冰浴中),此为第1次灌洗,然后重复3次上述操作(所有大鼠BALF的回收率保持在70%~80%)。所有标本计量后,离心半径为10 cm条件下,以1 500 r/min离心10 min,取上清液置入-80 ℃冰箱中保存,使用ELISA试剂盒检测BALF中TNF-α、IL-8和IL-17的含量,严格按照试剂盒的说明书进行操作。细胞用预冷Hanks液洗涤3次后,用血细胞计数板做细胞计数。
2.4病理标本制作及肺组织匀浆制备由于左肺已行肺泡灌洗,为减少灌洗可能带来的影响,故在每只大鼠右肺不同部位取2块组织(约1 cm×1 cm×0.5 cm),用4%多聚甲醛灌注固定,石蜡包埋,HE染色,分析肺组织结构的形态学变化,测定肺平均内衬间隔(mean lining interval, MLI)和平均肺泡数(mean alveolar number, MAN)。每只大鼠随机选取2张肺组织HE染色病理切片,每张切片随机选取上、中、下、左和右5个视野(避开大血管和支气管),显微镜下(×100)观察,在每个视野中央划“十”字交叉线,计算与交叉线相交的肺泡间隔数(number of alveolar septum, Ns)和测量十字线的总长度(length, L),以L/Ns即得MLI,其数值反映肺泡平均直径;计数每个视野内肺泡数(number of alveolar, Na)和每个视野的面积(surface area, S),以Na/S即得MAN,其数值反映肺泡密度。此外,取右肺组织1.0 g,在预冷的生理盐水中漂洗,用滤纸拭干,制备成10%的肺匀浆4 ℃、2 000 r/min离心10 min,收集上清液,测定SOD、GSH-Px和MDA。
3统计学处理
采用SPSS 20.0软件进行统计学分析。计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两两间比较用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1造模后肺功能变化
与control组比较,其余4组FEV0.3/FVC和Cdyn均明显降低,Re均明显升高(P<0.05);与model组比较,AZI组、NAC组和AZI+NAC组FEV0.3/FVC、Cdyn和Re均有改善(P<0.05);AZI组、NAC组和AZI+NAC组间比较无显著差异,见表1。
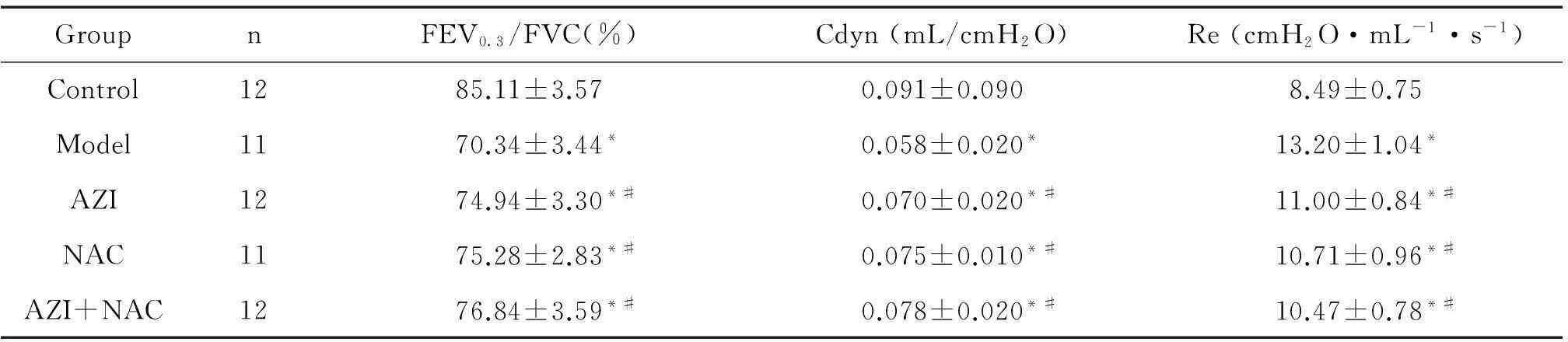
表1 各组大鼠肺功能的比较
*P<0.05 vs control group;#P<0.05 vs model group.
2造模后肺组织病理改变
Control组肺泡结构正常连续,小支气管未见腺体及炎症细胞浸润,肺泡壁完整。Model组肺泡结构紊乱,肺泡壁变薄或断裂,肺泡弹性减弱,呈囊状扩张,肺泡腔扩大,部分融合成肺大疱;同时伴有支气管管壁及周围部分单核细胞和淋巴细胞浸润。与model组相比,AZI组、NAC组和AZI+NAC组的肺泡破坏程度相对减轻,见图1。Control组、model组、AZI组、NAC组和AZI+NAC组的MLI值(μm)依次为:40.26±5.42、81.27±9.17、63.17±7.14、60.70±8.03和51.90±8.72,其中药物干预组MLI值均显著低于model组,AZI+NAC组MLI值低于AZI组和NAC组(P<0.05)。4组的MAN值(mm-2)依次为:208.06±19.68、95.98±12.32、122.29±16.51、117.51±16.46和141.33±14.95,其中药物干预组MAN值均显著高于model组,AZI+NAC组MLI值高于AZI组和NAC组(P<0.05)。
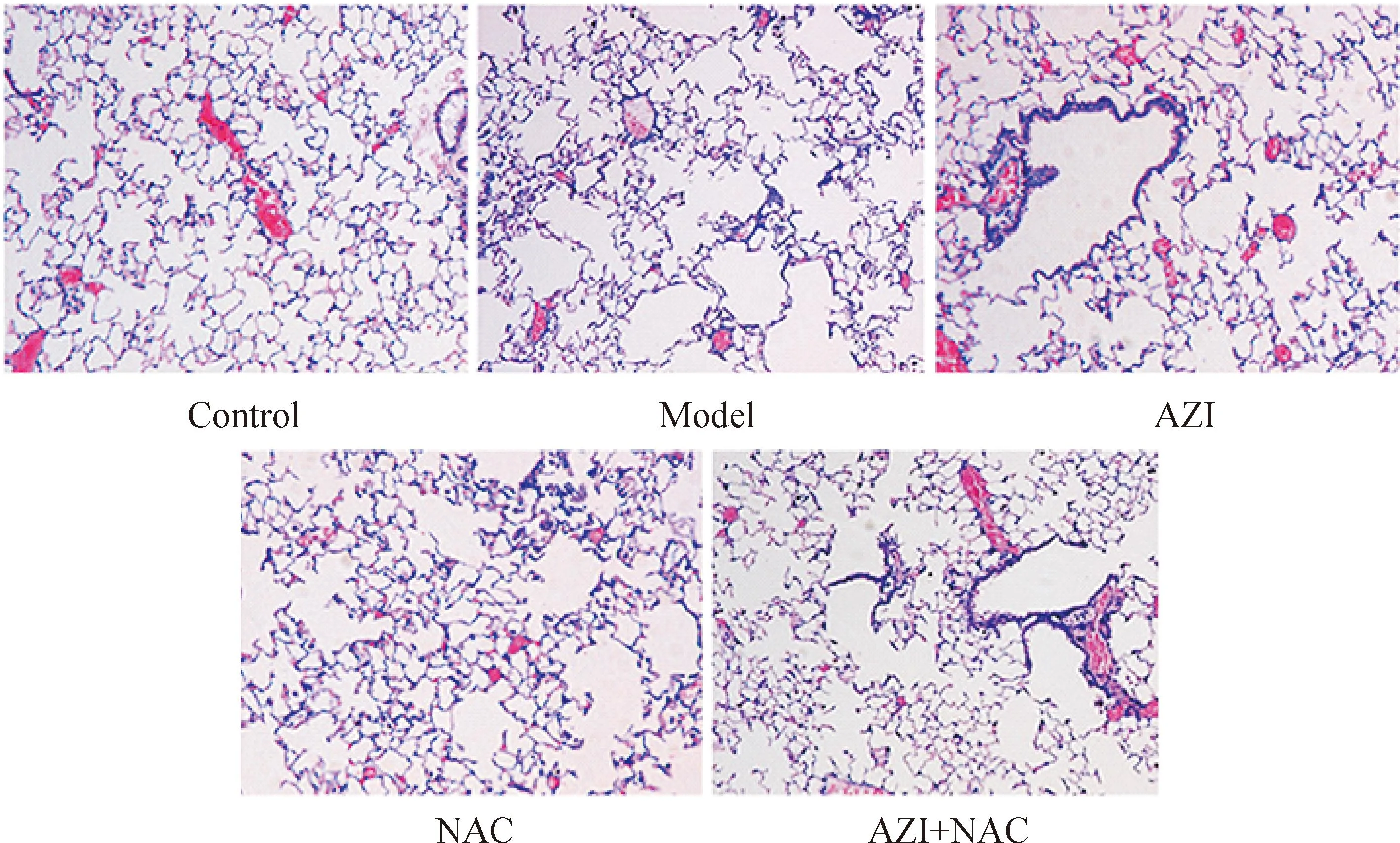
Figure 1.Pathological changes of lung tissue in different groups (HE staining, ×100).
图1各组大鼠肺组织病理学光镜下观察
3联合用药对BALF中细胞计数及炎症介质的影响
与control组比较,其余4组BALF中白细胞总数及单核巨噬细胞、中性粒细胞、淋巴细胞绝对数均显著增高(P<0.05);AZI组和NAC组各细胞计数比较差异无统计学显著性;与model组、AZI组和NAC组比较,AZI+NAC组BALF中的白细胞总数及中性粒细胞、淋巴细胞数均显著下降,单核巨噬细胞数显著上升(P<0.05)。与control组比较,其余4组BALF中的IL-8、IL-17和TNF-α均显著上升(P<0.05);与model组比较,AZI组、NAC组和AZI+NAC组上述炎症因子均显著降低(P<0.05);与AZI组和NAC组比较,AZI+NAC组上述炎症因子均显著下降(P<0.05),见表2、3。
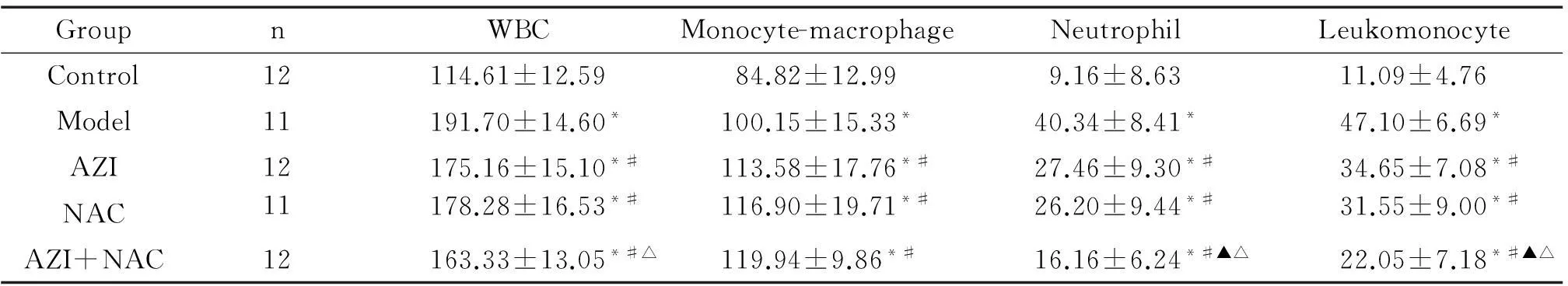
表2 联合用药对BALF中炎症细胞的影响
*P<0.05 vs control group;#P<0.05 vs model group;▲P<0.05 vs AZI group;△P<0.05 vs NAC group.

表 3 联合用药对BALF炎症因子的影响
*P<0.05 vs control group;#P<0.05 vs model group;▲P<0.05 vs AZI group;△P<0.05 vs NAC group.
4联合用药对肺匀浆中SOD、GSH-Px活性和MDA含量的影响
与control组比较,其余4组SOD和GSH-Px活性均显著降低,MDA含量显著升高(P<0.05);与model组比较,AZI组、NAC组和AZI+NAC组SOD和GSH-Px活性均显著增高,MDA含量显著降低(P<0.05);AZI+NAC组SOD和GSH-Px活性均高于AZI组和NAC组,MDA含量均低于AZI组和NAC组,上述差异有统计学显著性(P<0.05),见表4。

表 4 联合用药对氧化损伤产物的影响
*P<0.05 vs control group;#P<0.05 vs model group;▲P<0.05 vs AZI group;△P<0.05 vs NAC group.
讨论
吸烟是导致COPD的重要危险因素。在实验研究中,常常通过被动吸烟的方法建立COPD动物模型。然而,单独使用烟熏诱发肺气肿所需的时间较长,因此近年来更常用香烟烟熏结合LPS的造模方法。判断COPD模型是否成功的指标,一般都用病理组织学的方法,但由于持续气流受限是COPD的重要特征,采用病理和肺功能测定相结合的方法,可能对动物COPD模型的判断更为准确。本研究通过参照文献的经典方法[9],熏香烟加气管注内毒素,成功构建了COPD大鼠模型,其病理形态学和肺功能改变均与人类COPD改变相似。
本实验进一步探讨了氧化应激在COPD发病机制中的作用。香烟中存在大量的氧化剂,活化的炎症细胞也产生内源性氧化剂,活性氧物质生成增多将修饰脂质和蛋白质,导致脂质过氧化和硫醇基氧化,改变细胞膜的通透性,导致严重的组织损伤。MDA是一个广泛用于脂质过氧化的标志物,在COPD患者肺组织中也明显升高[10]。氧化负荷增加刺激炎症介质表达,IL-8、IL-17、TNF-α等促炎细胞因子介导炎症细胞在气道局部聚集和激活,激活的炎症细胞及细胞因子相互作用,形成复杂的细胞因子网络,促进炎症进一步发展[2]。其中IL-17在COPD的发生、发展中起着重要作用[11-13],其与受体结合后通过MAPK、核因子κB和Janus激酶/信号转导途径,介导中性粒细胞的募集和激活,是近年来的研究热点。本研究显示,烟熏和LPS诱导下,大鼠BALF中炎症细胞、IL-8、IL-17和TNF-α含量均有升高,提示COPD发病过程中炎症反应的增强。在促进炎症反应的同时,机体也会启动自我保护性调节机制,上调抗氧化物质的表达,起到代偿性防御作用。SOD和GSH-Px是体内重要的氧自由基清除剂,二者对肺组织有保护作用。我们的结果也显示,建立COPD模型后,MDA升高,SOD和GSH-Px活性下降。COPD的发病由多种炎症细胞、炎症介质及氧化损伤参与并相互作用,中性粒细胞在气道腔内聚集、活化、释放蛋白酶等多种酶类及氧自由基等,导致肺组织损伤[14]。因此,抑制肺部炎症,增强抗氧化能力,可能减轻烟熏和LPS对COPD的损伤。
本研究通过使用阿奇霉素和N-乙酰半胱氨酸作为干预药物,证实了2种药物对COPD氧化应激的作用。大环内酯类药物除了抑菌作用外,还有独特的免疫调节功能,其最早应用于支气管囊性纤维化、弥漫性泛细支气管炎的治疗[15-16],已取得了良好的临床疗效。通过大环内酯类药物阻断炎症因子的激活及其生物学效应,可能阻止COPD的发展,也是当前防治COPD的研究热点。阿奇霉素为半合成的十五元环大环内酯类抗生素,可与细菌核糖体50S亚基结合,通过中断细菌的蛋白质合成而阻止细菌生跃、繁殖,具有安全、有效、口服方便的优点。目前国内外不少研究已经证实了阿奇霉素在稳定期COPD患者中的作用,这可能与大环内酯类药物抑制中性粒细胞的氧化爆发和炎症介质释放有关[17]。NAC作为抗氧化剂,分子中含有活性巯基(—SH),可对抗不同原因所致的组织氧化损伤,在治疗稳定期COPD方面也有一定疗效。本研究显示,与造模组比较,使用阿奇霉素或N-乙酰半胱氨酸治疗后IL-8、IL-17和TNF-α含量均降低,提示2种药物均能抑制炎症介质的释放;同时,SOD和GSH-Px活性提高,MDA含量出现降低,提示2种药物均能增强体内清除氧自由基的能力,减少脂质过氧化生成的MDA,发挥对肺组织保护作用。值得注意的是,NAC为GSH的前体,能提高细胞内谷胱甘肽生物合成,属体内氧自由基清除剂,从理论上来说,其抗氧化的效果要优于阿奇霉素,但本研究显示两者差异尚无统计学显著性,可能与灌胃生物利用度偏低、样本量偏小等因素有关。
由上可以推测,2种药物对COPD有抗炎作用,可能与抑制中性粒细胞聚集与活化,减少TNF-α、IL-8、IL-17等炎症介质的释放有关;对COPD有抗氧化损伤作用,其机制与提高SOD和GSH-Px活性,减少MDA生成有关。研究结果显示,N-乙酰半胱氨酸联合阿奇霉素能显著降低COPD模型大鼠肺部炎症和氧化损伤的程度,较单一药物效果更加显著,这提示两者联合用于大鼠COPD治疗时有协同作用,增强氧化/抗氧化平衡的调节能力,可能更适用于COPD临床治疗。但本研究为动物实验,且样本量偏少,两种药物联合治疗COPD的疗程、药物的剂量构成有待进一步研究。
[参考文献]
[1]Kirkham PA, Barnes PJ. Oxidative stress in COPD[J]. Chest, 2013, 144(1):266-273.
[2]Lin JL, Thomas PS. Current perspectives of oxidative stress and its measurement in chronic obstructive pulmonary disease[J]. COPD, 2010, 7(4):291-306.
[3]Simoens S, Laekeman G, Decramer M. Preventing COPD exacerbations with macrolides: a review and budget impact analysis[J]. Respir Med, 2013, 107(5):637-648.
[4]Herath SC, Poole P. Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD)[J]. Cochrane Database Syst Rev,2013,11:CD009764.
[5]Ni W, Shao X, Cai X, et al. Prophylactic use of macrolide antibiotics for the prevention of chronic obstructive pulmonary disease exacerbation: a meta-analysis[J]. PLoS One, 2015, 10(3):e121257.
[6]Tse HN, Raiteri L, Wong KY, et al. Benefits of high-dose N-acetylcysteine to exacerbation-prone patients with COPD[J]. Chest, 2014, 146(3):611-623.
[7]Shen Y, Cai W, Lei S, et al. Effect of high/low dose N-acetylcysteine on chronic obstructive pulmonary disease: a systematic review and meta-analysis[J]. COPD, 2014, 11(3):351-358.
[8]Cazzola M, Calzetta L, Page C, et al. Influence ofN-acetylcysteine on chronic bronchitis or COPD exacerbations: a meta-analysis[J]. Eur Respir Rev, 2015, 24(137):451-461.
[9]李红梅,崔德健,佟欣,等. 熏香烟加气管注内毒素和单纯熏香烟法建立大鼠COPD模型[J]. 中国病理生理杂志,2002,18(7):73-77.
[10]Lee JS, Shin JH, Hwang JH, et al. Malondialdehyde and 3-nitrotyrosine in exhaled breath condensate in retired elderly coal miners with chronic obstructive pulmonary disease[J]. Saf Health Work, 2014, 5(2):91-96.
[11]van der Deen M, Timens W, Timmer-Bosscha H, et al. Reduced inflammatory response in cigarette smoke exposed Mrp1/Mdr1a/1b deficient mice[J]. Respir Res, 2007, 8:49.
[12]Huvenne W, Perez-Novo CA, Derycke L, et al. Different regulation of cigarette smoke induced inflammation in upper versus lower airways[J]. Respir Res, 2010, 11:100.
[13]Zhang X, Zheng H, Zhang H, et al. Increased interleukin (IL)-8 and decreased IL-17 production in chronic obstructive pulmonary disease (COPD) provoked by cigarette smoke[J]. Cytokine, 2011, 56(3):717-725.
[14]Herfs M, Hubert P, Poirrier AL, et al. Proinflammatory cytokines induce bronchial hyperplasia and squamous metaplasia in smokers: implications for chronic obstructive pulmonary disease therapy[J]. Am J Respir Cell Mol Biol, 2012, 47(1):67-79.
[15] Zhou Y, Tan X, Kuang W, et al. Erythromycin ameliorates cigarette-smoke-induced emphysema and inflammation in rats[J]. Transl Res, 2012, 159(6):464-472.
[16]Ramos FL, Criner GJ. Use of long-term macrolide therapy in chronic obstructive pulmonary disease[J]. Curr Opin Pulm Med, 2014, 20(2):153-158.
[17]Taylor SP, Sellers E, Taylor BT. Azithromycin for the prevention of COPD exacerbations: the good, bad, and ugly[J]. Am J Med, 2015,128(12):1362.e1-1362.e6.
(责任编辑: 陈妙玲, 罗森)
Effects ofN-acetylcysteine combined with azithromycin on oxidative stress in rats with chronic obstructive pulmonary disease
LI Yun, LI Shuo, LUO Yu-wen, CHEN Yi-tai, HUANG Yu-xia, WANG Kai, CHEN Xin
(Department of Respiratory Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China. E-mail: chen_xin1020@ 163.com)
[ABSTRACT]AIM: To investigate the effects of N-acetylcysteine (NAC) combined with azithromycin (AZI) on oxidative stress in the rats with chronic obstructive pulmonary disease (COPD). METHODS: Male Wistar rats (n=60) were randomly divided into control group, model group, AZI intervention group,NAC intervention group and AZI+NAC group. The COPD model was established by passive smoking and intratracheal instillation of lipopolysaccharide. Each day 30 min prior to smoking, intragastric administration with AZI, NAC or combination of the 2 drugs was given for AZI, NAC, and AZI+NAC groups, respectively. On the 31st day, all rats were killed following lung function test. Cell counts of bronchoalveolar lavage fluid (BALF) were performed, and the contents of interleukin-8 (IL-8), interleukin-17 (IL-17) and tumor necrosis factor alpha (TNF-α) in BALF were measured by ELISA. The histopathology of the lung tissues was observed under light microscope, and the levels of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malondialdehyde (MDA) in the lung homogenate were measured. RESULTS: Compared with control group, the other 4 groups showed decreased pulmonary function, and inflammatory cell infiltration and alveolar destruction in histopathology. Compared with control group, the other groups showed higher white blood cells, monocyte-macrophages, neutrophils and lymphocytes in the BALF (P<0.05). Compared with model group, AZI group and NAC group, lower white blood cells, neutrophils and lymphocytes in the BALF were observed in AZI+NAC group (P<0.05). Compared with model group, IL-8, IL-17, TNF-α and MDA in AZI group, NAC group and AZI+NAC group significantly decreased (P<0.05), while SOD and GSH-Px significantly increased (P<0.05). Compared with AZI or NAC group, IL-8, IL-17, TNF-α and MDA in AZI+NAC group significantly decreased (P<0.05), while SOD and GSH-Px increased significantly (P<0.05). CONCLUSION: Both NAC and AZI attenuate the lung inflammation and oxidative damage in COPD model rats. Combined medication exerts preferable anti-oxidation effects, which might be more suitable for the treatment of COPD.
[KEY WORDS]Chronic obstructive pulmonary disease; N-acetylcysteine; Azithromycin; Oxidative stress; Proinflammatory cytokines
[文章编号]1000- 4718(2016)05- 0798- 06
[收稿日期]2015- 11- 13[修回日期] 2016- 02- 04
*[基金项目]广东省科技计划(No. 2013B022000072); 广州市科技计划(No. 201507020033)
通讯作者△Tel: 020-62782296; E-mail: chen_xin1020@163.com
[中图分类号]R392.12
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.005
杂志网址: http://www.cjpp.net
