ATP清除剂三磷酸腺苷双磷酸酶对实验性矽肺的干预作用*
2016-06-06苏程程向国安马永强彭守春魏路清姬文婕
苏程程, 向国安, 马永强, 周 欣, 彭守春, 魏路清△, 姬文婕△
(1中国人民武装警察部队后勤学院附属平津医院呼吸与重症医学科, 2天津市心血管重塑与靶器官损伤重点实验室,天津 300162)
ATP清除剂三磷酸腺苷双磷酸酶对实验性矽肺的干预作用*
苏程程1▲,向国安1▲,马永强2,周欣2,彭守春1,魏路清1△,姬文婕1△
(1中国人民武装警察部队后勤学院附属平津医院呼吸与重症医学科,2天津市心血管重塑与靶器官损伤重点实验室,天津 300162)
[摘要]目的: 观察三磷酸腺苷双磷酸酶(apyrase,Apy)对实验性矽肺小鼠肺纤维化的干预作用及可能机制。方法: 160只雄性C57BL/6小鼠,随机分为对照组、矽肺组、Apy组及溶剂组,采用经口咽吸入法给予SiO2悬浊液(50 mg/kg)建立小鼠实验性矽肺模型,对照组给予等量生理盐水。Apy组在造模的同时及造模后4 h采用经口咽吸入法给予Apy(40 mg/kg),溶剂组给予等体积的无菌生理盐水。分别于术后3 h、7 d、14 d和28 d处死小鼠,计算各组小鼠肺指数,采用生物发光法检测小鼠肺组织的ATP含量,采用HE染色和苦味酸-天狼星红染色观察肺组织的病理学变化,采用real-time PCR法检测各组肺组织中Ⅰ型胶原(Col Ⅰ)、Ⅲ型胶原(Col Ⅲ)和转化生长因子β1(TGF-β1)的mRNA表达水平,采用ELISA法测定肺泡灌洗液TGF-β1的蛋白水平。结果: 与对照组相比,模型组和溶剂对照组小鼠的肺指数和胶原含量明显升高,证明矽肺模型制备成功。Apy组与溶剂组相比,肺组织的ATP含量下降,肺组织炎症表现明显减轻,炎症评分显著下降;同时肺指数、胶原容积分数及Col Ⅰ和Col Ⅲ的 mRNA表达水平均显著下降。Apy可以明显下调肺组织中TGF-β1的mRNA表达水平和肺泡灌洗液中TGF-β1蛋白表达水平。结论: Apy可以明显减轻实验性矽肺小鼠肺组织的炎症反应和纤维化,该作用可能与Apy减少肺组织ATP的浓度、下调TGF-β1的表达有关。
[关键词]矽肺; 三磷酸腺苷双磷酸酶; 转化生长因子β1
矽肺是由于长期吸入含游离二氧化硅(silicon dioxide,SiO2)的粉尘引起的职业性肺疾病,通常表现为持续的炎症反应、成纤维细胞增生、过量的胶原沉积最终导致肺间质纤维化[1]。目前,矽肺的发病机制尚未明确,且缺乏有效的治疗措施。三磷酸腺苷(adenosine triphosphate,ATP)是机体组织细胞所需能量的直接来源,且参与各个系统如神经系统、血管系统、免疫系统等细胞之间的信息传递[2-4]。大量研究表明,胞外ATP与多种疾病的发生发展有关,如败血症、肺纤维化等[5-6]。新近研究发现,通过气管滴注三磷酸腺苷双磷酸酶(apyrase,Apy)可以减轻博来霉素诱导的急慢性肺损伤[7],但其对实验性矽肺的干预研究尚未见报道。因此,本研究使用SiO2诱导小鼠矽肺模型,采用ATP清除剂Apy降低肺组织局部ATP的浓度,观察Apy对小鼠矽肺发生发展的影响,以期初步探讨其在矽肺肺纤维化过程中的作用。
材料和方法
1动物
6~8周龄雄性C57BL/6小鼠,购自中国人民解放军军事医学科学院实验动物中心,许可证号为SCXK-(军)2012-0004。小鼠在12 h/12 h光照周期,通风、温度和湿度适宜的清洁级动物室内常规饲养,适应性饲养 1 周后用于实验。
2试剂
三磷酸腺苷双磷酸酶、ATP检测试剂盒和0.5~10 μm SiO2颗粒(Sigma);TRIzol Reagent(Invitrogen);MMLV反转录酶和dNTPs(Promega);SYBR Green实时荧光定量PCR试剂盒(Roche);TGF-β1 ELISA试剂盒(上海索来宝生物技术有限公司);异氟烷(国药准字H19980141,河北一品制药有限公司);其余试剂均为国产分析纯。
3方法
3.1矽肺模型的制备及标本的采集处理将160只C57BL/6小鼠随机分为对照组、矽肺组、Apy组及溶剂组,每组40只。用MIDMARK小动物麻醉罐、2%异氟烷轻度麻醉小鼠,将小鼠上颌中切牙悬挂于特制环形架的橡胶带上,镊子夹闭鼻孔,同时从一侧嘴角轻轻拉出舌以暴露舌根和咽后壁,将均一的SiO2悬浊液沿咽后壁缓慢注入,确保其随呼吸运动吸入肺部,结束后将小鼠置于掌心保持上体直立位,直至完全苏醒[8]。对照组以同样的方式给予等体积的无菌生理盐水。Apy组在造模的同时及造模后4 h经口咽吸入Apy溶液,溶剂组经口咽吸入SiO2悬浊液造模,造模后4 h经口咽吸入无菌生理盐水作为溶剂对照。各组小鼠在造模后的3 h、7 d、14 d和28 d分为灌洗组和非灌洗组取材。将小鼠麻醉后摘眼球放血处死,灌洗组用1 mL预冷无菌生理盐水行经支气管肺泡灌洗,重复3次,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)离心后取上清储存于-80 ℃冰箱备用。非灌洗组开胸取肺,肉眼观察双肺,称量肺脏重量,计算肺系数,肺系数=肺湿重(mg)/体重(g);右上肺经4%多聚甲醛固定后用Leica TP-1020半自动台式组织处理机脱水浸蜡,包埋后组织切片进行HE染色、苦味酸-天狼星红染色;左肺储存于液氮中,用于肺组织RNA的提取与分析;右下肺储存于液氮中用于肺组织ATP的检测。
3.2小鼠肺组织ATP的检测取出液氮中的右下肺部分,置于冰上并剪成小块,加入提前预冷的10% HClO4,用KONTES微型电动组织匀浆器匀浆;使用Biofuge stratas离心机4 ℃ 45 000 r/min离心10 min;取500 μL上清置于新的EP管,加入200 μL 2.5 mol/L 的KOH溶液充分混匀,中和HClO4;4 ℃ 45 000 r/min离心10 min后,取上清用pH 7.8的TAE缓冲液稀释10倍,按照说明书的操作要求,用ATP检测试剂盒进行检测,简述步骤如下:将储存浓度为400 μmol/L的ATP标准品倍比稀释,分别得到2 000、1 000、500、250和100 nmol/L的标准品;避光条件下将ATP检测混合物稀释25倍;取100 μL工作浓度ATP检测混合液加入不透明酶标板,静置2 min以耗竭环境中的本底ATP;将100 μL的ATP标准品或待测样本加入酶标板,设复孔,振荡混匀后用PerkinElmer LS55分光光度计测定;根据标准品浓度和吸光度值拟合标准曲线,求出相应方程式并计算各样本的ATP浓度。
3.3小鼠肺组织的病理学检测肺组织在4%的多聚甲醛中固定48 h后常规石蜡包埋,切5 μm切片,进行HE染色、苦味酸-天狼星红染色,用NIKON E300偏振光显微镜观察肺组织炎症反应和纤维化程度。参照Szapiel等[9]的方法,在放大100倍视野下观察HE染色切片,每只小鼠取3个连续切片,避开大的气管和血管后随机选取5个视野,按以下规则进行炎症评分:正常组织评为0分,炎症细胞浸润面积占肺组织面积比例<20%评为1分,比例为20%~50%评为2分,比例>50%评为3分,取其平均值作为炎症评分,反映肺组织的炎症程度。应用Image-Pro Plus 6.0软件对肺间质纤维化程度进行分析:同一视野用暗场图像分析胶原面积,明场图像分析空白区域面积,计算胶原容积分数(collagen vo-lume fraction,CVF)反映肺纤维化程度,计算公式如下:CVF(%)=胶原面积/(图像总面积-空白区域面积)×100%。
3.4ELISA测定肺泡灌洗液TGF-β1的含量将ELISA试剂盒和待测BALF恢复室温,按照说明书的操作要求进行检测,简述步骤如下:稀释标准品,将100 μL的标准品或样本加入酶标板,均设复孔;封板膜封板后37 ℃孵育30 min,弃去液体,洗涤液洗涤5次;加显色A液、B液各50 μL,振荡混匀后37 ℃孵育15 min,加中止液50 μL后,Bio-Rad xMark分光光度计测定450 nm和630 nm双波长下的吸光度,根据标准品做出浓度与吸光度的标准曲线,得出相应的方程,求出各样本BALF上清TGF-β1的浓度。
3.5小鼠肺组织TGF-β1的mRNA水平检测采用TRIzol法提取各组肺组织的总RNA,NanoDrop 2000c分光光度计对其进行定量,用RNA甲醛变性电泳法验证其完整性,之后使用反转录试剂盒将mRNA反转录成cDNA,SYBR Green法进行实时定量PCR反应,反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。用2-ΔΔCt法对结果进行分析。所用引物序列如表1所示,引物均由北京中美泰和生物技术有限公司合成。
3.6小鼠肺组织Ⅰ型胶原(collagen typeⅠ,ColⅠ)和Ⅲ型胶原(collagen typeⅢ,Col Ⅲ)水平的检测将3.5中提取出的mRNA进行反转录,SYBR Green法进行实时荧光定量PCR反应,反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。用2-ΔΔCt法对结果进行分析。所用ColⅠ、Ⅲ引物序列如表1所示,引物均由北京中美泰和生物技术有限公司合成。
4统计学处理
采用GraphPad Prism 6.0软件进行统计分析,计量资料以均数±标准误(mean±SEM)表示,组间比较采用t检验和方差分析,多重比较使用Tukey’s法,相关性采用Pearson相关分析。以P<0.05为差异有统计学显著性。

表 1 目的基因引物序列
结果
1肺组织ATP含量的变化
如图1所示,在矽肺造模后的3 h,矽肺组与对照组相比肺组织ATP浓度显著升高(P<0.01);与溶剂对照组相比,Apy组肺组织ATP的含量明显下降(P<0.01)。

Figure 1. Apyrase (Apy) treatment reduced ATP accumulation induced by silica administration. Mean±SEM. n=5.**P<0.01 vs NS group;##P<0.01 vs silica+Apy group.
图1 三磷酸腺苷双磷酸酶干预3 h后小鼠肺组织ATP含量的变化
2各组小鼠肺组织的病理学变化
造模后7 d的HE染色可见,NS组肺组织结构基本正常,而silica组表现为大量的炎症细胞浸润,肺泡间隔增宽,肺泡结构破坏,炎症评分显著升高(P<0.01);与溶剂组相比,Apy组肺组织炎症细胞浸润等肺泡炎的症状明显改善,肺组织炎症评分显著降低(P<0.05),见图2;造模后28 d肺组织天狼星红染色表明,矽肺小鼠肺组织在偏振光下可见到呈团块状分布的红色粗大的Ⅰ型胶原及黄绿色细小的Ⅲ型胶原,而Apy干预小鼠肺组织硒结节的数量减少、规模减小,偏振光下观察到胶原沉积明显减轻,Image-Pro Plus 6.0软件分析所得胶原容积分数也显著降低(P<0.01),见图3。
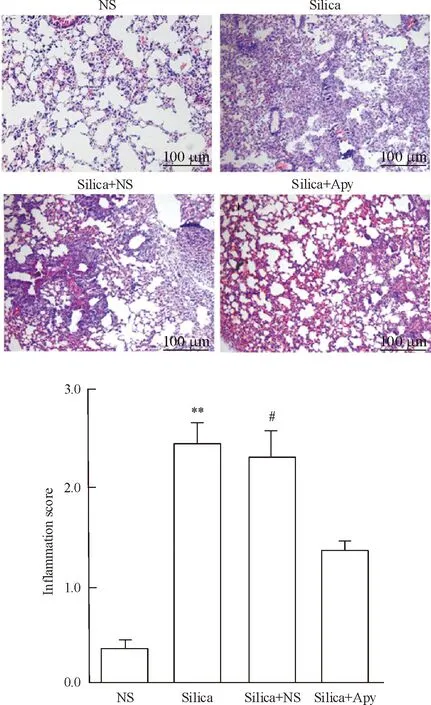
Figure 2. Histologic changes and inflammation score of the lung tissues from each group 7 d after oropharyngeal aspiration of silica suspension. Mean±SEM. n=5.**P<0.01 vs NS group;#P<0.05 vs silica+Apy group.
图2三磷酸腺苷双磷酸酶干预后小鼠肺组织炎症的变化
3各组小鼠肺指数的变化
28 d矽肺组小鼠肺指数与溶剂组比较差异无统计学显著性,与对照组相比肺指数显著升高(P<0.01);Apy组肺指数与溶剂组相比显著降低(P<0.01),见图3。
4肺组织Col Ⅰ和Col Ⅲ表达的变化
如图3所示,与对照组相比,矽肺组肺组织ColⅠ和ColⅢ的mRNA表达水平明显提高(P<0.05);而Apy组肺组织ColⅠ和ColⅢ的mRNA表达水平与溶剂组相比显著下降(P<0.05)。
5肺组织TGF-β1 mRNA的表达及肺泡灌洗液TGF-β1蛋白的表达
在矽肺造模的第7天,矽肺组和溶剂组肺组织TGF-β1的mRNA表达水平与对照组相比显著提高,Apy组肺组织TGF-β1的表达水平与溶剂组比较显著降低(P<0.05)。与此一致,第7 天 Apy组肺泡灌洗液中TGF-β1蛋白的水平与溶剂组相比明显降低(P<0.05),见图4。
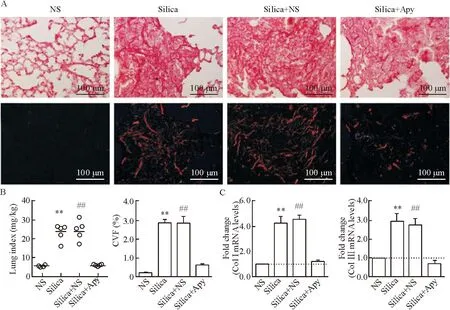
Figure 3.Changes of pulmonary fibrosis in the mice with apyrase (Apy) treatment. A: picrosirius red staining revealed that pulmonary fibrosis was attenuated by Apy treatment on day 28 after oropharyngeal aspiration of silica; B: Apy treatment reversed the rising trend of lung index and collagen volume fraction (CVF) of silicosis mice; C: the mRNA expression of collagen typeⅠ and collagen type Ⅲ in each group. Mean±SEM. n=5.**P<0.01 vs NS group;##P<0.01 vs silica+Apy group.
图3三磷酸腺苷双磷酸酶干预后小鼠肺组织纤维化程度的变化
6各组小鼠肺组织ATP含量和TGF-β1 mRNA表达水平的相关关系
Apy组小鼠ATP含量和TGF-β1表达水平与溶剂组相比显著下降,为分析两者关系,我们将小鼠肺组织ATP含量与相应的肺组织TGF-β1的mRNA表达水平进行相关性分析,结果显示两者呈明显的正相关(r=0.908 1,P<0.01),见图4。
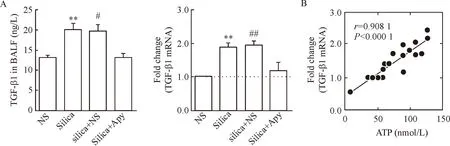
Figure 4.Changes of TGF-β1 at mRNA and protein levels in the mice with apyrase (Apy) treatment and the correlation between ATP level and TGF-β1 mRNA level. A: the expression of TGF-β1 at mRNA and protein levels in Apy treatment group were down-regulated; B: the positive correlation between ATP level and TGF-β1 mRNA expression level in the lung tissues. Mean±SEM.n=20.**P<0.01 vs NS group;#P<0.05,##P<0.01 vs silica+Apy group.
图4三磷酸腺苷双磷酸酶干预后小鼠TGF-β1在mRNA和蛋白水平表达的变化及其与肺组织ATP的相关关系
讨论
矽肺是由于长期慢性吸入游离SiO2引起免疫细胞激活、炎症介质释放从而导致慢性炎症迁延不愈,破坏肺的结构并引起细胞外基质过度沉积,最终导致肺结构的破坏。近年来,国内外学者从免疫调节及细胞因子水平干预等方面对矽肺的发病机制进行了广泛探索,然而其确切发病机制尚未完全阐明。而最近的研究表明,在维持宿主稳态的过程中,免疫系统不仅可以感受入侵的病原分子,还会受病理过程中产生的各种内源性分子的影响[7]。ATP的积累在感染及纤维化疾病中可以通过调控炎症通路、激活成纤维细胞等方式,参与炎症反应及组织重塑的过程[3, 10]。 Riteau等[7]的研究表明,使用Apy经口咽滴入呼吸道可以明显改善博来霉素导致的小鼠肺纤维化。本研究通过测定肺组织的ATP含量表明,矽肺造模后3 h小鼠肺组织有大量的ATP释放和积累,而经口咽吸入法给予Apy治疗后,气道中的ATP含量显著下降,说明Apy清除肺组织局部ATP。与矽肺组相比,我们观察到Apy组7 d小鼠肺组织炎症细胞浸润、肺泡间隔增宽、肺泡结构破坏等肺泡炎的症状明显减轻,炎症评分显著下降;28 d小鼠肺组织胶原的沉积明显减轻,胶原容积分数及肺系数显著下降,而肺组织Col Ⅰ和Col Ⅲ的表达水平也明显下降,表明Apy干预减轻了矽肺小鼠早期肺组织炎症和晚期肺纤维化。
Harris等[11]认为,TGF-β1是促进肺纤维化的最直接的细胞因子,是最强的细胞外基质沉淀促进剂,在调控肺成纤维细胞增殖分裂及胶原蛋白的合成与降解过程中发挥重要作用。多项研究表明TGF-β1水平可作为矽肺早期检测的指标之一,也是治疗矽肺的潜在作用靶点[12-13]。在Apy干预矽肺小鼠的过程中,我们观察到Apy组TGF-β1在基因和蛋白水平表达均下调,且小鼠急性炎症期肺泡炎的表现及后期纤维化的表现均显著缓解。肺组织ATP含量和肺组织TGF-β1 mRNA表达水平的相关性分析表明两者呈明显的正相关,因此Apy可能是通过降低肺组织ATP调控TGF-β1的表达从而减少胶原的沉积、成纤维细胞的增生以达到缓解矽肺的目的。
综上所述,使用Apy可能通过局部清除呼吸道ATP而影响TGF-β1的表达,减轻矽肺的炎症和纤维化表现。下一步的研究拟通过Apy清除ATP的体内外实验,探讨ATP在矽肺中促炎症、促纤维化作用的具体分子机制及其作为矽肺预防和治疗靶点的可能性。
[参考文献]
[1]Lopes-Pacheco M, Ventura TG, de Oliveira HD, et al. Infusion of bone marrow mononuclear cells reduces lung fibrosis but not inflammation in the late stages of murine si-licosis[J]. PLoS One, 2014, 9(10):e109982.
[2]Bianchi G, Vuerich M, Pellegatti P, et al. ATP/P2X7 axis modulates myeloid-derived suppressor cell functions in neuroblastoma microenvironment[J]. Cell Death Dis, 2014, 5:e1135.
[3]Dolmatova E, Spagnol G, Boassa D, et al. Cardiomyocyte ATP release through pannexin 1 aids in early fibroblast activation[J]. Am J Physiol Heart Circ Physiol, 2012, 303(10):H1208-H1218.
[4]Burnstock G, Boeynaems JM. Purinergic signalling and immune cells[J]. Purinergic Signal, 2014, 10(4):529-564.
[5]Moncao-Ribeiro LC, Faffe DS, Santana PT, et al. P2X7 receptor modulates inflammatory and functional pulmonary changes induced by silica[J]. PLoS One, 2014, 9(10):e110185.
[6]Csoka B, Nemeth ZH, Toro G, et al. Extracellular ATP protects against sepsis through macrophage P2X7 purinergic receptors by enhancing intracellular bacterial killing[J]. FASEB J, 2015, 29(9):3626-3637.
[7]Riteau N, Gasse P, Fauconnier L, et al. Extracellular ATP is a danger signal activating P2X7 receptor in lung inflammation and fibrosis[J]. Am J Respir Crit Care Med, 2010, 182(6):774-783.
[8]Lakatos HF, Burgess HA, Thatcher TH, et al. Oropharyngeal aspiration of a silica suspension produces a supe-rior model of silicosis in the mouse when compared to intratracheal instillation[J]. Exp Lung Res, 2006, 32(5):181-199.
[9]Szapiel SV, Elson NA, Fulmer JD, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. Am Rev Respir Dis, 1979, 120(4):893-899.
[10]Lee BH, Hwang DM, Palaniyar N, et al. Activation of P2X7receptor by ATP plays an important role in regulating inflammatory responses during acute viral infection[J]. PLoS One, 2012, 7(4):e35812.
[11]Harris WT, Muhlebach MS, Oster RA, et al. Plasma TGF-β1in pediatric cystic fibrosis: potential biomarker of lung disease and response to therapy[J]. Pediatr Pulmonol, 2011, 46(7): 688-695.
[12]陈丽,贾晓民,王新梅,等. 矽肺肺纤维化患者血清转化生长因子-β1检测及其意义[J]. 中国临床研究, 2014, 27(12):1498-1500.
[13]吴旭辉,邱振宁,陈雨燕. 矽肺患者IL-1、TGF-β1水平与Ⅰ、Ⅲ型胶原表达的相关性研究[J]. 临床医药文献电子杂志, 2015,2(19):3868-3869.
(责任编辑: 林白霜, 罗森)
Intervention effects of apyrase on silica-induced pulmonary fibrosis in mice
SU Cheng-cheng1, XIANG Guo-an1, MA Yong-qiang2, ZHOU Xin2, PENG Shou-chun1, WEI Lu-qing1, JI Wen-jie1
(1Department of Respirology and Critical Care Medicine, Pingjin Hospital, Logistics University of Chinese People’s Armed Police Forces,2Tianjin Key Laboratory of Cardiovascular Remodeling and Target Organ Injury, Institute of Cardiovascular Disease and Heart Center, Tianjin 300162, China. E-mail: ji_wenjie@hotmail.com; wei_luqing@hotmail.com)
[ABSTRACT]AIM: To investigate the effect of apyrase on the experimental silicosis. METHODS: C57BL/6 male mice were randomly divided into control group, silica treatment group, silica+apyrase group and silica+NS group. A mouse model of lung fibrosis was induced by crystalline silica particles (50 mg/kg, via oropharyngeal instillation), and were sacrificed at 3 h, 7 d, 14 d and 28 d. Apyrase was delivered by oropharyngeal aspiration at the same time and 4 h after silica challenge. The lung indexes were calculated and the concentration of ATP was detected by bioluminescent assay. The mRNA expression levels of collagen type Ⅰ(Col Ⅰ), collagen type Ⅲ (Col Ⅲ) and transforming growth factor β1 (TGF-β1) were examined by real-time PCR. The protein levels of TGF-β1 in bronchoalveolar lavage fluid were measured by ELISA. RESULTS: The elevated lung index and collagen levels showed that silicosis model was established successfully. Compared with silica group, apyrase treatment significantly alleviated silica-induced inflammation, reduced inflammation score on day 7, and decreased the lung index, collagen volume fraction and the mRNA expression of Col Ⅰand Col Ⅲ on day 28. Treatment with apyrase effectively down-regulated the mRNA levels of TGF-β1 in the lung tissues and TGF-β1 protein levels in bronchoalveolar lavage fluid on day 7.CONCLUSION: Apyrase attenuates the pulmonary inflammation and fibrosis of silicosis, which may be related with down-regulation of ATP and TGF-β1 in the lung tissues.
[KEY WORDS]Silicosis; Apyrase; Transforming growth factor β1
[文章编号]1000- 4718(2016)05- 0792- 06
[收稿日期]2016- 01- 07[修回日期] 2016- 03- 16
*[基金项目]国家自然科学基金资助项目(No. 81102088; No. 81441101);天津市自然科学基金资助项目(No. 13JCYBJC22000; No. 15JCZDJC35000);武警后勤学院附属医院重点项目(No. FYZ201510; No. FYZ201605);武警后勤学院附属医院种子基金资助项目(No. FYM201538)
通讯作者△姬文婕 Tel: 022-60577283; E-mail: ji_wenjie@hotmail.com; 魏路清 Tel: 022-60578671; E-mail: wei_luqing@hotmail.com
[中图分类号]R135.2; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.004
杂志网址: http://www.cjpp.net
▲并列第1作者
