UV-Vis结合HPLC FP对不同采收期傣药灯台叶的鉴别及品质研究
2016-06-05杨妮娜赵艳丽王元忠赵应红
杨妮娜、张 霁、赵艳丽、王元忠*、赵应红
1. 西双版纳傣族自治州傣医医院、云南 西双版纳 666100 2. 云南中医学院中药学院、云南 昆明 650500 3. 云南省农业科学院药用植物研究所、云南 昆明 650200
UV-Vis结合HPLC FP对不同采收期傣药灯台叶的鉴别及品质研究
杨妮娜1,2、张 霁3、赵艳丽3、王元忠3*、赵应红1*
1. 西双版纳傣族自治州傣医医院、云南 西双版纳 666100 2. 云南中医学院中药学院、云南 昆明 650500 3. 云南省农业科学院药用植物研究所、云南 昆明 650200
建立不同采收期灯台叶紫外-可见光谱指纹图谱及HPLC指纹图谱、结合主成分分析、聚类分析对不同采收期灯台叶进行快速鉴别和品质评价、确定最佳采收期、推动傣药现代化发展进程。通过单因素实验确定灯台叶紫外-可见光谱的最佳提取条件、采集12个月份灯台叶紫外光谱数据、平行3次、扣除背景8点平滑后倒入SIMCA-P+11.5进行主成分分析、以前三个主成分三维得分图快速鉴别不同采收期。Agilent ZORBAX Eclipse XDB C18(250×4.6 mm,5 μm)色谱柱、以乙腈(B)-0.1%甲酸水(A)为流动相、梯度洗脱(0~5 min、5% B; 5~35 min、5% B→26% B; 35~40 min、26% B→56% B)、流速1 mL·min-1、进样量7 μL、柱温30 ℃、检测波长287 nm。不同采收期灯台叶紫外-可见光谱根据吸收峰位置及变化的幅度可以将光谱分为三段、第一段为235~400 nm、第二段为400~500 nm、第三段为500~800 nm。第一段中吸收峰数目最多、主要集中在270、287和325 nm、吸光度及其变化幅度最大、体现出不同月份光谱图的指纹特征。第二段吸收峰较少主要分布在410 nm和464 nm附近、吸光度及其变化较第一段减小。第三段图谱在665 nm处均有一个较大吸收峰、吸光度无明显差异。将UV-Vis光谱数据进行主成分分析、不同月份样品在主成分得分图中离散分布、同一月份样品相对集中、可以将不同月份样品鉴别开。HPLC指纹图谱结合聚类分析可将不同采收期样品分为Ⅲ类、第Ⅰ类为3、4、5和7月份、第Ⅱ类为6、8和9月份、第Ⅲ类为10、11、12、1及2月。结合共有峰面积可以看出同一类样品化学成分含量相近、不同类之间差异较明显、第Ⅲ类样品化学成分含量最高。UV-Vis FP、HPLC FP结合主成分分析和聚类分析能快速鉴别不同采收期灯台叶并对其进行品质评价。灯台叶最佳采收期为10月至次年2月、即傣历中的冷季。
紫外-可见光谱; HPLC指纹图谱; 傣药; 灯台叶; 采收期; 鉴别; 质量评价
引 言
民族的就是世界的[1]。2007年国家11个部委联合制定的48号文件《关于切实加强民族医药事业发展的指导意见》充分肯定了民族医药在人类卫生事业中的突出贡献。傣医药作为“四大民族医药”(藏、蒙、维、傣)之一、越来越受到人们的关注。据《贝叶经》、《逸周书王会解》记载、早在2500多年前“当补腊萨哈”(橄揽时期)傣族人民就有了自己的医药文化[2-3]。傣族将一年分为腊鲁闹(冷季)、腊鲁皇(热季)、腊鲁芬(雨季)三个季节、不同季节药物有效成份存在于植物的不同部位、故傣医非常注重采药季节和周日时辰[4]。
随着傣药材消耗日益增长、野生资源逐步枯竭、不同采收期药材混用现象愈加严重、给傣药临床疗效带来了巨大隐患。因此、结合现代研究技术鉴别和确定药材最佳采收期保证药物疗效显得尤为重要。由于傣药研究相对滞后、缺乏相应对照品、因此构建一种从整体角度鉴别和评价傣药的方法迫在眉睫。指纹图谱技术凭借其整体性、模糊性特点、在民族药研究中已广泛应用[5-7]。获取指纹图谱的方法有紫外-可见光谱、红外光谱、液相色谱、气相色谱、毛细管电泳及其相关联用技术等[8-9]。紫外-可见光谱是有机化合物中价电子吸收一定光子能量从基态跃迁至激发态的结果、是共轭结构的特有属性、色谱峰高低代表价电子吸收光子能量的大小[10]。紫外-可见分光光度法操作简便、测定快速、应用范围广、能将微观的价电子跃迁过程转化成宏观的光谱图但专属性较差、存在光谱重叠、数据量大等问题[11-13]。高效液相色谱图是不同极性化合物在固定相和流动相中分配系数不同而形成的、每一个色谱峰代表一个或一类化合物、其分离效率高、灵敏度好、专属性强、操作自动化但所需时间较长[10,14]。同时采用UV-Vis指纹图谱和HPLC指纹图谱、结合化学计量学方法探讨傣药采收期及品质评价的研究未见报道。
灯台叶是夹竹桃科鸡骨常山属糖胶树(Alstoniascholaris(L.) R. Br.)的干燥树叶、寒、苦、微涩、入火、水塔、有清火解毒、止咳化痰、消肿止痛等功效、被广泛地用于治疗拢答儿(颌下淋巴结肿大)、拢达儿(腮腺肿大)、乃多皇卖唉列习特来(肺热咳嗽、痰多)、习火(哮喘)、农杆农暖(乳腺炎)、“拢匹勒”(月子病)、拢梦曼(荨麻疹)、“拢匹把母”(癫痫病)和拢梅接路多火档(风湿肢体关节疼痛)[15-16]。现代研究表明灯台叶富含生物碱、黄酮、三萜等活性成分、具有止咳平喘、抗氧化、抗炎镇痛、抗肿瘤和免疫调节的药理活性[17-21]。
研究以灯台叶为材料、建立其UV-VisFP和HPLC FP、结合聚类分析和主成分分析对不同采收期灯台叶药材进行鉴别和品质评价、研究结果以期为灯台叶药材最佳采收期的确定提供科学依据、确保临床用药的有效性、推动傣药现代化发展进程。
1 实验部分
1.1 仪器
UV-2550双通道紫外-可见分光光度计(日本岛津)、电子分析天平(美国奥豪斯公司)、超声波清洗机(上海科导超声仪器有限公司)、FW-100型高速万能粉碎机(天津泰斯特仪器有限公司)、LC-10 ATvp型高效液相色谱仪(日本岛津、包括二极管阵列检测器、二元泵、手动进样器、CLASS-VP工作站)、Agilent ZORBAX Eclipse XDB C18色谱柱(250×4.6 mm,5 μm)。
1.2 试剂
甲醇、无水乙醇(分析纯、四川西陇化工有限公司)、乙酸乙酯(分析纯、汕头市西陇化工有限公司)、石油醚、甲酸(分析纯、天津市风船化学试剂科技有限公司)、乙腈(色谱纯、美国fisher)、超纯水(Millipore纯水系统、美国Millipore公司)。
1.3 样品
12批灯台叶样品分别于2014年4月至2015年3月采自云南省西双版纳傣族自治州傣医医院、每批样品量均为5株。样品采集后晒干、粉碎、过2号筛、自封袋密封、避光、阴凉干燥处保存。所有样品经傣药主任药师赵应红鉴定为夹竹桃科鸡骨常山属糖胶树叶。
1.4 UV-Vis指纹图谱建立
1.4.1 UV-Vis供试品溶液制备
精密称取灯台叶粉末0.025 0 g于25 mL具塞试管中、加无水乙醇10 mL、称定重量、室温下超声提取40 min、取出、静置、再次称定、无水乙醇补足损失重量、过滤、滤液作为供试品溶液。
1.4.2 灯台叶紫外-可见光谱测定
根据“1.4.1”项下方法制得供试品溶液、以无水乙醇为参比液、设定扫描波长235~800 nm、狭缝宽度1.0 nm、采样间隔0.2 nm、扫描紫外-可见光谱图、每份样品平行测定3次、取平均光谱。
1.4.3 UV-Vis数据处理
将12批36个原始光谱图进行扣背景8点平滑处理、以消除基线漂移和光谱噪音干扰。波长和吸光度数据通过转置、导入SIMCA-P+11.5软件进行主成分分析。
1.5 HPLC指纹图谱建立
1.5.1 色谱条件
Agilent ZORBAX Eclipse XDB C18色谱柱(250×4.6 mm,5 μm); 流动相为乙腈(B)-0.1%甲酸水(A)、洗脱梯度; 流速1.0 mL·min-1; 柱温30 ℃; 检测波长287 nm; 进样量7 μL。梯度洗脱程序:0~5 min、5% B; 5~35 min、5% B→26% B; 35~40 min、26% B→56% B。
1.5.2 样品测定
分别取12批灯台叶粉末各0.500 0 g、精密称定、置洁净具塞试管中、加水10 mL、超声提取(53 Hz)40 min、取出、干燥玻璃滤器过滤、滤液用0.22 μm微孔滤膜过滤、精密吸取续滤液7 μL、注入高效液相色谱仪、按“1.5.1”项下色谱条件进行测定、记录色谱图。
1.6 方法
1.6.1 UV-Vis光谱精密度、重复性、稳定性试验
取6月份供试品溶液、根据“1.4.2”项光谱条件下连续进样6次、以吸光度计、相对标准偏差RSD小于0.6%、表明仪器精密度良好。
平行称取6月份样品6份、依照“1.4.1”项下方法制备供试品溶液、在“1.4.2”项光谱条件下进行测定、以吸光度计算相对标准偏差小于2.8%、结果表明该方法重现性良好。
取6月份样品、按“1.4.1”项方法制备UV-Vis供试品溶液、分别于0、2、4、8、12、24 h扫描光谱图、以吸光度计算相对标准偏差RSD小于1.7%、供试品溶液在24 h内稳定。
1.6.2 HPLC精密度、重复性、稳定性试验
取6月份灯台叶样品、按“1.5.2”项下方法获得供试品溶液、按“1.5.1”项下色谱条件连续进样6次、考察各共有峰相对保留时间和相对峰面积。结果相对保留时间RSD%<0.39%、相对峰面积RSD%<3.78%、表明仪器精密度良好。
取6月份灯台叶样品6份、按“1.5.2”项下方法获得供试品溶液、各取7 μL、依次进样、考察各共有峰相对保留时间和相对峰面积。结果相对保留时间RSD%<0.25%、相对峰面积RSD%<4.97%、表明方法重复性良好。
取6月份灯台叶样品、采用“1.5.2”项下方法得到供试品溶液、分别于0、2、4、8、12、24 h进样分析、记录色谱图、考察各共有峰相对保留时间和相对峰面积。结果相对保留时间RSD%<0.64%、相对峰面积RSD%<2.88%、表明供试品溶液在24 h内稳定性良好。
2 结果与讨论
2.1 提取溶剂优化
精密称取6月份灯台叶粉末4份、每份0.025 0 g、分别加入10 mL甲醇、无水乙醇、乙酸乙酯、石油醚、超声提取40 min、过滤、续滤液按“1.4.2”项下条件测定、结果见图1(a)。图中可以看出甲醇、乙酸乙酯为溶剂所得光谱色谱峰数目较少且吸光度过大、石油醚提取物光谱色谱峰数目少吸光度最低、无水乙醇提取物所获得光谱色谱峰数目最多吸光度适中、因此选择无水乙醇为提取溶剂。
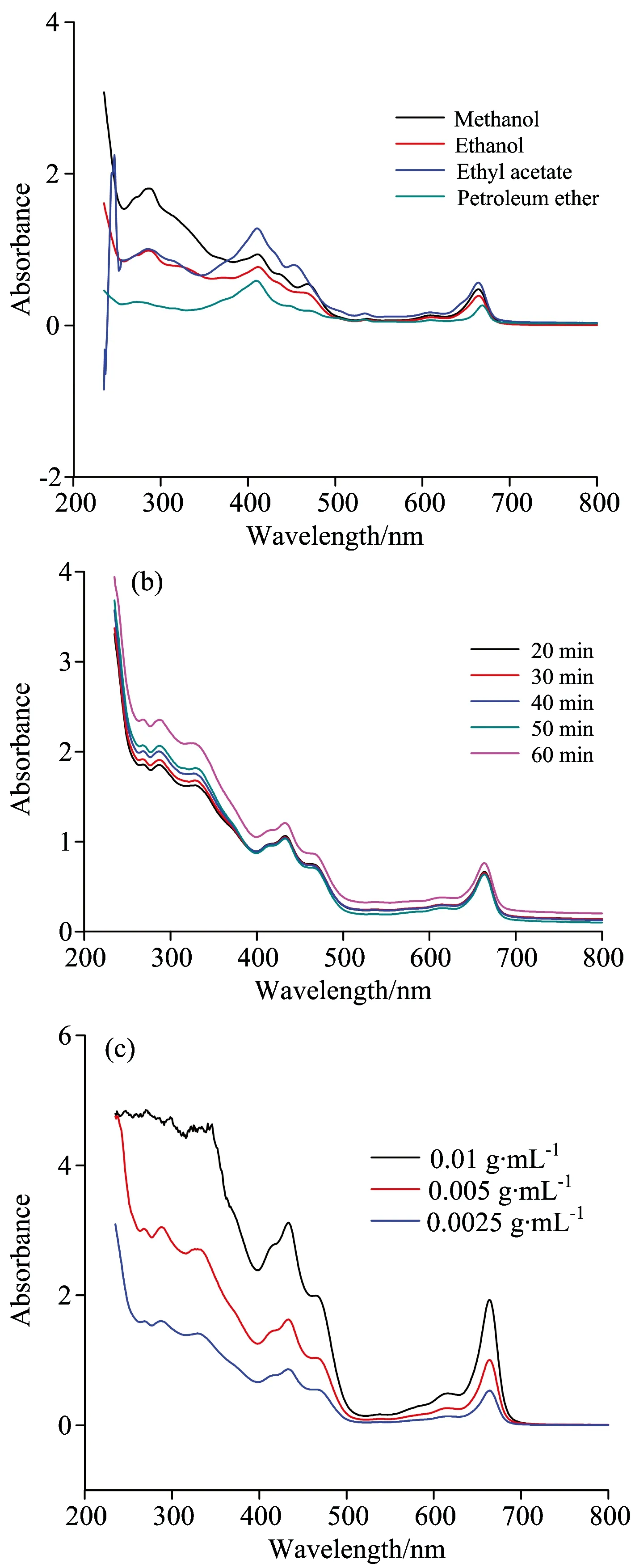
图1 优化提取方法的紫外-可见光谱指纹图谱
(a):不同提取溶剂的紫外-可见光谱指纹图谱; (b)、(c):不同超声时间和不同料液比的紫外-可见光谱指纹图谱
Fig.1 UV-Vis fingerprint of optimization of method for extraction
(a): UV-Vis fingerprint of different solvents extracts; (b),(c): UV-Vis fingerprint of different ultrasonic time and material liquid ratio
2.2 超声时间优化
以6月份样品为考察对象、精密称定样品0.025 g、加无水乙醇10 mL、分别超声20、30、40、50、60 min、过滤、按“1.4.2”项下条件进行光谱测定、结果见图2(b)。图中可以看出超声20,30,40,50 min对灯台叶提取效率影响较小、60 min影响最大。其中超声30 min到40 min提取率升高幅度大于40~50 min、同时考虑到长时间超声会对药材中物质成分和结构造成影响、故选择40 min为最佳提取时间。
2.3 料液比优化
精密称取6月份样品0.025、0.05、0.1 g于3支试管中、加入10 mL无水乙醇、按“1.4.1”项方法制备供试品溶液、“1.4.2”项中光谱条件进行测定、结果见图1(c)。结果表明、不同料液比光谱图差异较大。0.0025 g·mL-1的料液比光谱图峰数目与吸光度均适中、因此选择0.002 5 g·mL-1为最佳料液比。
2.4 不同采收期灯台叶UV-Vis指纹图谱
不同月份样品UV-Vis指纹图谱见图2。图中可以看出、灯台叶UV-Vis光谱峰数目较多、涵盖信息量较大。根据吸收峰位置及变化的幅度可以将光谱分为三段、第一段为235~400 nm、第二段为400~500 nm、第三段为500~800 nm。第一段中吸收峰数目最多、主要集中在270、287和325 nm、可能是醛酮n→π*跃迁产生的R带或芳香环精细解构B带在助色团影响下红移的结果、推测可能与灯台叶中生物碱和黄酮类成分有关。同时第一段中吸光度及其变化幅度最大、体现出不同月份光谱图的指纹特征。第二段吸收峰较少主要分布在410和464 nm附近、吸光度及其变化较第一段减小。第三段图谱中不同月份样品吸光度及变化无明显差异、但在665 nm处均有一个较大吸收峰、可能是叶绿素的吸收峰[22-24]。
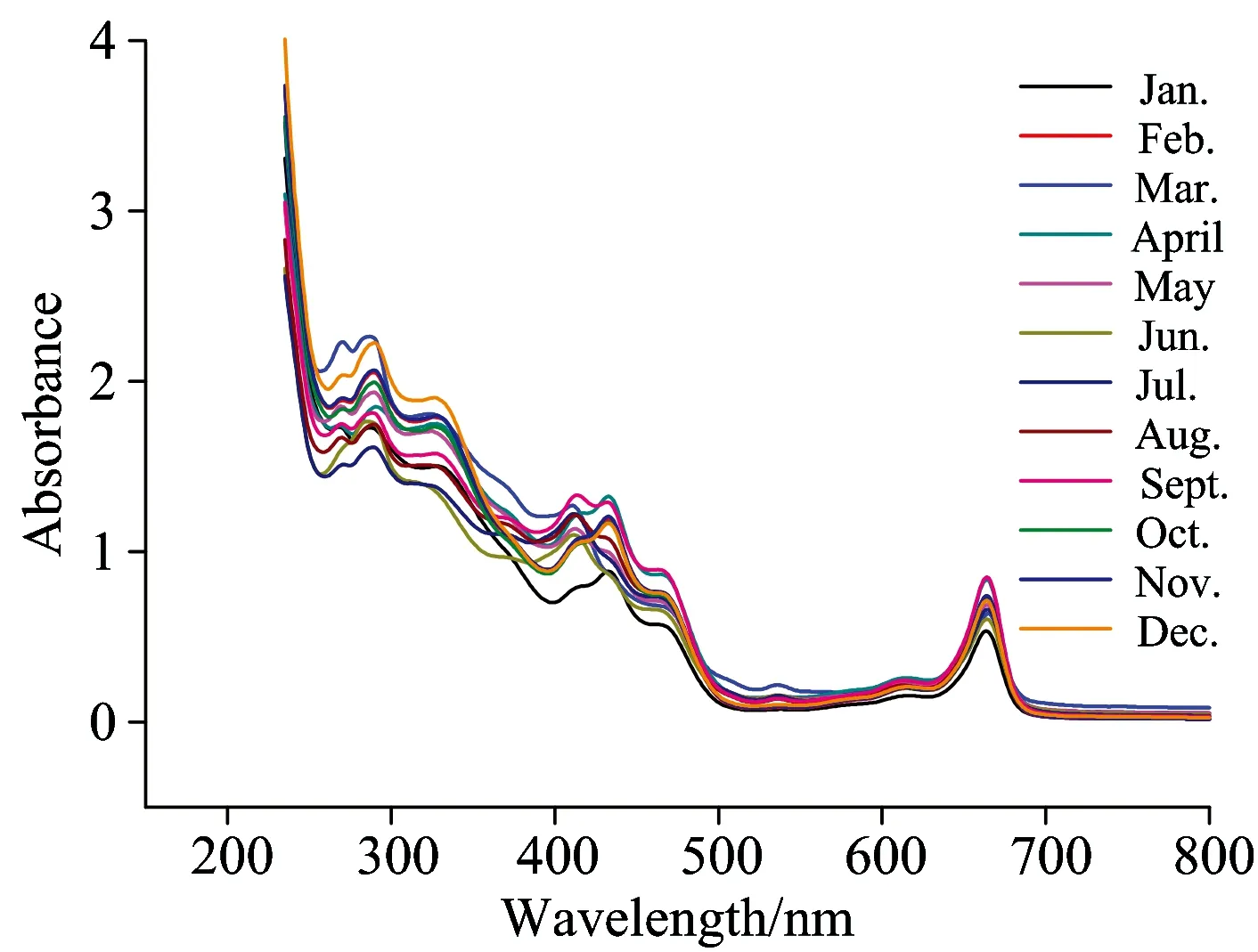
图2 不同采收期灯台叶紫外-可见光谱指纹图谱
2.5 不同采收期灯台叶主成分分析
采用SIMCA-P+11.5软件对不同采收期灯台叶进行主成分分析、特征根大于1的3个主成分累积贡献率高达97.221%(表1)、表明该3个主成分能够表达样品全部化学信息的97.221%、以其来评价采收期药材的质量变化具有可行性。因此以PC1,PC2和PC3为坐标、做主成分分析的三维投影图(图3)。图中相同颜色的为同一个月份样品、聚集一起为整体质量接近的样品。可以看出相同月份的样品在主成分得分图中较集中、不同月份灯台叶样品在主成分分析图中产生一定离散现象。其中、10,11,12,1和2月聚为一类、3,5,6和7月聚为一类、4,8和9月聚为一类。结果表明UV-Vis光谱结合主成分分析能够反应出不同采收期灯台叶样品的整体差异、可用于灯台叶采收期的鉴别。
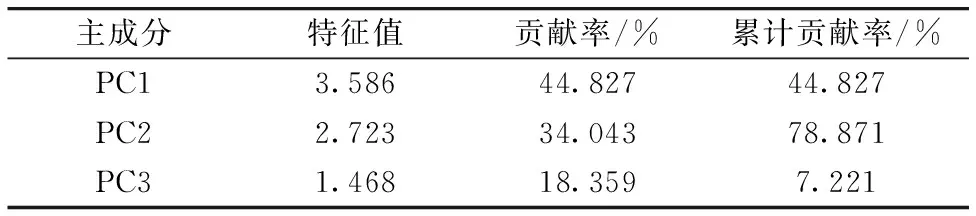
表1 三种主成分的特征值和贡献率
2.6 不同采收期灯台叶HPLC指纹图谱建立
不同采收期样品HPLC指纹图谱见图4、确定了16个共有峰、共有峰总面积见表2。采用SPSS16.0对全谱峰面积进行聚类分析、见图5。从指纹图谱和共有峰总面积可以看出不同采收期灯台叶化学成分基本相似、但含量差异较明显。聚类分析结果可以看出不同采收期样品分为Ⅲ类、第Ⅰ类为3、4、5和7月份、第Ⅱ类为6、8和9月份、第Ⅲ类为10、11、12、1及2月。同一类样品化学成分含量相似、不同类之间含量差异较明显、结合共有峰面积可以看出第Ⅲ类样品化学成分含量最高、建议灯台叶在10月至次年2月(傣族冷季)之间采摘较好。因此HPLC指纹图谱技术结合化学计量学方法可对不同采收期灯台叶品质进行评价。该结果与UV-Vis光谱结果高度吻合、二者的结果相互印证、表明UV-Vis结合HPLC指纹图谱技术在灯台叶采收期评价中应用的可行性。
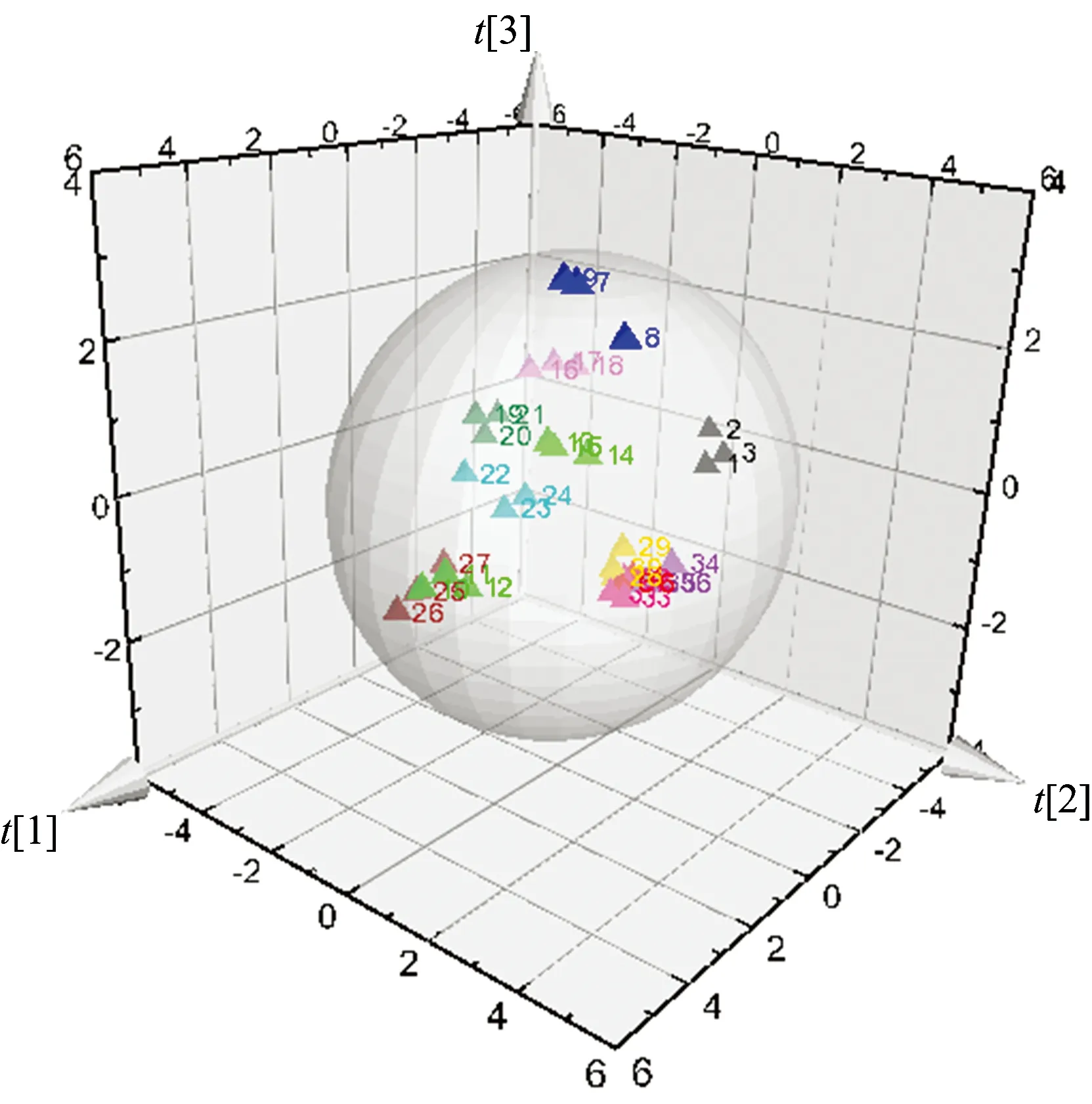
图3 不同采收期灯台叶主成分分析三维图
Fig.3 PCA three-dimensional diagram of different harvest time ofAlstoniascholaris(L.) R. Br.
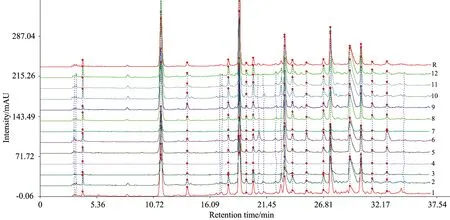
图4 不同采收期灯台叶HPLC指纹图谱
2.7 UV-Vis与HPLC指纹联用技术
UV-Vis光谱指纹图谱与HPLC色谱指纹图谱、均具有“整体性”和“模糊性”的特点、都能从整体上反应不同药材的质量变化情况、但所反应的信息又有区别。UV-Vis光谱操作简便、测定快速、是不饱和基团或共轭基团的特征图谱、反应不同电子跃迁能力的大小、对于化学成分鉴别专属性差。HPLC法灵敏度高、选择性好、从化学成分角度反应药材质量的整体差异、但耗时较长、费用昂贵。本研究采用UV-Vis与HPLC指纹图谱联合技术、凭借其优势互补特点、探讨不同采收期灯台叶质量变化情况、研究表明二者结果高度吻合、相互验证、能够较好地对不同采收期灯台叶进行鉴别和品质评价。
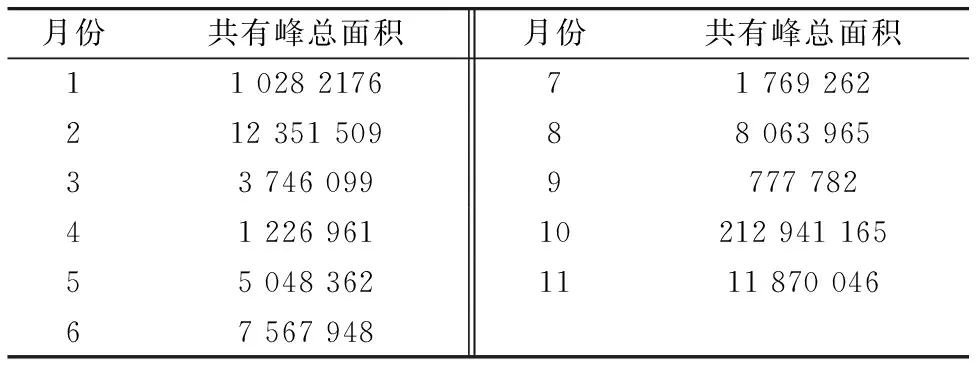
表2 不同采收期灯台叶共有峰总面积

图5 不同采收期灯台叶聚类分析图
2.8 不同采收期灯台叶质量差异性分析
灯台叶传统药用产地为云南西双版纳傣族自治州一带、该地区属热带雨林气候、全年仅有冷季(11~次年2月)、热季(3~6月)、雨季(7月~10月)之分、光照、温度、降雨量差异较大。相关研究表明药用植物有效成分种类和含量的积累随采收期、季节的变化而有所不同、这种差异与外界非生物环境因子密切相关、如光照、温度、降雨量等等[25-31]。灯台树在不同光照、温度刺激下、体内抗氧化酶、生物总量变化较大、进而对其质量产生影响[32]。
2.9 灯台叶最佳采收期的确定
《云南省中药材标准》2005年版第七部规定灯台叶采收期为全年可采、但从UV-Vis与HPLC指纹图谱中可以看出、不同生长阶段灯台叶中物质积累有较大差异。UV-Vis光谱中235~500 nm差异较大、表现出明显的指纹性、其中10、11、12、1、2月份吸光度相对较高。HPLC指纹图结合聚类分析可以看出10、11、12、1、2月份品质接近被聚为一类、且共有成分含量最高、因此建议灯台叶最佳采收期为10月至来年2月、即傣历中的冷季。
3 结 论
建立了不同采收期灯台叶UV-Vis光谱指纹图谱和HPLC色谱指纹图谱、结合主成分分析、相似度评价及聚类分析、表明不同采收期灯台叶质量差异明显、其中10、11、12、1和2月份样品光谱图中吸光度较大、峰数目较多、色谱图中共有化学成分含量最高、因此建议灯台叶最佳采收期为10月至来年2月、即傣历中的冷季。该结果与《云南省中药材标准》2005年版第七部中规定灯台叶全年可采相矛盾、有待进一步研究。
采收期是影响药材质量的关键环节之一、仅以一个或几个化学成分的含量变化来评价不同采收期药材质量、不能完全反应药材整体质量变化。在缺少大量化学对照品和疗效组分不明确的情况下、本研究建立了脂溶性和水溶性成分UV-Vis和HPLC指纹图谱、结合化学计量学研究、即能对不同采收期灯台叶进行快速鉴别又能品质评价、反映不同采收期对灯台叶质量的影响、为确定药材最佳采收期提供了一种新的思路。
[1] Yue C,Xiang L. 2011 6th IEEE Joint International. IEEE,2011,2: 51.
[2] ZHENG Jin(郑 近). The history of Traditional Dai Medicine (傣医药学史). Beijing: China Press of Traditional Chinese Medicine(北京: 中国中医药出版社),2007. 35.
[3] ZHENG Jin,LIN Yan-fang,ZHANG Chao(郑 进,林艳芳,张 超). Basic Theories of Dai Medicine(傣医基础理论). Beijing: China Press of Traditional Chinese Medicine(北京: 中国中医药出版社),2008. 15.
[4] ZHU Cheng-lan,ZHAO Ying-hong,MA Wei-guang(朱成兰,赵应红,马伟光). Traditional Dai Medicine(傣药学). Beijing: China Press of Traditional Chinese Medicine(北京: 中国中医药出版社),2007. 35.
[5] Gong A G,Li N,Lau K,et al. Journal of Ethnopharmacology,2015,168: 150.
[6] Wan L,Cheng Y,Luo Z,et al. Journal of Ethnopharmacology,2015,165: 118.
[7] Li J,He X,Li M,et al. Food Chemistry,2015,176: 7.
[8] Jing J,Parekh H S,Wei M,et al. TrAC Trends in Analytical Chemistry,2013,44: 39.
[9] Wu H,Guo J,Chen S,et al. Journal of Pharmaceutical and Biomedical Analysis,2013,72: 267.
[10] LI Fa-mei(李发美). Analytical Chemistry(分析化学). Beijing: People’s Medical Publishing House(北京: 人民卫生出版社),2011.
[11] LIU Yan,CAI Wen-sheng,SHAO Xue-guang(刘 言,蔡文生,邵学广). Science China Press(科学通报),2015,60(8): 704.
[12] Valderrama L,Gonçalves R P,Março P H,et al. Revista Brasileira de Pesquisa em Alimentos,2014,5(2): 32.
[13] ZHANG Jin-yu,WANG Yuan-zhong,ZHAO Yan-li,et al(张金渝,王元忠,赵艳丽,等). Spectroscopy and Spectral Analysis(光谱学与光谱分析),2012,32(8): 2176.
[14] Tistaert C,Dejaegher B,Vander Heyden Y. Analytica Chimica Acta,2011,690: 148.
[15] Chinese Academy of Sciences Editorial Board of Flora of China(中科院植物志编委会). Flora of China(中国植物志). Beijing: Science Press(北京: 科学出版社),1977,63: 90.
[16] KANG Lang-la(康朗腊). Dang Ha Ya Long(档哈雅龙). Kunming: The Nationalities Publishing House of Yunnan(昆明: 云南民族出版社),2003. 20.
[17] Khyade M S,Kasote D M,Vaikos N P. Journal of Ethnopharmacology,2014,153(1): 1.
[18] Wang C M,Chen H T,Li T C,et al. Journal of Chemical Ecology,2014,40(1): 90.
[19] Arulmozhi S,Mazumder P M,Sathiyanarayanan L,et al. European Journal of Integrative Medicine,2011,3(2): e83.
[20] Arulmozhi S,Mazumder P M,Lohidasan S,et al. European Journal of Integrative Medicine,2010,2(1): 23.
[21] Feng L,Chen Y,Yuan L,et al. Molecules,2013,18(11): 13920.
[22] Seifert B,Pflanz M,Zude M. Food and Bioprocess Technology,2014,7(7): 2050.
[23] Nakajima H,Hara K,Yamamoto Y,et al. Ecotoxicology and Environmental safety,2015,113: 477.
[24] Erten-Ela S,Vakuliuk O,Tarnowska A,et al. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2015,135: 676.
[25] Szakiel A,P?czkowski C,Henry M. Phytochemistry Reviews,2011,10(4): 471.
[26] Hassiotis C N,Ntana F,Lazari D M,et al. Industrial Crops and Products,2014,62: 359.
[27] Liu W,Liu J,Yin D,et al. PloS One,2015,10(4).
[28] Chauhan A,Verma R S,Padalia R C. Climate Change Effect on Crop Productivity,2014: 251.
[29] Moghaddam M,Farhadi N. Journal of Applied Research on Medicinal and Aromatic Plants,2015.
[30] Pacifico S,Galasso S,Piccolella S,et al. Food Research International,2015,69: 121.
[31] Kindlovits S,Radácsi P,Sárosi S,et al. European Journal of Horticultural Science,2014,79(2): 76.
[32] JIANG Yan-juan(姜艳娟). Acta Bot. Boreal. -Occident. Sin. (西北植物学报),2008,28(8): 1675.
*Corresponding authors
Distinguish and Quality Estimation of the Leaves ofAlstoniascholaris(L.) R. Br. from Different Harvest Time Based on the UV-Vis·FP and HPLC·FP
YANG Ni-na1,2,ZHANG Ji3,ZHAO Yan-li3,WANG Yuan-zhong3*、ZHAO Ying-hong1*
1. Dai Hospital of Xishuangbanna Dai Autonomous Prefecture,Xishuangbanna 666100,China 2. College of TCM,Yunnan University of TCM,Kunming 650500,China 3. Institute of Medicinal Plants,Yunnan Academy of Agricultural Sciences,Kuming 650200,China
UV-Vis and HPLC fingerprint of different harvest time of the leaves ofAlstoniascholaris(L.) R. Br. were establish the for identification and quality evaluation to promote the development of Dai Medicine modernization. The optimal extraction condition was used to obtain UV - vis data of different harvest time which were deducted background and eight spot smooth,were collected to make the principal component analysis in SIMCA-P+11.5,identifying the samples quickly with the first three principal component three-dimensional diagram. The HPLC fingerprint were obtained with Agilent ZORBAX Eclipse XDB C18 (250×4.6 mm,5 μm) chromatographic column with the mobile phase of acetonitrile (B) - water (contain 0.1% formic acid) (A) for gradient elution (0~5 min,5% B; 5~35 min,5% B→26% B; 35~40 min,26% B→56% B). The wavelength was set at 287 nm and the column temperature was maintained at 30 ℃. The flow rate was 1.0 mL·min-1and the injection volume was 7 μL. The HPLC fingerprint of different harvest time of the leaves ofAlstoniascholaris(L.) R. Br. was analysised by cluster analysis to quality evaluation. Research findings showing: (1) The UV-Vis spectrogram of different harvest time of the leaves ofAlstoniascholaris(L.) R. Br. were divided into three parts according to the absorption peak position and amplitude of variation. The first was 235 to 400 nm,the second was 400 to 500 nm,and the third was 500 to 800 nm. In the first part,absorption peak were focused on 270,287 and 325 nm,which can reflect the fingerprint character for the high absorbance and amplitude of variation. Absorption peak were distributed in 410 and 464 nm in the second part,absorbance and amplitude of variation were lower than the first part. There was a bigger absorption peak at 665 nm in the third part,but the absorbance had no difference. The UV-Vis data of different harvest time were gathered to make the principal component analysis,the result was that the samples of same month were concentrated distribution,but different month samples were dispersed distribution. (2) HPLC fingerprint were divided into three categories through hierarchical cluster analysis,3,4,5 and 7 month were the first category,6,8,9 month samples were second category,the others were third category. Chemical composition and content of the same category samples were similar,but the different category samples had a obvious difference,more important is that the third category samples content was the highest. Combining UV-Vis FP and HPLC FP can identify and evaluate quickly the samples of different harvest time of the leaves ofAlstoniascholaris(L.) R. Br. The optimal harvest time ofAlstoniascholaris(L.) R. Br. was from October to next February,which was the coldest season in the Dai calendar.
UV-Vis; HPLC fingerprint; Dai medicine;Alstoniascholaris(L.) R. Br.; Harvest time; Distinguish; Quality estimation
May 19,2015; accepted Oct. 2,2015)
2015-05-19、
2015-10-02
国家自然科学基金项目(81260608)和云南省自然科学基金重大项目(2013FC006)资助
杨妮娜、女、1988年生、云南中医学院中药学院研究生 e-mail:yangnina-2008@163.com *通讯联系人 e-mail: yzwang1981@126.com; 15887797260@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)12-4021-07
