不同粒径纳米羟基磷灰石牙膏对铅离子的吸附研究*
2016-06-05杨剑珍申晓青刘成霞徐平平
杨剑珍,申晓青,刘成霞,徐平平
(1.南方医科大学附属口腔医院广东省口腔医院牙体牙髓病科,广东 广州 510280;2. 南方医科大学珠江医院口腔科,广东 广州 510280)
不同粒径纳米羟基磷灰石牙膏对铅离子的吸附研究*
杨剑珍1,申晓青2,刘成霞1,徐平平1
(1.南方医科大学附属口腔医院广东省口腔医院牙体牙髓病科,广东 广州 510280;2. 南方医科大学珠江医院口腔科,广东 广州 510280)
比较不同粒径的纳米羟基磷灰石(n-HA)及掺入牙膏后对模拟废水中铅离子的吸附能力,并探讨掺n-HA牙膏对铅离子的吸附稳定性及作用机制。配制系列质量浓度的n-HA悬液及掺n-HA牙膏悬液,与初始质量浓度为1 mg/L的模拟铅溶液进行反应,静置24 h、14 d和28 d后,取上清液测定残余铅离子质量浓度,计算吸附率及吸附能力。结果显示,n-HA及其牙膏对铅离子的平均吸附率达95%左右,吸附能力随着HA粒径的减小而增大。掺n-HA牙膏的吸附能力显著优于掺微米级HA牙膏和空白牙膏,吸附作用随时间的推移解吸附现象不明显。HA及其牙膏对铅离子的吸附均符合Langmuir和Freundlish等温模型。研究表明,掺n-HA牙膏可有效去除模拟废水中的铅离子,是一种绿色环保的吸附剂,可为人们的日常保健行为赋予环保意义。
羟基磷灰石;吸附;铅离子;牙膏;纳米
羟基磷灰石( hydroxyapatite,HA)是人体骨和牙齿的主要组成成分,将HA掺入牙膏中,发现其在缓解牙本质敏感,早期釉质龋再矿化、美白等方面,可取得较好的效果[1-3]。新型羟基磷灰石牙膏在日本及欧美国家已投放市场,颇受消费者欢迎,如“APADENT” 羟基磷灰石药用牙膏。掺HA牙膏也能吸附模拟生活污水中的铅、铜、铬等重金属离子[4-6],这为人们的刷牙行为赋予了环保意义。因此,研究开发高效的掺HA牙膏,具有社会经济价值。
HA的吸附性能主要受其比表面积和表面活性的影响,减小颗粒尺寸至纳米级别可增大比表面积和提高表面活性,从而提高HA的吸附量[7-10]。将更具活性的不同粒径纳米羟基磷灰石(n-HA)添加入牙膏并对铅离子(Pb2+)进行吸附研究,此类研究未见报道。本实验Pb2+质量浓度采用2倍于国家Ⅲ类污水排放标准,在常温常压和pH中性条件下检测不同粒径的n-HA及其牙膏吸附Pb2+后是否能达到Ⅲ类污水排放标准,并比较不同粒径的n-HA及其牙膏的吸附能力和吸附稳定性。
1 实验方法
Quanta 400 FEG场发射扫描电子显微镜(SEM,荷兰飞利浦FEI公司),Tecnai G2 F30场发射透射电子显微镜(TEM,美国FEI公司),Pridigy XP电感耦合等离子发射光谱仪(ICP,美国Leeman公司),带能谱S-3700N场发射扫描电子显微镜(EDS,日本Hitachi公司)。
硝酸铅(分析纯,广州化学试剂厂),普通碳酸钙牙膏(佛山市口腔护理用品工程技术中心提供),HA(20 nm、30 nm、60 nm、12 μm)(北京高德威金属科技开发有限责任公司);掺HA牙膏,HA粒径分别为20 nm、30 nm、60 nm、12 μm,质量分数为3%,与普通碳酸钙牙膏混合制成。
1.2 实验准备
1.2.1 样品的表征 采用扫描电子显微镜(SEM)和透射电子显微镜(TEM) 检测HA的分散性、形貌及粒度。
1.2.2 Pb2+溶液的配置 准确称取硝酸铅1.599 0 g,置入1.0 L容量瓶中并加去离子水稀释至标线,吸取1.0 mL此铅离子液(质量浓度为1.0 g/L)置1.0 L容量瓶中,加去离子水至标线,配制成质量浓度为1.0 mg/L的铅离子储备溶液。
1.2.3 HA及掺入HA牙膏悬液的配制 电子天平准确称取粒径为20 nm、30 nm 、60 nm和12 μm的HA各0.030 g,取掺以上粒径的HA牙膏及空白牙膏各取1 g,分别用50 mL双重蒸馏水溶解,超声振荡3次( 30 s/次),放置磁力搅拌器搅拌,直到形成均匀的悬浊液。实验在持续搅拌的条件下进行,即配成质量浓度为0.6 g/L 的4种粒径的HA悬液,4组掺HA牙膏悬液及空白牙膏悬液浓度为20 g/L。用双重蒸馏水稀释成质量浓度(ρ)分别为0.015、0.03、0.06、0.12、0.18、0.24、0.30、0.36、0.42、0.48 g/L的HA悬液,对应的牙膏悬液质量浓度为0.50、1.0、 2.0、4.0、6.0、8.0、10、12、14、16 g/L,两者含HA的质量浓度相同。
⑭阿莱达·阿斯曼:《回忆空间:文化记忆的形式和变迁》,潘璐译,北京大学出版社2016年版,第297页。
1.2.4 铅离子吸附实验 取体积为50 mL、初始质量浓度为1 mg/L的铅离子溶液10份为1组,共9组,每组分别加入1 mL以上系列质量浓度的HA悬液或掺HA牙膏悬液,用摇床于室温下[(25±2) ℃]以300 r/min搅拌3 h,静置24 h。然后将溶液置于离心机离心(温度25 ℃,转速为3 000 r/min,时间为10 min)过滤,吸取滤液15 mL,利用ICP测定残余铅离子浓度,计算吸附率,比较不同粒径、不同浓度HA及其牙膏吸附铅离子的能力。
HA及掺HA牙膏对水溶液中重金属离子的吸附率计算公式:
(1)
其中,P为吸附率,%;Ct为水样中重离子浓度,mg/L;Vt为反应体系的体积,mL;V0为未反应前重离子溶液的体积, mL;C0为重金属离子溶液的初始质量浓度,mg/L。
HA或掺HA牙膏对水溶液中重金属离子的吸附能力计算公式:
(2)
其中,q为吸附能力,mg/g;Ct为水样中重金属离子溶液质量浓度,mg/L;Vt为反应体系的体积,L;V0为未反应前重金属离子溶液的体积,L;C0为重金属离子溶液的初始质量浓度,mg/L;m为HA或牙膏的质量,g。
1.2.5 稳定性实验 按照上述反应体系,分别静置14、28 d后,ICP测量残余Pb2+质量浓度,计算吸附率,比较不同粒径HA牙膏溶液吸附Pb2+能力的稳定性。
1.2.6 沉淀测定 将离心后离子溶液的沉淀物于120 ℃的恒温干燥箱内烘干至粉末状,EDS检测粉末元素组成。
1.2.7 吸附等温线 利用平衡吸附等温线可以研究吸附物与被吸附物之间的相互作用。本实验使用 Langmuir和Freundlish方程来描述吸附平衡。
Langmuir等温式:
(5)
式中,qmax为单分子层饱和吸附量,mg/g;b为Langmuir常数,1/mg。Freundlish等温式
(6)
式中,1/n、K为Freundlish常数。
2 结果与讨论
2.1 不同粒径HA的形貌特征
SEM下HA粉末形貌特征如图1所示,未经处理的n-HA粉末互相叠加在一起,而12 μm HA 粉末呈球形,颗粒间界限清晰。n-HA粉末经超声分散后透射电镜(TEM)下分散性较好,粒径均在纳米尺寸范围内,20 nm和60 nm HA的形貌为针状,30 nm HA为短棒状(图2)。
2.2 不同粒径n-HA及其牙膏对Pb2+的吸附情况比较
掺不同粒径n-HA及其牙膏对铅离子的吸附结果如图3、图4中所示,纯n-HA对铅溶液的吸附率相近,最高时吸附率接近100%,平均吸附率达95.71%。掺n-HA牙膏组对Pb2+的吸附率与n-HA组接近,平均为94.63%,但吸附率在整个浓度范围内的变化不大,说明n-HA掺入牙膏后对水溶液中铅离子的吸附更稳定。掺n-HA牙膏对Pb2+的吸附在较低浓度时即达到吸附平衡,说明少量掺n-HA牙膏的牙膏残夜进入下水道后能够有效的去除生活污水中的Pb2+,废物利用,可减少重金属水污染的防治成本,也为人们的日常保健行为赋予了环保意义。掺n-HA牙膏对铅离子的吸附率明显高于掺微米级HA(12 μm)牙膏和空白牙膏。微米级HA及其牙膏对铅溶液的吸附率随质量浓度的升高逐渐下降,但掺12 μm HA牙膏的平均吸附率(85.36%)较纯12 μm HA(77.89%)提高了7%,说明12 μm HA加入牙膏后与牙膏本身成分发生了协同吸附作用。空白牙膏组对Pb2+溶液也有一定的吸附效果,这可能是因为普通牙膏中的基本成分对Pb2+有一定的吸附能力。经测定,1 mg/L铅离子经HA及其牙膏吸附后剩余Pb2+质量浓度在0.038 8~0.297 8 mg/L范围,均能达到国家污水Ⅲ级排放标准(0.5 mg/L)。

图1 HA粉末的扫描电镜图像Fig.1 SEM images of micrograph of HA powers

图2 n-HA粉末的透射电镜图像Fig.2 TEM images of micrograph of n-HA powers
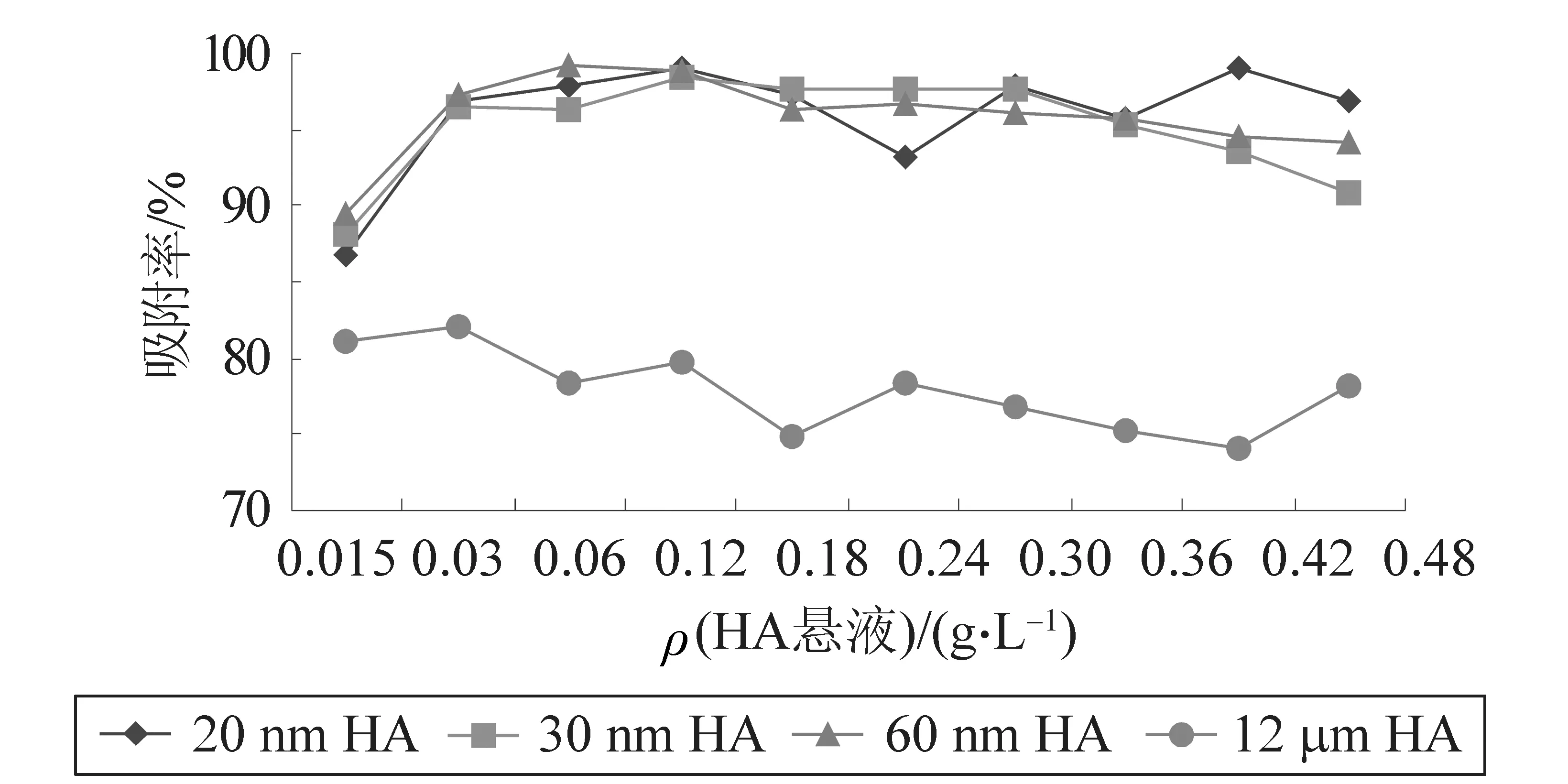
图3 20 nm、30 nm、60 nm、12 μm HA对Pb2+的吸附率(静置1 d)Fig.3 Adsorption rates of HA with different sizes for lead ion in 1 d

图4 掺HA牙膏和空白牙膏对Pb2+吸附率(静置1 d)Fig.4 Adsorption rate of HA dentifrice and blank dentifrice and blank dentifrice for lead ion in 1 d
2.3 掺不同粒径n-HA牙膏对Pb2+吸附的稳定性
图5显示,从静置1 d到静置14 d,掺n-HA牙膏组对Pb2+的吸附随着时间的推移,其吸附率呈现上升的趋势。从静置14 d到静置28 d,掺n-HA牙膏组的吸附率出现了不同程度的下降(下降幅度为0.52%~18.20%),说明发生了解吸现象。其中掺30 nm HA牙膏的吸附率波动幅度最小,说明掺30 nm HA牙膏组的吸附最稳定。从静置1 d到静置14 d,掺12 μm HA牙膏和空白牙膏的吸附率随时间的推移明显上升,上升幅度约5%,从静置14 d到28 d,吸附率明显下降(下降幅度分别为10%、15%),出现了明显的解吸现象,说明掺12 μm HA牙膏和空白牙膏对铅溶液的吸附不稳定。各实验组均在14 d时达到吸附平衡,平衡时间较文献报道的时间长(HA对Pb2+的吸附在反应30 min-24 h时达到吸附平衡)[11-12],这可能与HA加入牙膏后发生缓慢释放有关。
2.4 n-HA及其牙膏对Pb2+吸附的反应残留物EDS测定
n-HA及其牙膏悬液与Pb2+溶液混合反应后所得沉淀物经干燥所成粉末经EDS检测发现粉末有铅元素分布(如图6),进一步证实Pb2+溶液中的铅为HA及其牙膏所吸附沉淀的。
2.5 不同粒径n-HA及其牙膏对铅离子吸附的吸附等温线
吸附等温线可在一定程度上反映吸附剂与吸附物的特性,其形式在许多情况下与实验所用的溶质浓度区段有关,常用于描述水体系中的吸附等温线有Langmuir型和Freundlish型[7, 11-13]。将上述吸附数据采用 Langmuir方程和Freundlish方程对吸附等温线进行分析,得到HA及其牙膏对Pb2+的吸附与两种吸附等温式均有较好的相关性(各种参数见表1、表2),说明HA及其牙膏对Pb2+的吸附符合单分子层吸附。从表1、表2中可以看出n-HA组及其牙膏组的最大吸附量均高于12 μm HA组及其牙膏组和空白牙膏组。本实验中的n-HA对Pb2+的吸附率不相上下,吸附能力却是20 nm>60 nm>30 nm>12 μm,即HA粒径越小,HA最大吸附量越高,吸附能力越好,与其他学者的研究结果一致[7, 9, 14]。30 nm略有不同,可能是30 nm HA为短棒状,而20 nm和60 nm HA均为针状,n-HA的吸附能力除了与其粒径大小有关外,还与其形貌有一定的关系[15]。研究还发现,纯HA组的最大吸附量明显高于HA牙膏组,可能是HA纳米颗粒与牙膏成分混合应用时发生了团聚,形成大小不一的较大颗粒团簇,无法发挥出纳米材料的优越性[16]。一般认为,Freundlish方程中的K值大,吸附能力强,1/n=0.1~0.5时,容易吸附[17],从表1、表2中可以看出: HA及其牙膏的0.1<1/n<0.5,最小K=171.44,说明HA及其牙膏、空白牙膏对Pb2+的吸附反应容易进行,吸附容量较大。
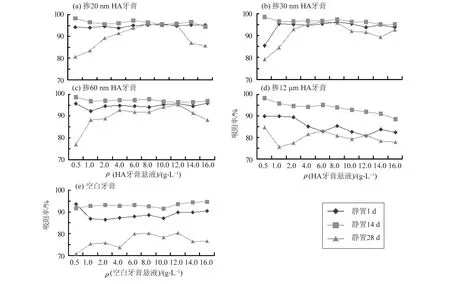
图5 静置1 d、14 d、28 d后, 掺HA牙膏吸附Pb2+情况Fig.5 Adsorption rates of HA dentifrice for lead ion in 1,14 and 28 d
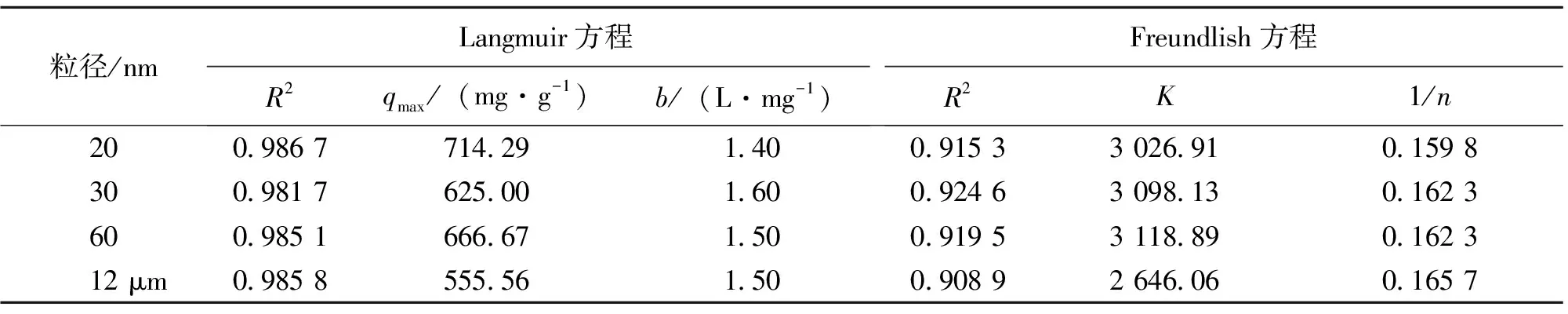
表1 20 nm、30 nm、60 nm、12 μm HA吸附Pb2+的等温线吸附参数1)
1)qmax为饱和吸附量,代表吸附能力;b为Langmuir常数,代表吸附剂结合位点对金属离子的结合强度

表2 掺20 nm、30 nm、60 nm、12 μm HA牙膏吸附Pb2+的等温线吸附参数
2.6 不同粒径n-HA及其牙膏对Pb2+的吸附机制
目前,大量研究证实,HA吸附Pb2+的主要机制为溶解—沉淀,并有X线衍射分析、电子显微镜等微观证据证实反应残留物中有磷氯铅矿沉淀形成,而且通过实验对溶解-沉淀过程中晶体成核-生长的动力学模型进行了验证[17]。另外,学者还认为溶解—沉淀和离子交换机制不能完全解释HA吸附Pb2+的行为,并提出还有表面络合机制[12, 19]。本实验也发现,HA及其牙膏对Pb2+的吸附率很高,在低质量浓度时即达到吸附平衡,主要吸附机制为溶解—沉淀、表面络合、离子交换等化学反应过程。
3 小 结
不同粒径n-HA及其牙膏对模拟废水中的Pb2+具备较强的吸附能力,吸附能力随粒径减小而增大。掺n-HA牙膏对Pb2+的吸附随时间的推移解吸附现象不明显,稳定性较好,尤以掺30 nm HA牙膏组最佳。
n-HA及其牙膏对Pb2+的吸附符合Langmuir和Freundlish等温模型,吸附Pb2+的机制为溶解-沉淀、表面络合、离子交换等化学反应过程。
[1] GOPINATH N M, JOHN J, NAGAPPAN N, et al. Evaluation of dentifrice containing nano-hydroxyapatite for dentinal hypersensitivity: a randomized controlled trial[J]. J Int Oral Health, 2015,7(8):118-122.
[2] SOUZA B M, COMAR L P, VERTUAN M, et al. Effect of an experimental paste with hydroxyapatite nano-particles and fluoride on dental demineralisation and remineralisationinsitu[J]. Caries Res, 2015,49(5):499-507.
[3] VANO M, DERCHI G, BARONE A, et al. Tooth bleaching with hydrogen peroxide and nano-hydroxyapatite: a 9-month follow-up randomized clinical trial[J]. Int J Dent Hyg, 2015, 13(4):301-307.
[4] 刘晶.掺羟基磷灰石牙膏对多种重金属离子吸附作用的研究[D].广州:南方医科大学, 2013.
[5] 刘成霞,申晓青,杨剑珍,等. 羟基磷灰石的粒径及其掺入牙膏后对镉离子吸附作用的研究[J]. 中山大学学报(自然科学版), 2015,54(3):98-101.
[6] 马伟群,黄建生,徐平平. 掺羟基磷灰石牙膏对早期龋的修复及吸附镉离子作用研究[J]. 日用化学工业,2014, 44(5): 266-269.
[7] ZHANG J, WANG D, ZHOU J, et al. Precise adsorption behavior and mechanism of Ni(Ⅱ) ions on nano-hydroxyapatite[J]. Water Environ Res, 2010,82(11):2279-2284.
[8] YUAN P, SHEN X, LIU J, et al. Effects of dentifrice containing hydroxyapatite on dentinal tubule occlusion and aqueous hexavalent chromium cations sorption: a preliminary study[J]. PLoS One, 2012,7(12):e45283.
[9] 张鹏,管红雨,钟小君. 钛种植体羟基磷灰石和神经生长因子复合涂层的制备及缓释性能研究[J].广东牙病防治,2014,22(5):238 -240.
[10] 胡诗靖. 含不同粒径羟基磷灰石牙膏吸附重金属离子的研究[D]. 广州:南方医科大学, 2014.
[11] STOTZEL C, MULLER F A, REINERT F, et al. Ion adsorption behaviour of hydroxyapatite with different crystallinities[J]. Colloids Surf B Biointerfaces, 2009,74(1):91-95.
[12] HASHIMOTO Y, SATO T. Removal of aqueous lead by poorly-crystalline hydroxyapatites[J]. Chemosphere, 2007,69(11):1775-1782.
[13] VILA M, SANCHEZ-SALCEDO S, CICUENDEZ M, et al. Novel biopolymer-coated hydroxyapatite foams for removing heavy-metals from polluted water[J]. J Hazard Mater, 2011,192(1):71-77.
[14] ISLAM M, MISHRA P C, PATEL R. Physicochemical characterization of hydroxyapatite and its application towards removal of nitrate from water[J]. J Environ Manage, 2010, 91(9):1883-1891.
[15] 孙玉绣,周松,杨华.羟基磷灰石纳米离子制备及其对Pb2+离子的吸附性能[J]. 环境化学,2010,2(6):1059-1062.
[16] MULLER K H, MOTSKIN M, PHILPOTT A J, et al. The effect of particle agglomeration on the formation of a surface-connected compartment induced by hydroxyapatite nanoparticles in human monocyte-derived macrophages[J]. Biomaterials, 2014,35(3):1074-1088.
[17] POINERN G E, GHOSH M K, NG Y J, et al. Defluoridation behavior of nanostructured hydroxyapatite synthesized through an ultrasonic and microwave combined technique[J]. J Hazard Mater, 2011,185(1):29-37.
[18] ZHANG Z, LI M, CHEN W, et al. Immobilization of lead and cadmium from aqueous solution and contaminated sediment using nano-hydroxyapatite[J].Environ Pollut, 2010,158 (2):514-519.
[19] MAVROPOULOS E, ROSSI A M, COSTA A M, et al. Studies on the mechanisms of lead immobilization by hydroxyapatite[J]. Environ Sci Technol, 2002, 36(7):1625-1629.
Lead cations adsorption by dentifrice containing nano hydroxyapatite particles with different sizes
YANGJianzhen1,SHENXiaoqing2,LIUChengxia1,XUPingping1
(1.Department of Endodontics, the Affiliated Stomatological Hospital of Southern Medical University and Guandong Provincial Stomatological Hospital, Guangzhou 510280,China;2. Department of Stomatology, Zhujiang Hospital Southern Medical University, Guangzhou 510280,China)
Toothpaste with nano HA was conducted according to the adsorption of lead ions in synthetic wastewater. Comparisons were made between distinct particle sizes of nano HA based on the adsorption effect of lead ions. Meanwhile, the stability of adsorption and mechanism of nano HA toothpaste was investigated. The suspensions of nano HA, HA dentifrice and blank dentifrice with different concentrations were prepared.Lead ion solutions with initial concentration of 1.0 mg /L were mixed with these suspensions respectively. Following being kept still for 24 h, 14 d and 28 d, the residual lead ion concentration of the supernatant was measured, the sorption rate and sorption ability was calculated. The result showed that the nano HA and nano HA dentifrice with various particle sizes had strong abilities of absorbing lead ions from simulated waste water, the average adsorption rate was determined to be 95%. The adsorption capacity of nano HA increased with the decrease of particle sizes. The adsorption capacity of nano HA dentifrice was significantly higher than that of the micro HA dentifrice and blank dentifrice. The effects of nano HA dentifrice group on Pb2+adsorption were relatively stable, of which no desorption were detected subsequently. Both Langmuir and Freundlich equations were sued to simulate the sorption processes of the nano HA and HA dentifrice. The result indicated that the dentifrice containing nano HA could reduce the lead ions effectively,and could be used as an environmental protection absorbent, which is beneficial to giving environmental significance for the daily health caring behavior.
hydroxyapatite; adsorption; lead ions;dentifrice; nano
10.13471/j.cnki.acta.snus.2016.04.012
2016-02-03
广东省自然科学基金资助项目(2014A030313330)
杨剑珍(1982年生),女;研究方向:口腔临床医学;通讯联系人:徐平平;E-mail:gdskqyykjk@163.com
TQ658.4+1
A
0529-6579(2016)04-0068-07
