不同保存方法对少孢节丛孢菌存活及捕食活性的影响
2016-06-03孟庆玲贡莎莎赵海龙张星星罗建勋朱兴全
孟庆玲,贡莎莎,乔 军,赵海龙,张星星,罗建勋 ,朱兴全
(1 .石河子大学 动物科技学院,新疆石河子 832003;2.中国农业科学院 兰州兽医研究所,兰州 730046)
不同保存方法对少孢节丛孢菌存活及捕食活性的影响
孟庆玲1,贡莎莎1,乔军1,赵海龙1,张星星1,罗建勋2,朱兴全2
(1 .石河子大学 动物科技学院,新疆石河子832003;2.中国农业科学院 兰州兽医研究所,兰州730046)
摘要为了探讨少孢节丛孢菌分生孢子及菌丝长期保存方法,以分生孢子萌发、菌丝生长、产生捕食器和捕食能力为指标,比较少孢节丛孢菌分生孢子及菌丝在不同保存条件下的保存效果。结果表明,在3种保存溶液中、-20 ℃条件下冻存3 a的分生孢子没有萌发长出菌丝,而在4 ℃条件下保存3 a的分生孢子仍可以萌发长出菌丝,且能产生捕食器捕食线虫。在固体培养基CMA和YPSSA生长的菌丝于-20 ℃或4 ℃条件下保存2 a,菌丝仍可生长并产生捕食器捕食线虫;但在-20 ℃保存2 a的菌丝复苏后接种对绵羊粪便中线虫的捕食活性较冻存前有所下降。研究结果提示,少孢节丛孢菌分生孢子可在3种保存溶液中4 ℃条件下及在固体培养基CMA、YPSSA中于-20 ℃或4 ℃条件下均可长期保存,但在3种保存溶液中4 ℃条件下菌株的捕食活性最高。
关键词少孢节丛孢菌;捕食线虫性真菌;菌种保存
家畜线虫病是由线形动物门线虫纲所属各种寄生性线虫寄生于家畜所引起的一类疾病,目前,主要采取化学药物防控该病。然而,随着化学驱虫药的长期使用而产生的抗药性、药物残留、环境污染等问题日益严重,迫切需要寻找一种新的方法将寄生性线虫控制在较低的危害水平,以获得最佳的经济、生态和社会效益[1-6]。目前,最有应用前景的是利用寄生性线虫的天敌——捕食线虫性真菌进行生物防治[7-8]。捕食线虫性真菌在自然界中分布很广。近几年,对捕食线虫性真菌生态学和临床应用等方面的研究已经发现其具有极大的利用空间和潜在的市场价值。长期保存捕食线虫性真菌菌种并使其保持捕食活性是研发生物防控制剂的前提。现有的实验室保存捕食线虫性真菌的方法有如连续转接法、土壤保存法、液氮保存法等,然而这些方法都存在一定的弊端:连续转接,易发生污染并导致菌株生物活性发生改变,捕食能力下降;土壤保存则费时费力,且不易再次重新进行纯化分离;而液氮保存则需要一定条件,操作麻烦。因此,本试验对捕食线虫性真菌的代表菌——少孢节丛孢菌在不同保存条件下,通过比较保存前后菌株分生孢子及菌丝的复苏、捕食器产生能力和捕食活性,以期探讨不同保存方法对少孢节丛孢菌捕食活性的影响,为进一步研发防控家畜消化道线虫病的生防制剂奠定基础。
1材料与方法
1.1仪器、试剂及培养基
霉菌培养箱、冰箱、倒置显微镜、普通光学显微镜、冷冻管、琼脂粉和新鲜玉米粉等由石河子大学动物疾病防控兵团重点实验室提供。CMA 、YPSSA和玉米粒培养基参照考桂兰等[9]提供的方法制备。
1.2保存溶液或介质
0.4 g/L玉米粉 CMA培养基,YPSSA培养基,质量分数0.05%吐温-80溶液,质量分数0.05%吐温-80-5%甘油溶液,质量分数0.05%吐温-80-10%聚乙二醇溶液。
1.3少孢节丛孢菌及其分生孢子
所用菌株来源于实验室保存的9株少孢节丛孢菌(Arthrobotrysoligospora)分别命名为A-XJ1、B-XJ2、C-XJ3、D-XJ4、H-XJ8、J-XJ10、K-XJ11、L-XJ12和M-XJ13。将9株少孢节丛孢菌分别接种于CMA培养基中,于真菌培养箱 21 ℃培养7 d后,将培养基切成小块,转接于玉米粒培养基培养25 d后,分别用质量分数0.05%吐温-80溶液、质量分数0.05%吐温-80-5%甘油溶液、质量分数0.05%吐温-80-10%聚乙二醇溶液洗脱,即获得分生孢子,调整分生孢子的数量为5×105mL-1。
1.4诱饵线虫分离与纯化
采集绵羊真胃中寄生的捻转血矛线虫(Haemonchuscontortus)雌虫,取出虫卵于24 ℃培养12 d,参照王为升[10]的贝尔曼氏法分离第3期幼虫(L3),在光学显微镜下计数,并调整幼虫混悬液的含量为2 000 mL-1,4 ℃冰箱保存,备用。
1.5含捻转血矛线虫虫卵羊粪的收集
选择3只健康的绵羊单独饲喂,口服阿苯达唑驱虫,1周后,用布兜悬空法收集羊粪,用漂浮法检查羊粪中虫卵情况,直至虫卵转阴为止。用H.contortusL3感染绵羊(每只20 000条),23~30 d时收集羊粪,备用。
1.6不同保存溶液及温度对少孢节丛孢菌分生孢子的影响
在5 mL冷冻管中分别加入“1.3”中获得的 9株少孢节丛孢菌分生孢子悬液2 mL,于 -20 ℃冰箱冻存3 a后,取出融化摇匀,用移液器取20 μL于载玻片上,盖上盖玻片,镜下观察分生孢子的形态。同时接种于CMA培养基上,观察分生孢子有无萌发、有无菌丝长出。同时,将9株少孢节丛孢菌分生孢子悬液于4 ℃保存3 a后,取出,用移液器取20 μL于载玻片上,盖上盖玻片,镜下观察分生孢子的形态。同时接种于CMA培养基上,观察分生孢子有无萌发、有无菌丝长出。若有菌丝生长,滴加诱饵线虫H.contortusL3进行诱导,显微镜下观察其有无捕食器产生及有无幼虫被捕食。
1.7不同保存介质及温度对少孢节丛孢菌的影响
将9株少孢节丛孢菌分别转接于CMA培养基和YPSSA培养基中,待菌丝长满平皿,用封口膜封好平皿,分别于-20 ℃和4 ℃保存2 a后取出,再分别转接于CMA培养基,置于21 ℃真菌培养箱培养,观察菌丝生长情况,若有菌丝生长,滴加诱饵线虫-H.contortusL3进行诱导,显微镜下观察其有无捕食器产生及有无幼虫被捕食。
1.8少孢节丛孢菌对绵羊粪便中H.contortusL3捕食活性影响的测定
将在-20 ℃条件下保存2 a的9株少孢节丛孢菌,解冻后分别转接于CMA培养基,待菌丝长满平皿后,分别切块转接于玉米粒培养基中,于真菌培养箱 21 ℃培养25 d后,用含0.05%吐温-80洗脱液洗脱分生孢子,最终配成5×105mL-1分生孢子悬液。将收集的绵羊粪碾碎,混合均匀后分成10组,其中1个对照组,9个试验组,每组3个重复,每个重复100 g粪便,置于平皿内,每组羊粪加入1株少孢节丛孢菌的分生孢子悬液1 mL,后放在21 ℃下避光培养。10 d后采用贝尔曼氏幼虫分离法收集各组幼虫。统计各组幼虫数(LPG),计算捕食率。捕食率=(对照组LPG-试验组LPG)/对照组LPG×100%。与动物疾病防控兵团重点实验室前期做的少孢节丛孢菌对粪中幼虫捕食率[10]进行比较,观察冻存前后少孢节丛孢菌捕食能力是否发生变化。
2结果与分析
2.1不同保存溶液及温度对少孢节丛孢菌分生孢子的影响
少孢节丛孢菌分生孢子在0.05%吐温-80溶液、0.05%吐温-80-5%甘油溶液、0.05%吐温-80-10%聚乙二醇溶液、0.05%吐温-80溶液、0.05%吐温-80-5%甘油溶液、0.05%吐温-80-10%聚乙二醇溶液条件下保存3 a后的萌发、菌丝生长、产生捕食器及捕食情况见表1。
在3种保存溶液中,在-20 ℃条件下冻存3 a 的9株少孢节丛孢菌分生孢子,在显微镜下均可看到清晰的分生孢子:分生孢子有隔无色双胞,呈梨形,分隔处稍缢缩,大小为23 μm×13 μm(图1-A);但是接种到CMA培养基后,均未萌发,无菌丝生长。
在3种保存溶液中,4 ℃条件下保存3 a的9株少孢节丛孢菌分生孢子,镜下观察均可见分生孢子,分生孢子呈梨形,有隔无色双胞,分隔处稍缢缩。接种到CMA培养基后分生孢子萌发率达到90% 以上(图1-B)。加入诱饵线虫H.contortusL3后菌丝可以产生捕食器,并且可以捕食H.contortusL3(图1-C、D)。
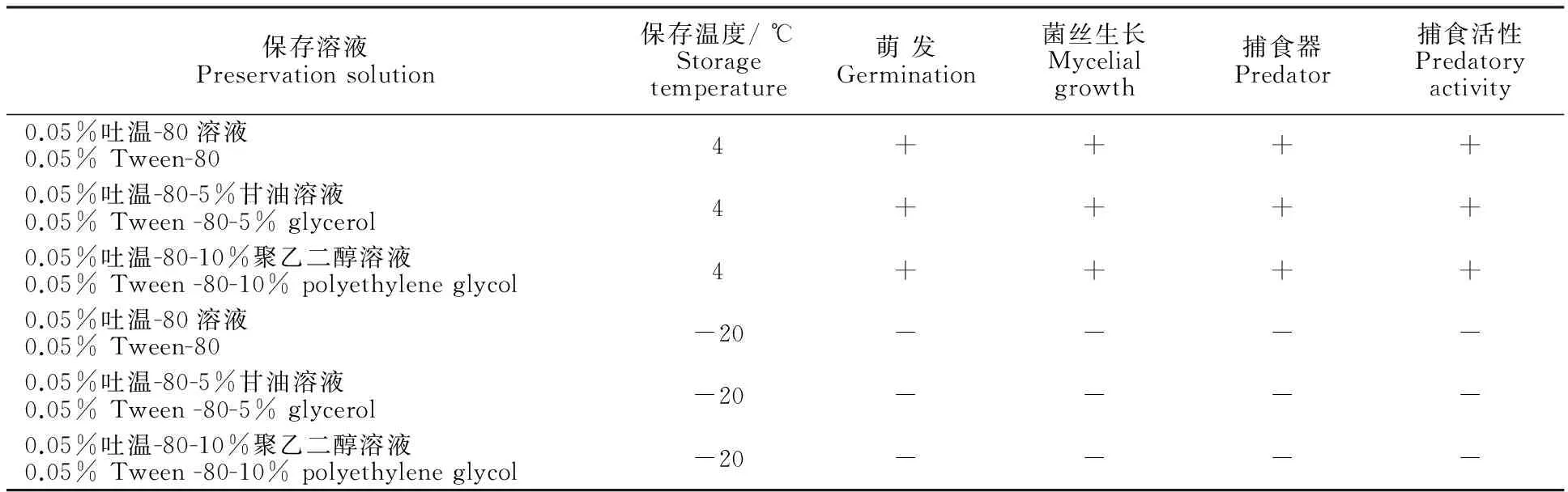
表1 少孢节丛孢菌分生孢子在各种保存条件下的萌发、菌丝生长、产生捕食器及捕食活性
注:“+”表示试验结果为阳性,“-”表示试验结果为阴性。
Note:“+” shows the test result is positive,“-” shows the test result is negative.
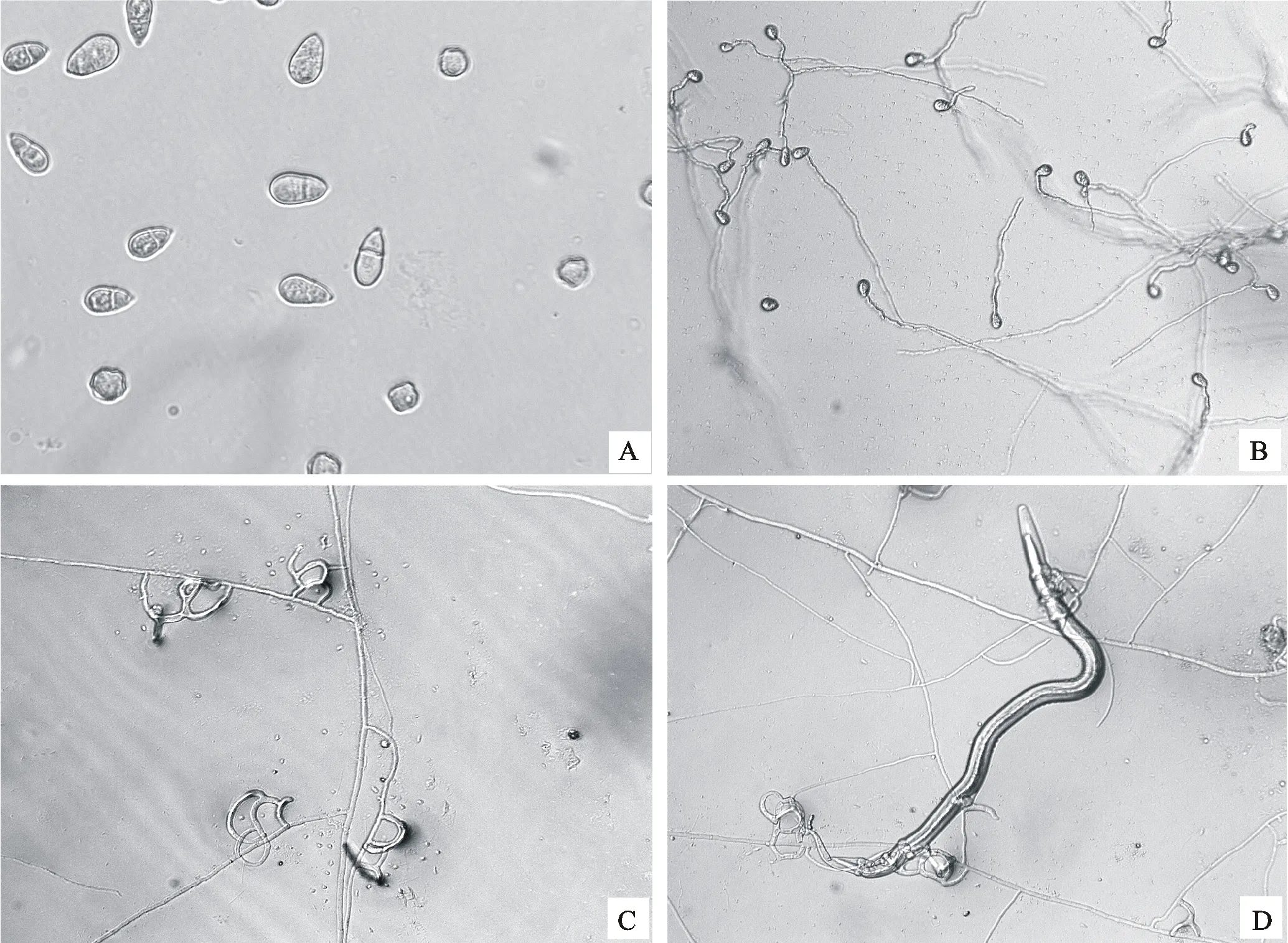
A.保存于-20 ℃的分生孢子形态Morphological characteristics of conidia stored at -20 ℃;B. 保存于4 ℃的分生孢子经培养后萌发情况Spore germination saved at 4 ℃;C. 分生孢子萌发后菌丝特化形成捕食器Spores germinate to form predator;D. 特化形成的捕食器对线虫的捕获Capture of nematodes by specialized predator
图1-20 ℃和4 ℃条件下保存对9株少孢节丛孢菌分生孢子形态及生存能力的影响
Fig.1Effects of 4 ℃ or -20 ℃ on conidia and germination of 9 strains ofA.oligospora
2.2不同保存介质及温度对少孢节丛孢菌生存能力的影响
在2种固体保存介质中,-20 ℃条件下冻存2 a的9株少孢节丛孢菌解冻后分别接种于CMA培养基,9株菌全部有菌丝生长,菌丝为白色,发达,呈密集的丝状体,在培养基质内或培养基质表面呈树枝状延伸生长;菌丝粗细不均,主干菌丝稍粗,分枝菌丝稍细,菌丝无色有隔,并且距离不等(图2-A);加入诱饵线虫后有少量的单个菌环产生(图2-B),随后在单个菌环上又长出2~3个菌环,随着时间的延长,菌环增多,形成三维菌网(图2-C);产生的菌环或菌网可粘住或套住诱饵线虫(图2-D)。在2种固体保存介质中,在4 ℃条件下冻存2 a的9株少孢节丛孢菌分别接种于CMA培养基,9株菌的生存能力与“2.2.1” 相同,也可以产生捕食环或捕食网,可对线虫进行捕食。
2.3少孢节丛孢菌对绵羊粪便中H.contortusL3捕食活性的影响
将在-20 ℃条件下保存2 a的9株少孢节丛孢菌,解冻后分别转接于CMA培养基,待菌丝长满平皿后,分别切块转接于玉米粒培养基中,于真菌培养箱 21 ℃培养25 d后,用含0.05%吐温-80溶液洗脱分生孢子,将分生孢子与羊粪混合。结果9株菌对粪便中H.contortusL3的捕食活性全部降低,但降低程度存在差异(图3);其中保存前活性最高的A-XJ1株,捕食活性从97.6%下降到83.3%,下降最明显;而保存前活性相对较低的J-XJ10株捕食活性下降最少,只下降了1.4%;K-XJ11捕食活性下降幅度最大,达到14.4%;此外,捕食活性下降幅度比较大的还有B-XJ2、D-XJ4,下降幅度均在10%以上。
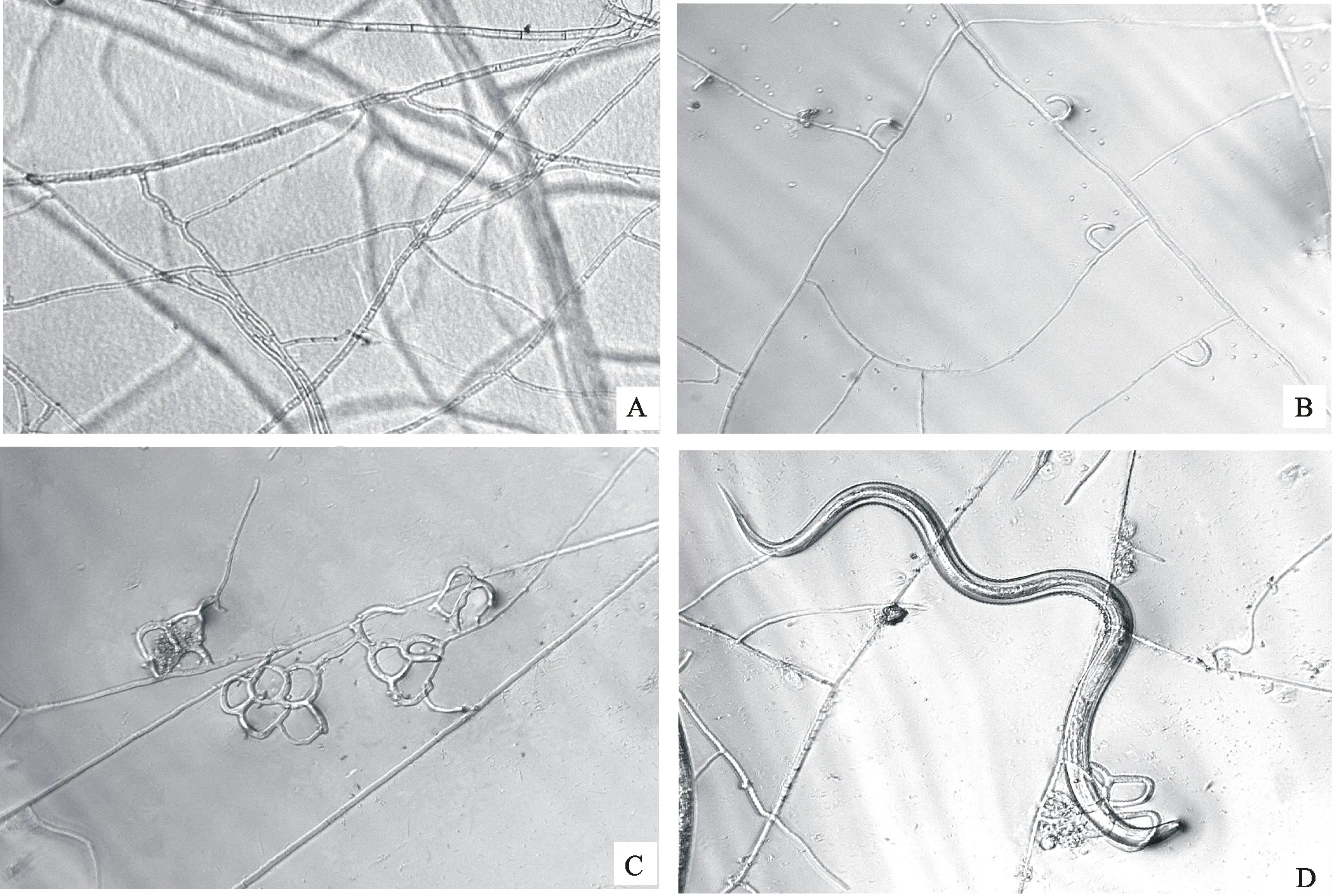
A. 解冻后接种于CMA培养基的菌丝呈树枝状延伸生长Hyphae inoculated CMA extending dendritic growth after thawing the culture medium;B. 加入H.contortusL3诱导12 h后产生的捕食环H.contortusL3 induces prey ring after 12 h;C. 加入H.contortusL3诱导24 h后产生的捕食菌网H.contortusL3 induces prey network after 24 h;D.H.contortusL3被捕食器捕获H.contortusL3 captured by prey network
图2-20 ℃条件下保存于YPSSA培养基的菌株存活及捕食结构产生情况
Fig.2Effects of YPSSA medium on conidia and germination ofA.oligospora
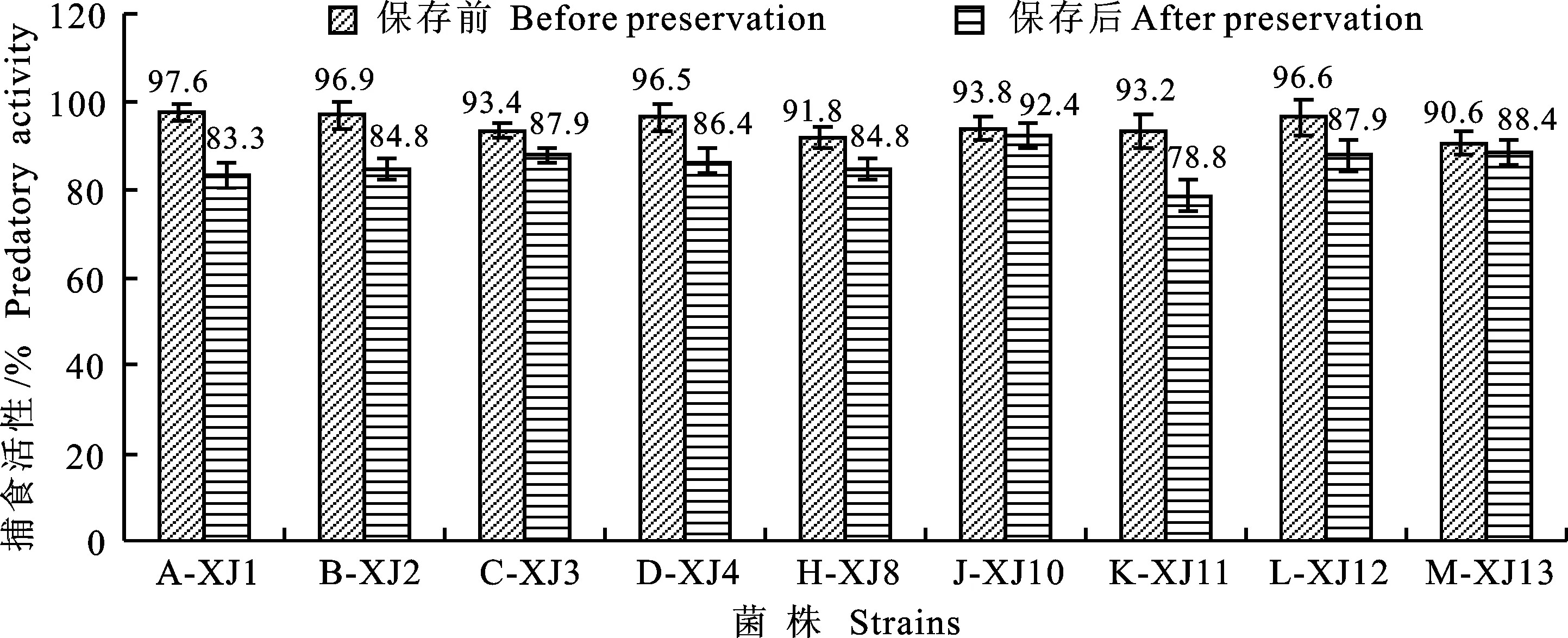
图3 保存前后9株少孢节丛孢菌对绵羊粪便中H.contortus L3捕食活性的比较
3讨 论
在捕食线虫性真菌生物制剂研发中,如何长期保存真菌菌种,并且保持其捕食能力,是真菌研究者非常关注的问题。本试验探讨了在常规的保存条件下少孢节丛孢菌分生孢子被保存3 a后及菌丝被保存2 a后的生存能力和捕食能力,发现分生孢子-20 ℃冻存3 a后虽保持固有形态,但其活力丧失。在前期的预试验中,曾将分生孢子于-20 ℃冻存5 d,解冻后,转接于CMA培养基,分生孢子可以萌发长出菌丝,并且可以产生捕食器捕食线虫;这与考桂兰等[10]研究结果一致。少孢节丛孢菌分生孢子在3种保存溶液中、4 ℃条件保存3 a后,分生孢子仍保持活力,能够长出菌丝,产生捕食器捕食线虫。证实4 ℃条件下可长期保存分生孢子,此种保藏方法简便易行,费用低廉,菌种保存时间长而不需要其他处理,适用于大批量的菌种长期保存,为今后实验室保存少孢节丛孢菌分生孢子提供了依据。
在本试验中,9株少孢节丛孢菌在2种固体保存介质中,-20 ℃或4 ℃ 保存2 a后分别接种于CMA培养基,9株菌全部有菌丝生长,且能产生捕食器捕食诱饵线虫。有些真菌室采用了一些菌株保存法有:移种传代保存法、液体石蜡覆盖保存法、低温冰箱保存法、冷冻干燥保存法等。但经过长期的实践后发现,这些方法都不太理想,原因是:①菌株易发生变异;②费时、费力、费资金;③融化后的菌种不能再次低温冰箱冷冻保存;④操作复杂, 需要昂贵的仪器设备[11-14]。因真菌的种类繁多,每种真菌有其自身的特点,为了寻找适合少孢节丛孢菌的保存方法,本实验室在前期工作的基础上,选用菌丝作为菌种在固体培养基中保存,结果表明在-20 ℃或4 ℃ 保存2 a后的少孢节丛孢菌仍保持活力。
为了探讨少孢节丛孢菌长期低温保存后其捕食活性的变化,本试验将扩繁的分生孢子与羊粪混合培养,结果表明9株少孢节丛孢菌对羊粪中H.contortusL3的捕食活性均有不同程度的降低,其中有5株的捕食活性降低10%以上,另外4株的捕食活性下降小于10%。试验所用9株分离自新疆不同地区[9,15],由于不同生态环境对少孢节丛孢菌具有不同的遗传背景,因此从不同地区分离的少孢节丛孢菌可能在温度的适应性方面存在差异,导致不同的菌株对低温的耐受性不同。本试验为进一步研发防控家畜消化道线虫病的生防制剂奠定了前期基础。
参考文献Reference:
[1]杨晓野,吴彩艳,杨莲茹,等.口服少孢节丛孢菌孢子对家畜粪便中线虫幼虫的杀灭研究[J].畜牧兽医学报,2005,36(9):927-930.
YANG X Y,WU C Y,YANG L R,etal.Study of conidia ofArthrobotrysoligosporaadministrated orally on killing the nematode larvae in faeces of domestic animals [J].ActaVeterinariaEtZootechnicaSinica,2005,36(9):927-930(in Chinese with English abstract).
[2]FARRELL F C,JAFFEE B A,STRONG D R.The nematode-trapping fungusArthrobotrysoligosporain soil of the Bodega marine reserve:distribution and dependence on nematode-parasitized moth larvae [J].SoilBiologyandBiochemistry,2006,38(6):1422-1429.
[3]KELLY P,GOOD B,HANRAHAN J P,etal.Screening for the presence of nematophagous fungi collected from Irish sheep pastures [J].VeterinaryParasitology,2009,165(3):345-349.
[4]WANG W S,MENG Q L,QIAO J,etal.Isolation ofArthrobotrysoligosporafrom soil of the Chinese Northern Tianshan Mountain slope pasture show predatory ability againstHaemonchuscontortuslarvae [J].BiocontrolScienceandTechnology,2014,24(2):170-179.
[5]孟庆玲,乔军,王辉胜,等.捕食线虫性真菌——少孢节丛孢菌口服生物制剂安全性试验[J].西北农业学报,2014,23(4):198-201.
MENG Q L,QIAO J,WANG H SH,etal.Safety of oral biological based om nematode-trapping fungi——Arthrobotrysoligospora[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(4):198-201(in Chinese with English abstract).
[6]杨晓野,汪明,杨莲茹,等.寄生虫生物控制概述[J].中国兽医杂志,2003,39(7):30-32.
YANG X Y,WANG M,YANG L R,etal.Overview of biological control against parasites [J].ChineseJournalofVeterinaryMedicine,2003,39(7):30-32(in Chinese with English abstract).
[7]KETZIS J K,TAYLOR A,BOWMAN D D,etal.Chenopodium ambrosioides and its essential oil as treatments forHaemonchuscontortusand mixed adult-nematode infections in goats[J].SmallRuminantResearch,2002,44(3):193-200.
[8]BARCANTE J M P,BARCANTE T A,DIAS S R C,etal.A method to obtain axenic Angiostrongylus vasorum first-stage larvae from dog feces [J].Parasitology,2003,8(9):89-93.
[9]考桂兰,石鑫,杨晓野,等.捕食线虫性真菌菌种保存技术的研究[J].中国预防兽医学报,2004,26(5):385-388.
KAO G L,SHI X,YANG X Y,etal.Safety of preserving of technique for nematode-trapping fungi [J].ChineseJournalofPreventiveVeterinaryMedicine,2004,26(5):385-388(in Chinese with English abstract).
[10]王为升.捕食线虫性真菌的分离鉴定及高效菌株的筛选 [D].石河子:石河子大学,2013.
WANG W SH.Isolation and Identification of nematode-trapping fungi and screening of high-performance strains [D].Shihezi:Shihezi University,2013(in Chinese with English abstract).
[11]张俊达,孙厚华.常见医学真菌菌种低温真空冷冻干燥长期保存后存活情况研究 [J].中国麻风皮肤病杂志,2006,22(3):213-214.
ZHANG J D,SUN H H.Study on survival of common medicine fungi after cryogenic vacuum freeze drying preservation [J].ChinaJournalofLeprosyandSkinDiseases,2006,22 (3):213-214(in Chinese with English abstract).
[12]HOMOLKA L,LISA L,NERUD F.Basidiomycete cultures on perlite survive successfully repeated freezing and thawing in cryovials without subculturing [J].JournalofMicrobiologicalMethods,2007,69(3):529-532.
[13]张振,苏晓庆.灭蚊真菌贵阳腐霉长期保存方法的研究 [J].贵阳医学院学报,2013,38 (2):115-119.
ZHANG ZH,SU X Q .A study on factors affecting long-term storage ofPythiumguiyangenseSu [J].JournalofGuiyangMedicalCollege,2013,38 (2):115-119(in Chinese with English abstract).
[14]吴婧,李东明,DEHOOG G S,等.病原性丝状真菌的菌种保藏方法 [J].中国真菌学杂志,2011,6 (5):305-307.
WU J,LI D M,DEHOOG G S,etal.Preservation of pathogenic filamentous fungi [J].ChineseJournalofMycology,2011,6 (5):305-307(in Chinese with English abstract).
[15]孟庆玲,王为升,王俊伟,等.少孢节丛孢菌的分离鉴定及捕食线虫活性研究[J].中国预防兽医学报,2011,33(3):189-193.
MENG Q L,WANG W SH,WANG J W,etal.Isolation,identification and predation activity ofArthrobotrysoligosporaXinjiang isolates [J].ChineseJournalofPreventiveVeterinaryMedicine,2011,33(3):189-193(in Chinese with English abstract).
Received 2015-06-05Returned2015-07-18
Foundation itemSupported by the National Natural Science Foundation of China (No. 31260601,No.31460654); the Doctoral Research Fund of Xinjiang Production and Construction Corps (No. 2010JC09); Special Fund for Agro-scientific Research in the Public Interests (No. 201303037).
First authorMENG Qingling, female, Ph.D,professor.Research area:animal parasitology.E-mail:2448986506@qq.com
(责任编辑:潘学燕Responsible editor:PAN Xueyan)
Effects of Different Methods for Fungi Preservation on Germination and Predation Activity ofArthrobotrysoligospora
MENG Qingling1, GONG Shasha1, QIAO Jun1, ZHAO Hailong1,ZHANG Xingxing1, LUO Jianxun2and ZHU Xingquan2
(1.Department of Animal Science and Technology, Shihezi University, Shihezi Xinjiang832003, China;2.Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences,Lanzhou730046, China)
AbstractTo explore the best preservation method of spores and hyphae for prolonging its effective preservation period, methods and conditions for Arthrobotrys oligospora (A.oligospora) were studied by comparing the different indexes of spore germination, predator generation and predatory activity before and after preservation of strain. Among the three preservation solution, there was no germination for spores under conditions of -20 ℃ for three years, while spores germinated and produced prey predator at 4 ℃ for three years. Mycelium of A.oligospora grew on solid medium CMA and YPSSA at -20 ℃ or 4 ℃ for 2 years, and mycelium grew well after the transferring on CMA. However, predatory activity of strains of A.oligospora recovered from which were stored at -20 ℃,2 years was significantly declined in sheep feces than that of activity before preservation. The results showed that spores can be preserved in three kinds of preservation solution at 4 ℃ for long-term preservation, and mycelial can be preserved on solid medium CMA and YPSSA at -20 ℃ or 4 ℃ for a long time, but it's predator activity could be affected.
Key wordsArthrobotrys oligospora; Nematode-trapping fungi; Species preservation
Corresponding authorQIAO Jun, male,Ph.D,professor.Research area:pathogenic biology in livestock. E-mail:xjmqlqj@163.com
中图分类号S852.7
文献标志码A
文章编号1004-1389(2016)03-0347-06
通信作者:乔军,男,博士,教授,研究方向为畜禽病原生物学。E-mail:xjmqlqj@163.com
基金项目:国家自然科学基金(31260601,31460654);兵团博士基金(2010JC09);国家公益性(农业)行业专项(201303037)。
收稿日期:2015-06-05修回日期:2015-07-18
网络出版日期:2016-03-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160306.1610.010.html
第一作者:孟庆玲,女,博士,教授,研究方向为动物寄生虫学。E-mail:2448986506@qq.com
