2型糖尿病及其并发症患者中血清铁蛋白的变化及临床意义
2016-06-03延安大学附属医院延安716000
延安大学附属医院(延安 716000) 王 晶 刘 哲
2型糖尿病及其并发症患者中血清铁蛋白的变化及临床意义
延安大学附属医院(延安 716000)王晶刘哲
摘要目的:探讨2型糖尿病(T2DM)及其并发症患者中血清铁蛋白(SF)的变化及临床意义。方法:选择健康体检者40例(对照组)和T2DM患者248例(DM组),DM组分为单纯T2DM组(45例)和并发症组(203例),并发症组分为非酒精性脂肪肝(NAFL)组(49例),糖尿病周围神经病变(DNP)组(44例),糖尿病大血管病变(MCV)组(53例),糖尿病视网膜病变(DR)组(24例)和糖尿病肾病(DN)组(33例),比较各组的血糖、血脂指标、肝肾功能指标及SF水平。结果:DM组患者的血糖、血脂指标及SF与对照组比较有显著性差异(P<0.05);NAFL组患者ALT、AST及GGT水平均显著高于其余各组(P<0.05);DN组的mAlb、Cr显著高于其余各组(P<0.05);SF与TC、TG、LDL-C、FPG、Cr、HbAlc、HOMA-IR、mAlb、ALT、AST、GGT呈显著正相关性,与HDL-C及ISI呈显著负相关性(P<0.05);SF、TC、HbAlc、LDL-C、FINS及HOMA-IR是DM慢性并发症的危险因素(P<0.05),SF、Cr、mAlb是DN的危险因素(P<0.05),SF、ALT、AST及GGT是NAFL的危险因素(P<0.05)。结论:血清SF在T2DM患者中明显升高,且在合并慢性并发症患者中升高更为明显,SF升高是T2DM及其慢性并发症发生的高危独立因素。
主题词糖尿病,非胰岛素依赖型/并发症糖尿病神经病变/病因学糖尿病血管病变/病因学糖尿病神经病变/血液糖尿病血管病变/血液铁蛋白/代谢
2型糖尿病(T2DM)是临床常见慢性代谢性疾病,患者存在胰岛素分泌异常以及明显的胰岛素抵抗,常合并多种慢性并发症[1]。近年来,临床研究表明:微量元素水平异常变化在本病的发生及发展过程中具有重要作用。血清铁蛋白(SF)作为人体含铁量最高的蛋白之一,其浓度能够直接反应机体的储铁情况,对于体内缺铁或铁超载的评价具有较高的敏感性[2]。大量研究发现:铁代谢与T2DM的发生及发展具有密切关系,血清SF水平可能预测或评价T2DM及其并发症的发生及发展。本研究分析了T2DM及其慢性并发症患者的血清SF及其他相关代谢指标变化,旨在探讨SF与T2DM及其慢性并发症间的关系,现分析报告如下。
资料与方法
1研究对象2012年1月至2014年6月,我院内分泌科住院确诊为T2DM患者248例以及同期健康体检者40例。均符合纳入标准:①对照组血糖及血脂水平正常,无心脑肝肾以及周围神经等疾病;②T2DM诊断符合1999年WHO推荐诊断分型标准,均为新诊T2DM;③受试者均自愿参与本次研究,研究获得医院伦理委员会的审核和批准。也符合排除标准:①急性损伤、手术等其他应激情况者;②近1年内有献血史者;③贫血、铁剂治疗及输血者;④合并恶性肿瘤、各类急慢性感染、甲状腺功能亢进、特定性肝病(自身免疫性、病毒性、酒精性、遗传性及药物性肝病);⑤合并其他自身免疫性疾病以及内分泌疾病者;⑥大量吸烟和饮酒病史者;⑦合并糖尿病酮症酸中毒者及其他DM急性并发症者。将40例健康体检者作为对照组,248例T2DM组作为糖尿病组,其中,45例单纯T2DM患者作为单纯T2DM组,203例有慢性并发症者作为并发症组,并根据并发症类型分为相应亚组:49例非酒精性脂肪肝为NAFL组,44例糖尿病周围神经病变为DNP组,53例大血管病变者为MCV组,57例微血管病变中,24例糖尿病视网膜病变为DR组,33例糖尿病肾病为DN组。各组基线资料见表1,对照组、单纯T2DM组以及并发症各组年龄、性别、T2DM病程及BMI等比较无明显差异(P>0.05),具有可比性。
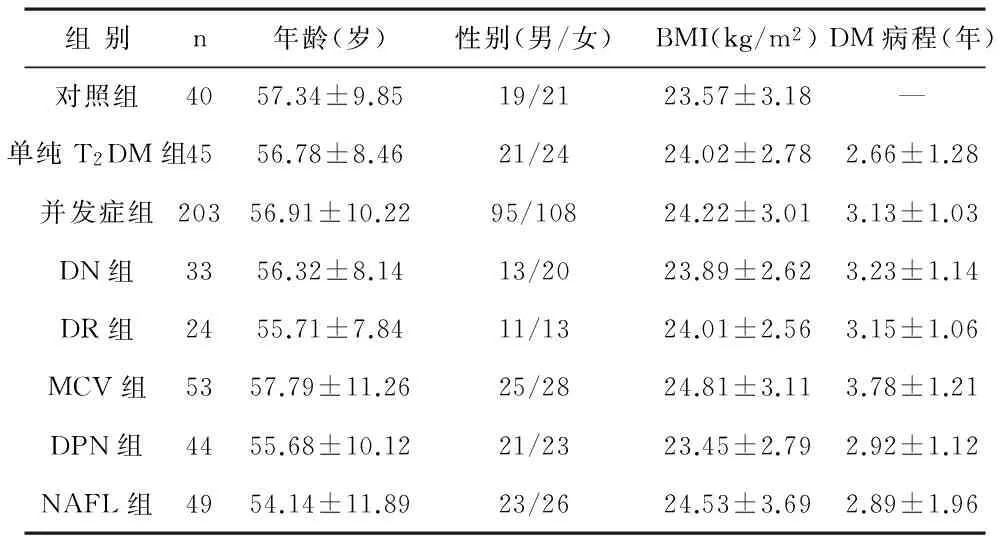
表1 各组基线资料比较
2研究方法
2.1一般性指标:统计受试者的年龄、性别,于清晨7:00~8:00测量脱鞋免冠空腹身高、体重,并计算体重指数(BMI)=体重/身高2(kg/m2),糖尿病组统计糖尿病病程。
2.2标本采集:受试者均过夜禁食12h后,晨取空腹肘静脉血5ml,于室温下静置2h,经1000r/min离心20min,留取上清液置于-20℃冰箱中保存待测。
2.3生化指标测定:①糖代谢指标:测定采用葡萄糖氧化法测定空腹血糖(FPG),采用高效液相法测定糖化血红蛋白(HbAlc),采用化学发光法测定空腹胰岛素(FINS),并计算胰岛素敏感指数(ISI)=-ln(FPG×FINS),计算胰岛素抵抗指数(HOMA-IR)=ln(FPG×FINS)/22.5。②脂代谢指标:采用日立7600生化自动分析仪测定总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)。③肝功能指标:采用生化自动分析仪测定谷氨酰转氨酶(GGT)、天门冬氨酰转氨酶(AST)以及丙氨酰转氨酶(ALT)水平。④肾功能指标:采集受试者的24h尿液,采用比色法测定尿肌酐(Cr),采用放射免疫法测定尿微量蛋白(mAlb),采用免疫比浊法测定24h尿蛋白排泄量(UAER)。⑤血清SF:采用免疫分析仪以放射免疫法测定血清SF。
结果
1各组糖代谢指标比较见表2。T2DM患者的FPG、FINS均显著高于对照组(P<0.05),且并发症组各项指标与单纯T2DM组比较有显著差异(P<0.05)。

表2 各组糖代谢指标比较±s)
注:a与对照组比较,P<0.05;b与单纯T2DM组比较,P<0.05
2 各组脂代谢指标比较见表3。T2DM组患者TC、TG、HDL-C均显著高于对照组(P<0.05),LDL-C显著低于对照组(P<0.05),且并发症组与单纯T2DM组比较差异显著(P<0.05)。
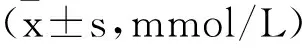
表3 各组脂代谢指标比较
注:a与对照组比较,P<0.05;b与单纯T2DM组比较,P<0.05
3各组肝功能指标比较见表3。NAFL组患者ALT、AST及GGT水平均显著升高(P<0.05),其余各组间无明显差异(P>0.05)。
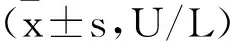
表3 各组SF及肝功能指标比较
注:c与其余各组比较,P<0.05
4各组SF及肾功能指标比较见表4。DN组患者mAlb、Cr均显著高于其余各组(P<0.05),DM患者的SF及CRP均显著高于对照组(P<0.05),且慢性合并症各组SF显著高于单纯T2DM组(P<0.05),DR组CRP显著高于其余各组(P<0.05)。
5SF与各指标之间的关系SF与年龄、BMI、DM病程、CRP无明显相关性(r=0.213、0.235、0.015、0.226,P>0.05),而与TC、TG、LDL-C、FPG、Cr、HbAlc、HOMA-IR、mAlb、ALT、AST、GGT呈显著正相关性(r=0.391、0.334、0.415、0.378、0.397、0.534、0.632、0.311、0.389、0.312、0.515,P<0.05),与HDL-C及ISI呈显著负相关性(r=-0.419、-0.662,P<0.05)。

表4 各组SF及肾功能指标比较±s)
注:a与对照组比较,P<0.05;b与单纯T2DM组比较,P<0.05;c与其余各组比较,P<0.05
6T2DM及其并发症的危险因素经Logistic回归分析显示:SF、TC、LDL-C均是T2DM的危险因素(OR=1.021、3.391、4.925、4.432,P<0.05);以慢性并发症为应变量,Logistic回归分析显示:SF、TC、LDL-C、HbAlc、FINS、HOMA-IR、CRP是T2DM慢性并发症的危险因素(OR=2.009、3.091、7.113、2.004、1.091、2.927、2.012,P<0.05);以DN为应变量,Logistic回归分析显示:SF、Cr、mAlb是DN的危险因素(OR=1.231、1.356、2.275,P<0.05);以NAFL为应变量,Logistic回归分析显示:SF、ALT、AST及GGT是NAFL的危险因素(OR=2.002、2.986、2.783,P<0.05)。
讨论
SF是由铁以及脱铁蛋白所组成,是体内的主要铁源,同时也是铁在体内的主要贮存形式,故SF反应机体储铁情况的主要指标。铁作为一种脂质过氧化反应促进剂,其缺乏或者过载与多种疾病的发生及发展密切相关。铁过载可导致Haber-Weiss反应被启动和催化,生成过多氧自由基(ROS)而损伤机体组织细胞。SF水平高低对于机体糖脂代谢具有重要影响,认为SF可能参与了DM及其慢性并发症的发生及发展过程[3]。
临床研究显示:铁过载对于胰岛素具有拮抗作用,从而导致外周组织对于葡糖糖的生物利用率降低,并可导致胰岛β细胞受损而诱发DM。同时,铁超负荷可导致肝糖原合成过程受到抑制,进而引起周围组织细胞铁负荷增加,降低外周组织对于葡萄糖的利用率,诱发或加重糖代谢障碍[3]。冯烨等[4]研究显示:在糖脂代谢紊乱早期已经存在血清SF水平显著升高,提示SF水平异常升高与脂代谢异常具有密切关系。Forouhi NG等[5]在校正年龄、性别、BMI、DM家族史、吸烟以及炎症指标后发现SF仍为DM发生的独立预测因子。本研究结果显示:T2DM患者的SF水平显著高于健康对照组,且TC、TG、LDL-C、FPG、HbAlc、FINS及HOMA-IR均显著高于对照组,HDL-C及ISI均显著低于对照组,相关性分析显示:SF与TC、TG、LDL-C、FPG、HbAlc、HOMA-IR呈显著正相关性,而与HDL-C及ISI呈现显著负相关性,与雷海燕等[6]报道相似。证实DM患者具有铁超载现象,且与其糖脂代谢异常密切相关。
糖尿病微血管病变主要指DR和DN,目前已有诸多研究表明SF与其发生密切相关。蒙绪标等[7]研究发现:DN患者的SF及24h mAlb显著高于正常对照组,且SF与mAlb呈显著正相关性。过氧化脂质及ROS生成过多是T2DM及其慢性并发症的主要发病基础,可诱导肾小球血管基底膜中分布的磷脂成分发生脂质过氧化,从而导致肾小球的基底膜增厚且通透性增加,诱发或加重DN[8]。本研究在排除了贫血、年龄、性别等因素的影响下,DN患者的SF水平较对照组及单纯T2DM组显著升高,且mAlb、Cr水平显著高于其余各组,SF与mAlb、Cr呈显著正相关性。提示SF能够反映患者的肾脏微血管损伤情况,对早期DN的预测和诊断具有重要意义。
DR所致眼部神经血管病变而引起的视功能损害是一个不可逆的过程,即便控制血糖正常,DR仍可呈进行变,最终导致患者失明[9]。宗晓春等[10]认为:在高血糖及高SF状态下发生氧化应激反应生成过多ROS,ROS可加速内皮细胞以及周围细胞的凋亡,诱发毛细血管萎缩以及阻塞,最终造成局部缺血以及视网膜损伤,从而诱发DR。本研究中,DR组的SF、CRP水平显著高于对照组与单纯T2DM组,且SF与CRP呈显著正相关性,与蒋燕等[11]报道一致。提示SF及CRP能够诱发炎症以及氧化应激反应,诱导DR的发生和发展。
血清SF水平升高在组织缺氧缺血后脂质过氧化反应过程中具有关键性作用,铁过载可作为催化剂,加速ROS的生成,损伤脂膜以及亚细胞器,引起血管内皮发生损伤性增厚,并可损伤内皮组织细胞,从而加速动脉硬化的发生及发展[12]。詹宇红等[13]研究发现:血清SF水平与患者的动脉粥样硬化程度呈现显著正相关性,铁过载是诱发动脉粥样硬化的独立危险因素。本研究结果显示:T2DM合并MCV患者的SF显著高于对照组及单纯T2DM组,且与TC、TG、LDL-C、FPG、HbAlc、HOMA-IR呈显著正相关性,与HDL-C及ISI呈显著负相关性,与胡朝晖等[14]研究结果相似。证实SF与TC、LDL-C及HOMA-IR等协同作用,在T2DM及其MCV的发生及发展过程中具有重要作用。
DNP的发生机制目前尚未完全阐明,多认为与长期高血糖水平所致代谢障碍、微循环变化、神经营养障碍以及ROS生成过多有关。魏剑芬等[15]研究发现:SF水平过高可导致神经生长因子减少,诱发神经细胞膜中含有的脂质成分发生过氧化以及变性,从而导致周围神经的传导功能受损。本研究显示:DNP组的SF水平相比于正常对照组及单纯T2DM组显著升高,且与各项因子水平具有显著相关性。提示SF在DNP的发生发展中具有重要作用,但本研究样本较少,且缺乏肌电图指标,其SF与DNP的关系尚待进一步研究。
SF的主要合成场所为肝细胞,故肝脏也是铁过载损害的靶器官。Marchecini等[16]研究显示:NAFL患者多存在肝组织以及外周组织IR,而SF在代谢综合征及IR的病理生理过程中具有重要作用,推测SF与NAFL的发生密切相关。张楚等[17]研究发现:DM伴高铁综合征者的NAFL发生率较单纯DM患者明显增加。铁超载与IR相互协同作用,可促进NAFL的发生及发展。李婷等[18]研究发现:NAFL患者的SF、ALT、FBG、FINS、TG及TC均较正常人显著增加。本研究示:NAFL组的糖脂代谢指标与对照组及单纯T2DM组具有显著差异,SF、IR均显著升高,肝功能指标(ALT、AST及GGT)均较其余各组显著升高,且SF与IR、肝功能指标呈现显著正相关性,证实了上述观点。
综上所述,T2DM及其慢性并发症患者中存在血清SF水平升高,且在合并慢性并发症者中升高更明显。血清SF水平升高是T2DM及其慢性并发症的独立危险因素,SF升高可预测和诊断T2DM及其慢性并发症的发生及发展,为临床治疗T2DM及其慢性并发症提供新途径。
参考文献
[1]李靖,刘浩,杨立宏,等.糖尿病中医证候与分子生物学理论探讨[J].陕西中医,2014,35(6):859-860.
[2] 石珏.血清铁蛋白与2型糖尿病相关性的研究进展[J].医学综述,2012,18(5):741-743.
[3] 朱正国,钟琳.血清铁蛋白在2型糖尿病患者中的变化及临床意义[J].健康研究,2014,35(3):341-342.
[4] 冯烨,李成江.糖尿病前期人群铁蛋白与糖脂代谢相关性研究[J].国际内分泌代谢杂志,2009,29(5):299-302.
[5] Forouhi NG,Harding AH,A11ison M,et al.Elevated serum ferritin 1evels predict new-onset type 2 diabetes:results from the EPIC-Norfolk prospective study[J].Diabetologia,2007,50(5):949-956.
[6] 雷海燕,顾萍,邵加庆,等.血清铁蛋白与2型糖尿病及其相关危险因素的关系[J].中国全科医学,2010,13(1):36-38.
[7] 蒙绪标,闻智鸣,郑地明,等.血清铁蛋白与糖尿病肾病相关性的探讨[J].中国实验诊断学,2009,13(12):1747-1748.
[8] 许军英,罗俊辉,杨丽华,等.铁蛋白与糖尿病肾病早期微炎症状态的关系[J].医学临床研究,2014,31(8):1482-1484,1485.
[9] 卢亚敏,李天沛,刘光霞,等.铁蛋白水平变化与2型糖尿病及其微血管病变的关系[J].中国基层医药,2014,21(13):2019-2021.
[10] 宗晓春,彭 一,张贵山,等.血清铁蛋白与2型糖尿病及糖尿病视网膜病变相关性研究[J].河北医科大学学报,2013,34(7):764-766.
[11] 蒋燕,缪珩.血清C反应蛋白、铁蛋白与糖尿病视网膜病变严重程度关系的研究[J].实用临床医药杂志,2012,16(17):150-152.
[12] 袁惠敏,张江蓉,赵烨,等.老年2型糖尿病血清铁蛋白和超敏 C 反应蛋白与颈动脉内中膜厚度的相关性分析[J].中国医师杂志,2014,19(2):10-12.
[13]詹宇红,陈宇,徐陈柯,等.2型糖尿病患者血清铁蛋白与动脉粥样硬化的相关性观察[J].心脑血管病防治,2013,13(1):46-48.
[14]胡朝晖,祝素文,刘加和,等.2型糖尿病患者大血管病变与铁蛋白水平变化的临床观察[J].心脑血管病防治,2010,10(2):120-122.
[15] 魏剑芬,田晓,陈冬,等.2型糖尿病患者血清铁蛋白的变化及其与糖尿病周围神经病变的关系[J].中国糖尿病杂志,2014,22(3):204-206.
[16] Marchesini G, Marzocchi R, Agostini F,et al. Nonalcoholic fatty liver disease and the metabolic syndrome [J]. Curr Opin Lipidol,2005,16(4):421-427.
[17]张楚,詹宇红.高铁蛋白血症与早期糖脂代谢异常的关系[J].医学研究杂志,2008,37(2):32-34.
[18] 李婷,杨丽清,李廷廷,等.2型糖尿病患者血清铁及转铁蛋白水平与非酒精性脂肪肝的关系[J].中西医结合心脑血管病杂志,2013,11(8):938-939.
(收稿:2015-05-20)
【中图分类号】R587.2
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.01.044
