丹溪痛风方对阿尔茨海默病小鼠海马的影响
2016-06-03张晓杰费洪新刘得水张英博
张晓杰 费洪新 刘得水 张英博
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
丹溪痛风方对阿尔茨海默病小鼠海马的影响
张晓杰费洪新刘得水张英博
(齐齐哈尔医学院,黑龙江齐齐哈尔161006)
〔摘要〕目的探讨丹溪痛风方(DGP)对阿尔茨海默病(AD)小鼠海马的影响。方法C57BL/6小鼠随机分成对照组,模型组,治疗组(吡拉西坦0.42 g/kg),DGP 高、中、低剂量组(DGP 52,26,13 g/kg)。采用小鼠双侧海马微量注射(10 μg)β-淀粉样蛋白1~42(Aβ1~422 g/L)和腹腔注射D-半乳糖(180 mg/kg)诱导AD小鼠。给予小鼠连续治疗35 d后处死取材。采用Morris水迷宫测试小鼠学习记忆能力,观察小鼠海马结构,采用双抗体夹心法测定海马β-淀粉样蛋白前体蛋白(APP)、Aβ1~42、白介素(IL)-1β和肿瘤坏死因子(TNF)-α水平。结果与对照组比较,模型组小鼠海马潜伏期和游泳距离明显增加(P<0.05),海马目标停留时间和跨平台次数明显减少(P<0.05),海马APP、Aβ1~42、IL-1β和TNF-α水平明显升高(P<0.05);与模型组比较,DGP高、中剂量组AD小鼠海马学习记忆能力明显改善(P<0.05),海马神经元结构明显改善,海马APP、Aβ1~42、IL-1β和TNF-α水平明显降低(P<0.05)。结论DGP改善AD小鼠海马学习记忆能力及海马形态结构,通过抑制海马APP、Aβ1~42、IL-1β和TNF-α在AD治疗中发挥重要作用。
〔关键词〕丹溪痛风方;阿尔茨海默病
阿尔茨海默病(AD)是老年人认知障碍的常见原因之一。脑中β-淀粉样蛋白(Aβ)增加,造成Aβ1~42沉积,形成老年斑(SP),并对海马神经元造成损伤。Aβ来源于β-淀粉样蛋白前体蛋白(APP),通过激活神经胶质细胞促发神经性炎症反应〔1〕。小胶质细胞(MG)活化分泌白介素(IL)-1β〔2〕,MG活化可被多奈哌齐抑制〔3〕。AD还表现为脑星形胶质细胞活化,伴有IL-1β和肿瘤坏死因子(TNF)-α增加〔4~10〕。
丹溪痛风方(DGP)是朱丹溪首先创立的古老方剂,组成包括天南星、苍术、黄柏等,通过抗炎作用治疗急性痛风性关节炎(AGA)和痛风性肾病等〔11~14〕。但DGP抗AD的研究尚属于空白。本实验拟探寻DGP对AD小鼠海马的影响及其相关机制。
1材料与方法
1.1动物清洁级雄性8周龄C57BL/6小鼠,体重(23±2)g,48只,由黑龙江中医药大学实验动物中心李宝龙副主任购买于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。小鼠饲养在常温、常湿的实验环境中,给予小鼠无菌饲料和蒸馏水。
1.2主要药物和仪器药物:吡拉西坦(东北制药集团沈阳第一制药有限公司,批号5140556),DGP(黑龙江中医药大学中医药研究院周忠光教授购买,包括天南星、苍术、黄柏、川芎、泽泻、车前子、桃仁、威灵仙、羌活、防己、桂枝、红花、土茯苓,批号分别为1306047、1310074、1401016、1312144、1401045、1406017、1310087、1310045、1401057、1312139、1312093、1401103、1407002,由田明教授制备成水煎剂,给药时用生理盐水溶解),APP、Aβ1~42、IL-1β和TNF-α酶联免疫试剂盒(南京建成生物工程研究所,批号20140401),Aβ1~42和D-半乳糖(Sigma公司),其他试剂均为国产分析纯,由黑龙江中医药大学周忠光教授提供。仪器:TCNAI-G2型透射电子显微镜(荷兰公司),ZH-DSG型Morris水迷宫(安徽淮北正华生物仪器设备有限公司),TGL-16G型台式离心机(上海安亭科学仪器厂),Leica-2135切片机(德国Leica公司),STW-1型脑立体定位仪(成都仪器厂),6100型RT-雷杜酶标仪(美国RT公司),HMIAS型高清晰度彩色医学图文分析系统(武汉千屏影像技术有限公司),PLZOZ-S型电子天平(梅特勒-托利多仪器有限公司)等。
1.3方法
1.3.1AD模型复制C57BL/6小鼠水合氯醛麻醉后,剪去头顶部毛发,固定小鼠,STW-1型脑立体定位仪定位小鼠海马区,微量加样器双侧脑室海马区连续注入10 μg的Aβ1~42(2 g/L),针头留置15 min,缓慢退针,封闭,包扎小鼠,伤口处滴加青霉素,同时C57BL/6小鼠腹腔注射D-半乳糖(180 mg/kg);对照组双侧脑室和腹腔注射等量生理盐水。
1.3.2分组和给药C57BL/6小鼠随机分为对照组,模型组,治疗组,DGP高、中、低剂量组,每组8只。DGP全方:苍术15 g、黄柏15 g、防己15 g、威灵仙15 g、天南星15 g、泽泻15 g、车前子15 g、川芎10 g、桃仁10 g、红花10 g、羌活20 g、桂枝20 g、土茯苓25 g,共200 g。依据人和小鼠的体表面积比值计算给药量。对照组和模型组给予生理盐水灌胃,治疗组给予吡拉西坦0.42 g/kg灌胃,DGP高、中、低剂量组分别给予DGP 52、26、13 g/kg灌胃,灌胃给药35 d。
1.3.3检测AD小鼠Morris水迷宫潜伏期及游泳距离、目标停留时间、跨平台次数采用ZH-DSG型Morris水迷宫检测小鼠潜伏期。该仪器水深20 cm,高于平台1 cm,水温控制在(23±2)℃,水池内放置清洁自来水及奶粉,平台放于第Ⅳ象限,第1、2、3、4天为训练时间,每次训练60 s。60 s内未找到平台,需要将小鼠放在平台上10 s。第5天为测试时间,观察小鼠到达平台位置的潜伏期,以此评价小鼠的学习能力。撤去平台,记录在60 s内小鼠找到平台的游泳距离,以此来评价小鼠的记忆能力。然后检测在60 s内小鼠在平台所在象限的游泳时间(目标停留时间)和跨越平台所在位置的次数(跨平台次数),以此评价小鼠学习记忆保持能力。
1.3.4检测AD小鼠海马CA3区电镜结构Morris水迷宫实验结束后,心脏灌注70 ml生理盐水,2.5%戊二醛灌注,取材小鼠脑海马CA3区,2.5%戊二醛固定、四氧化锇固定、脱水、包埋、切片等,TCNAI-G2型透射电子显微镜观察AD小鼠海马CA3区结构。
1.3.5检测AD小鼠海马CA3区光镜结构Morris水迷宫实验结束后,常规制备石蜡切片,二甲苯脱蜡,乙醇脱水,水洗,苏木精染10 min,冲洗,盐酸乙醇分化,水洗,氨水处理,水洗,伊红染色,水洗,乙醇脱水,透明,干燥,封片,显微镜观察海马组织CA3区结构。
1.3.6检测AD小鼠海马APP、Aβ1~42、IL-1β和TNF-α含量Morris水迷宫实验结束后小鼠断头,取小鼠脑海马,匀浆,静置,5 000 r/min离心10 min,取上清液,分装,-80℃保存。在6100型RT-雷杜酶标仪上450 nm波长处测定吸光度(A),绘制标准曲线,求得小鼠脑海马APP、Aβ1~42、IL-1β和TNF-α含量。
1.4统计学方法应用SPSS19.0软件,多组间比较采用单因素方差分析。
2结果
2.1DGP对AD小鼠Morris水迷宫潜伏期的影响经过4 d训练,各组小鼠潜伏期呈整体下降趋势。第5天与对照组比较,模型组小鼠潜伏期延长,差异有统计学意义(P<0.05);与模型组比较,治疗组、DGP高、中剂量组小鼠潜伏期明显缩短,差异有统计学意义(P<0.05)。见表1。
2.2DGP对AD小鼠Morris水迷宫游泳距离的影响经过4 d训练,各组小鼠游泳距离呈整体下降趋势。第5天与对照组比较,模型组小鼠游泳距离明显增加(P<0.05);与模型组比较,治疗组、DGP高、中剂量组小鼠游泳距离明显减少(P<0.05)。见表2。
2.3DGP对AD小鼠目标停留时间和跨平台次数的影响与对照组比较,模型组小鼠目标停留时间明显缩短和跨平台次数明显减少(P<0.05);与模型组比较,治疗组、DGP高、中剂量组小鼠目标停留时间明显延长和跨平台次数明显增加(P<0.05)。见表3。
2.4DGP对AD小鼠Morris水迷宫CA3区神经元电镜结构的影响对照组小鼠海马CA3区神经元形态规则,圆形,细胞核大而圆,核仁清晰,细胞质丰富,神经元形态正常;模型组小鼠海马CA3区神经元形态不规则,神经元较小,细胞核椭圆形,细胞核萎缩,细胞质不丰富,细胞器较少;治疗组,DGP高、中剂量组小鼠海马CA3区神经元形态规则,神经元较大,细胞核大而椭圆,核仁清晰,神经元细胞质不同程度地增加,说明神经元功能不同程度地恢复;DGP低剂量组小鼠海马CA3区神经元结构与模型组比较接近。见图1。
表1DGP对AD小鼠Morris水迷宫潜伏期的影响(x±s,n=8,s)

组别剂量(g/kg)1d2d3d4d5d对照组-57.6±1.450.2±5.940.5±4.329.2±6.822.3±3.9模型组-58.2±1.356.9±2.449.0±3.442.3±3.937.9±6.61)治疗组0.4258.1±1.151.5±5.239.0±4.231.5±6.723.5±5.62)DGP5257.7±1.152.0±5.241.6±4.329.4±6.225.2±5.22)2657.5±2.151.2±4.839.5±5.333.9±6.927.1±4.42)1358.0±1.850.7±4.947.0±3.038.5±7.135.6±5.9
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;下表同
表2DGP对AD小鼠Morris水迷宫游泳距离的影响(x±s,n=8,cm)

组别剂量(g/kg)1d2d3d4d5d对照组-1219.7±75.61091.8±141.6870.0±89.0670.2±88.8507.6±104.2模型组-1241.3±93.21203.6±130.11155.4±75.7902.8±133.7825.9±151.71)治疗组0.421270.4±77.01145.2±149.2875.0±98.4711.2±132.7603.6±106.62)DGP组521236.8±82.11152.7±143.81014.9±153.2714.2±98.4609.8±108.52)261226.9±67.51110.4±133.51027.2±156.7763.7±62.7683.4±118.32)131257.0±88.61197.5±132.61116.2±190.1800.3±74.8751.9±101.2
2.5DGP对AD小鼠海马CA3区神经元细胞质电镜结构的影响对照组小鼠海马CA3区神经元细胞质丰富,粗面内质网较多,双层核膜清晰可见;模型组小鼠海马CA3区神经元细胞质不丰富,核膜不清晰,细胞器较少;经过DGP治疗后,治疗组,DGP高、中、低剂量组小鼠海马CA3区神经元细胞质不同程度地增加,核膜较清晰。见图2。
2.6DGP对AD小鼠海马CA3区神经元光镜结构的影响对照组小鼠海马CA3区神经元分布均匀,细胞4~5层,神经元形态正常,模型组小鼠海马CA3区神经元2~3层,细胞分散排列,细胞质较少;治疗组、DGP高、中剂量组小鼠海马CA3区神经元层数较多,细胞质较多;DGP低剂量组小鼠海马CA3区神经元形态比较清晰,排列较规则。见图3。
2.7DGP对AD小鼠海马APP和Aβ1~42的影响与对照组比较,模型组小鼠海马APP和Aβ1~42明显升高(P<0.05);与模型组比较,治疗组,DGP高、中剂量组小鼠海马APP和Aβ1~42明显降低(P<0.05)。见表4。
2.8DGP对AD小鼠海马IL-1β和TNF-α的影响与对照组比较,模型组小鼠海马IL-1β和TNF-α明显升高(P<0.05);与模型组比较,治疗组DGP、高、中剂量组小鼠海马IL-1β和TNF-α明显降低(P<0.05)。见表5。

A:对照组;B:模型组;C:治疗组;D:DGP高剂量组;E:DGP中剂量组;F:DGP低剂量组;下图同图1 DGP对AD小鼠海马神经元电镜结构的影响(透射电镜,×2 550)
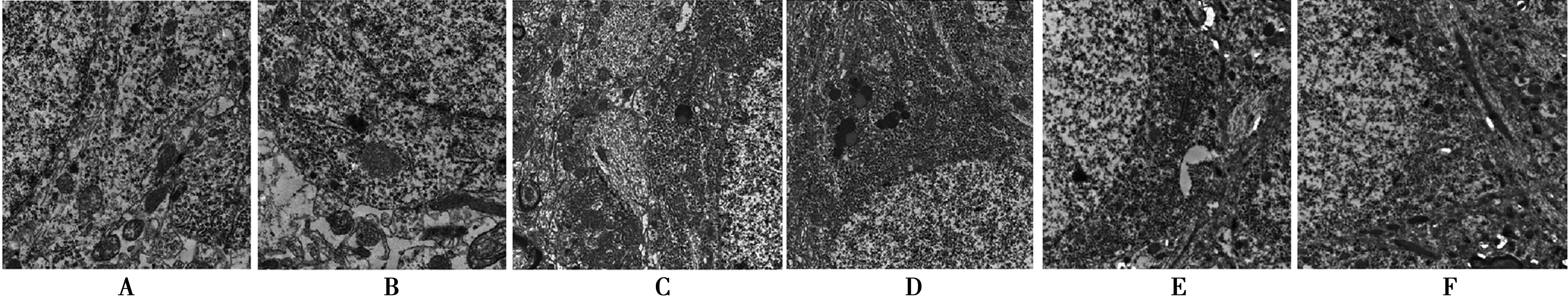
图2 DGP对AD小鼠海马神经元细胞质电镜结构的影响(透射电镜,×16 500)
表3DGP对AD小鼠Morris水迷宫目标停留时间和跨平台次数的影响(x±s,n=8)

组别剂量(g/kg)目标停留时间(s)跨平台次数(次)对照组-25.1±4.64.6±1.6模型组-13.7±3.21)2.4±0.91)治疗组0.4223.2±4.82)4.4±2.02)DGP组5221.5±5.42)4.1±1.92)2619.8±4.92)4.0±1.92)1314.9±4.02.3±1.0
表4DGP对AD小鼠海马APP和Aβ1~42的影响(x±s,n=8,ng/L)
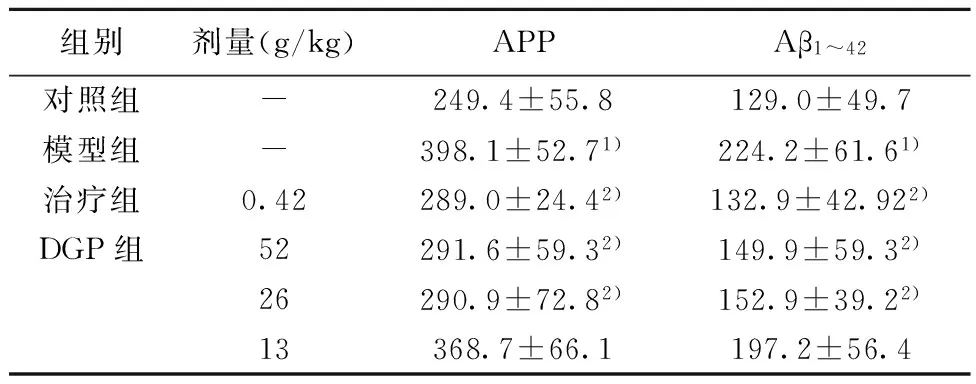
组别剂量(g/kg)APPAβ1~42对照组-249.4±55.8129.0±49.7模型组-398.1±52.71)224.2±61.61)治疗组0.42289.0±24.42)132.9±42.922)DGP组52291.6±59.32)149.9±59.32) 26290.9±72.82)152.9±39.22) 13368.7±66.1197.2±56.4
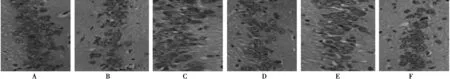
图3 DGP对AD小鼠海马神经元光镜结构的影响(HE,×400)
表5DGP对AD小鼠海马IL-1β和TNF-α的影响(x±s,n=8,pg/ml)

组别剂量(g/kg)IL-1βTNF-α对照组-240.3±88.5968.2±286.7模型组-384.2±94.81)1566.2±280.51)治疗组0.42252.2±92.72)1107.5±323.42)DGP组52257.2±66.22)1208.3±226.92)26268.6±79.12)1249.5±308.72)13316.2±113.61398.0±224.2
3讨论
AD是老年人高发的疾病之一,主要表现为学习记忆能力减退,脑淀粉样物质沉积及大量炎症介质释放。AD病理改变主要集中在海马、皮质等〔15〕,海马可分为CA1区、CA2区、CA3区和DG区,其中CA3区与学习记忆关联较大〔16〕。
Morris水迷宫检测结果显示,模型组小鼠学习记忆能力减退,模型稳定;DGP高、中剂量可改善AD小鼠学习记忆能力。透射电镜和光学显微镜观察可见,对照组小鼠海马CA3区神经元基本结构正常,神经元未出现病变;小鼠海马注射Aβ1~42造成海马结构异常,神经元损伤,模型建立成功,可进行实验研究;经过DGP治疗后,海马神经元结构得到不同程度地恢复。综合说明DGP可改善AD小鼠海马CA3区电镜结构,提示DGP对AD小鼠有一定疗效和实用价值。正常机体脑海马内存在APP和Aβ1~42,但是机体不会发病。AD脑海马存在大量APP,APP可形成Aβ1~42,Aβ1~42激活MG,活化MG分泌IL-1β,IL-1β作用方式包括自分泌和旁分泌。其中IL-1β作用于MG自身,促进MG增殖,释放更多IL-1β;另外,IL-1β可作用于星形胶质细胞IL-1β受体,促进星形胶质细胞产生TNF-α等炎症介质,形成神经性炎症反应。实验中模型组海马炎症介质及其形成老年斑的原材料增加,海马无菌性炎症反应明显;经过DGP治疗后,DGP高、中剂量组海马APP、Aβ1~42、IL-1β和TNF-α降低,说明DGP高、中剂量改善脑海马神经性炎症反应。本实验显示海马APP、Aβ1~42、IL-1β和TNF-α变化趋势与改善AD小鼠海马CA3区结构及其学习记忆能力相关联,小鼠海马APP、Aβ1~42、IL-1β和TNF-α降低伴随着小鼠海马CA3区结构及其学习记忆能力改善,提示DGP可通过降低小鼠海马APP、Aβ1~42、IL-1β和TNF-α来改善小鼠学习记忆能力和海马结构,也提示海马APP、Aβ1~42、IL-1β和TNF-α是防治AD的重要评价指标。
4参考文献
1Karki S,Nichols MR.CD47 does not mediate amyloid-β(1-42) protofibril-stimulated microglial cytokine release〔J〕.Biochem Biophys Res Commun,2014;454(1):239-44.
2Lv C,Wang L,Liu X,etal.Geniposide attenuates oligomeric Aβ(1-42)-induced inflammatory response by targeting RAGE-dependent signaling in BV2 cells〔J〕.Curr Alzheimer Res,2014;11(5):430-40.
3Kim HG,Moon M,Choi JG,etal.Donepezil inhibits the amyloid-beta oligomer-induced microglial activation in vitro and in vivo〔J〕.Neurotoxicology,2014;40(1):23-32.
4Wang HM,Zhang T,Huang JK,etal.3-N-butylphthalide(NBP) attenuates the amyloid β induced inflammatory responses in cultured astrocytes via the nuclear factor-κB signaling pathway〔J〕.Cell Physiol Biochem,2013;32(1):235-42.
5Xuan AG,Pan XB,Wei P,etal.Valproic acid alleviates memory deficits and attenuates amyloid-β deposition in transgenic mouse model of Alzheimer's disease〔J〕.Mol Neurobiol,2015;51(1):300-12.
6费洪新,高音,孙丽慧,等.黄芪多糖对阿尔茨海默病小鼠海马组织的影响〔J〕.中国老年学杂志,2015;35(16):4426-9.
7费洪新,高音,孙丽慧,等.蝙蝠葛酚性碱对阿尔茨海默病模型小鼠学习记忆和海马的影响〔J〕.中国实验方剂学杂志,2015;21(7):91-4.
8Konrath EL,Passos Cdos S,Klein LC Jr,etal.Alkaloids as a source of potential anticholinesterase inhibitors for the treatment of Alzheimer's disease〔J〕.J Pharm Pharmacol,2013;65(12):1701-25.
9Kawada H,Blessing K,Kiyota T,etal.Effects of multifunctional antioxidants on mitochondrial dysfunction and amyloid-β metal dyshomeostasis〔J〕.J Alzheimers Dis,2015;44(1):297-307.
10Wang F,Liu H,Shen X,etal.Combined treatment of amyloid-β1-42-stimulated bone marrow-derived dendritic cells plus splenocytes from young mice prevents the development of Alzheimer's disease in APPswe/PSENldE9 mice〔J〕.Neurobiol Aging,2015;36(1):111-22.
11周忠光,丑小月,费洪新,等.丹溪痛风方对小鼠急性痛风性关节炎的实验研究〔J〕.中医药学报,2015;43(1):59-62.
12李宝龙,韩玉生,刘旭,等.丹溪痛风加减方对MSU致家兔急性痛风性关节炎的防治作用〔J〕.中医药学报,2011;39(3):45-7.
13朴成玉,房城,安柏松,等.丹溪痛风胶囊对大鼠急性痛风性关节炎IL-12及COX-2表达的影响〔J〕.中医药信息,2012;29(4):91-2.
14段淑香,韩玉生,李宝龙,等.丹溪痛风方对小鼠高尿酸血症的影响〔J〕.齐齐哈尔医学院学报,2011;32(12):1889-90.
15Rossi L,Mazzitelli S,Arciello M,etal.Benefits from dietary polyphenols for brain aging and Alzheimer's disease〔J〕.Neurochem Res,2008;33(12):2390-400.
16Folstein M,Folstein S.Functional expressions of the aging brain〔J〕.Nutr Rev,2010;68(2):S70-3.
〔2015-12-25修回〕
(编辑袁左鸣)
Effect of Danxi Gout Party on hippocampal in Alzheimer's disease mice
ZHANG Xiao-Jie,FEI Hong-Xin,LIU De-Shui,et al.
Qiqihar Medical College,Qiqihaer 161006,Heilongjiang,China
【Abstract】ObjectiveTo explore the effect of Danxi Gout Party(DGP) on hippocampal in Alzheimer's disease(AD) mice.MethodsC57BL/6 mice were randomly divided into control,model,treatment(Piracetam 0.42 g/kg),DGP high-dose(DGP 52 g/kg),DGP medial-dose(DGP 26 g/kg),DGP low-dose groups(DGP 13 g/kg).By using microinjection of 10 μg incubated amyloid beta1~42(Aβ1~422 g/L) into the dorsal blade of the dentate gyrus in the bilateral hippocampus with intraperitoneal injection of D-galactose(180 mg/kg) in combination of mice to induce an AD mice.The mice were killed after 35 days continuous treating.After the treatment all animals were sacrificed.The Morris water maze was used to observe the learning and memory ability for the mice.Electron microscopy of hippocampus was observed.Biochemical methods were used to determine the content of β-amyloid protein precursor (APP),Aβ1~42,interleukin(IL)-1β and tumor necrosis factor(TNF)-α in the hippocampus tissue.ResultsCompared with the control group,latencies and swimming distances were significantly increased(P<0.05);target quadrant time and the number of cross-platform were significantly decreased(P<0.05);APP,Aβ1~42,IL-1β and TNF-α were significantly increased in model group(P<0.05).Compared with the model group,high-and medial-dose of DGP could significantly improve the learning,memory ability and morphological structure of hippocampus tissue of AD mice(P<0.05),APP,Aβ1~42,IL-1β and TNF-α in the hippocampus tissue were significantly decreased in high-and medial-dose of DGP groups(P<0.05).ConclusionsDGP could improve the ability of learning,memory and morphological structure of the hippocampus tissue of AD mice.DGP plays a certain role in the treatment of AD through inhibiting APP,Aβ1~42,IL-1β and TNF-α.
【Key words】Danxi Gout Party;Alzheimer's disease
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)08-1798-04;
doi:10.3969/j.issn.1005-9202.2016.08.004
基金项目:国家自然科学基金资助项目(81173576,81373777,81173599);黑龙江省自然科学基金资助项目(p01354);黑龙江省教育厅资助项目(12521624,12531788,12531790)
第一作者:张晓杰(1965-),女,博士,教授,博士生导师,主要从事痴呆、肿瘤、抑郁、痛风研究。
