SB431542对高糖环境中小鼠足细胞Cdk5/p35表达的影响
2016-06-03李宏博
李宏博 张 悦 郝 军 赵 松 刘 巍
(河北医科大学病理学教研室,河北 石家庄 050017)
SB431542对高糖环境中小鼠足细胞Cdk5/p35表达的影响
李宏博张悦1郝军赵松刘巍
(河北医科大学病理学教研室,河北石家庄050017)
〔摘要〕目的应用SB431542及Roscovitine处理高糖培养的足细胞,观察抑制转化生长因子(TGF)-β1通路对高糖培养足细胞中Cdk5/p35表达的影响及抑制Cdk5激酶活性对高糖和TGF-β1诱导足细胞凋亡的影响。方法采用不同浓度SB431542(0.1,1.0,10 μmol/L)处理高糖培养的足细胞,Western印迹法及RT-PCR技术检测各处理组Cdk5及p35蛋白和mRNA的表达变化情况。应用流式细胞术检测Roscovitine对高糖及TGF-β1刺激足细胞凋亡的影响。结果高糖(HG组)Cdk5和p35的蛋白及mRNA表达水平明显增高,显著高于正常血糖组(NG)组和甘露醇组(M组)(P<0.05),并且呈时间依赖性升高。加入SB431542后,高糖培养导致的足细胞内Smad-2蛋白磷酸化水平明显降低。同时,HG+SB431542组足细胞内Cdk5和p35的蛋白及mRNA表达水平呈浓度依赖性显著降低,明显低于HG组(P<0.05)。加入Roscovitine后,高糖及TGF-β1诱导足细胞的足细胞凋亡水平显著下降(P<0.05)。结论高糖可能通过活化TGF-β1通路上调Cdk5/p35表达从而诱导足细胞凋亡。
〔关键词〕糖尿病肾病;足细胞;高糖;转化生长因子-β1;Cdk5;p35
足细胞的损伤在糖尿病肾病(DN)的进展中发挥了重要作用〔1〕。细胞周期素依赖性蛋白激酶5(Cdk5)是细胞周期素依赖性蛋白激酶家族成员之一,属于脯氨酸限定性丝氨酸/苏氨酸蛋白激酶,通过与其特异性的调节蛋白p35或p39结合而被激活。肾组织中,Cdk5主要表达于终末分化的足细胞中,对调控足细胞的增殖、分化和形态结构具有重要作用。最新研究显示,Cdk5/p35的表达水平在高糖刺激的足细胞中显著升高,并同足细胞凋亡密切相关〔2〕。但是,高糖通过何种途径引起足细胞中Cdk5/p35表达升高并不十分清楚。转化生长因子(TGF)-β1刺激可导致神经元中Cdk5/p35蛋白的表达及活性增高,从而影响疼痛信号的传导〔3,4〕。高糖是否可通过TGF-β1通路增加足细胞中Cdk5/p35的表达从而诱导足细胞凋亡,尚未见报道。因此,本研究拟通过培养条件性永生化足细胞,应用转化生长因子受体1抑制剂SB431542处理高糖培养的足细胞,观察抑制TGF-β1通路对高糖培养足细胞中Cdk5/p35表达的影响;应用Cdk5激酶活性抑制剂Rocovitine处理高糖及TGF-β1培养的足细胞,观察抑制Cdk5激酶活性对足细胞凋亡的影响。
1材料与方法
1.1材料条件性永生化小鼠足细胞购自中国医学科学院基础医学研究所细胞中心。Cdk5抗体购自美国Epitomics公司,p35抗体购自美国Santa Cruz公司,β-actin、p-Smad-2购自美国SAB公司。SB431542和Ⅰ型胶原蛋白购自美国Sigma公司。DMEM培养基购自美国Gibco公司。重组人TGF-β1细胞因子、重组小鼠γ-干扰素(γ-IFN)购自美国PeproTech公司。SYBR®Premix Ex TaqTMReal-time PCR试剂盒购自大连宝生物公司。Annexin V/PI细胞凋亡检测试剂盒购自美国BD公司。
1.2方法
1.2.1细胞培养条件性永生化小鼠足细胞培养方法参照文献报道〔5〕。培养时,培养瓶及培养板底部均预先铺被0.1 mg/ml的Ⅰ型胶原蛋白。未分化足细胞用含有10% 胎牛血清(FBS)、20 U/ml γ-IFN、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基在33℃,5%CO2培养箱中培养,促进细胞增殖传代(许可条件)。许可条件下培养的足细胞按1∶10传代后,在37℃,用不添加γ-IFN的DMEM培养基(含10% FBS、100 U/ml青霉素和100 μg/ml链霉素)培养10~15 d(非许可条件),诱导足细胞分化成熟。
1.2.2实验分组足细胞在无血清培养基培养24 h后,按如下分组:①正常糖组(5.5 mmol/L,NG组);甘露醇组(24.5 mmol/L,M组);高糖组(30 mmol/L,HG组)。高糖组按不同刺激时间分为0、3、6、12 h。②正常糖组(NG组);高糖组(HG组);高糖+SB431542组(0.1、1.0、10 μmol/L,HG+SB431542组)。③对足细胞凋亡检测的分组如下:正常糖组(NG组);高糖组(HG组);高糖+Roscovitine组(50 μmol/L,HG+Ros组);TGF-β1组(10 ng/ml);TGF-β1+Roscovitine组(TGF-β1+Ros组)。
1.2.3Western印迹法收集各组细胞提取总蛋白,每组样品取50 μg总蛋白,加6×上样缓冲液,100℃变性5 min,经10% SDS-PAGE凝胶电泳后,电转移至PVDF膜。5%脱脂奶粉37℃封闭2 h,加入Cdk5(1∶100)、p35(1∶1 000)、phospho-Smad-2(1∶1 000)和β-actin(1∶2 000)抗体,4℃孵育过夜。洗膜后,加辣根过氧化物酶标记的羊抗兔/鼠IgG(1∶5 000),37℃孵育2 h。洗膜后,滴加ECL试剂,于Odyssey FC图像采集成像系统中显影,并对条带进行定量分析。以目的条带和β-actin条带积分光密度值比值作为最终结果。
1.2.4RT-PCR收集各组细胞,预冷生理盐水漂洗3次后,采用Trizol法提取细胞总RNA。鉴定完RNA纯度和完整性后,分别取1 μg总RNA用AMV逆转录试剂盒逆转录成cDNA备用。各取2 μl逆转录cDNA产物作为PCR反应模板,在MX3005P Real-time PCR仪检测Cdk5和p35的mRNA表达。Cdk5引物:上游5′-TAG GCT CTC TGA ACC CCA GT-3′,下游5′-ATC CCC ACC CGA CTC TTC-3′;p35引物:上游5′-GCC CTT CCT GGT AGA GAG CTG-3′,下游5′-GTG TGA AAT AGT GTG GGT CGG C-3′。18S引物:上游5′-ACA CGG ACA GGA TTG ACA GA-3′,下游5′-GGA CAT CTA AGG GCA TCA CAG-3′。反应扩增条件为:预变性 95℃ 30 s,95℃ 15 s,55℃ 5 s,72℃ 40 s扩增40个循环。以18S作为内参照校正,用2△△Ct法分析基因的相对表达。
1.2.5流式细胞术检测足细胞凋亡各组实验细胞刺激结束后,加入胰酶-EDTA消化细胞,室温1 000 r/min,离心4 min,弃上清,加生理盐水洗涤。向沉淀的细胞中加入已稀释好的上样缓冲液,500 μl/管(按1∶4用MilliQ水/灭菌蒸馏水稀释),反复吹打均匀;分别加入5 μl FITC标记的Annexin V和5 μl PI,混匀后避光室温孵育10 min,立即上流式细胞仪检测结果。
1.3统计学方法采用SPSS13.0软件行方差分析。
2结果
2.1高糖对足细胞中Cdk5/p35表达的影响Western印迹法检测结果显示,HG组足细胞内Cdk5和p35的蛋白表达水平在高糖培养后有显著增高,明显高于NG组和M组(P<0.05,图1),并且随高糖培养时间的延长逐渐增高(图1)。RT-PCR检测结果显示,Cdk5和p35的mRNA表达水平在HG组呈时间依赖性显著升高(表1)。

图1 Western印迹法检测各组足细胞中Cdk5/p35蛋白的表达
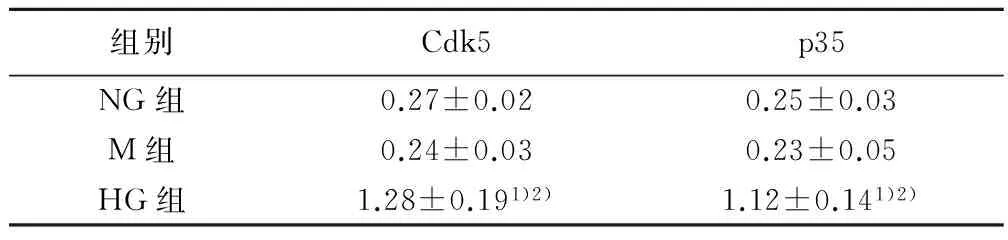
组别Cdk5p35NG组0.27±0.020.25±0.03M组0.24±0.030.23±0.05HG组1.28±0.191)2)1.12±0.141)2)
与NG 组比较:1)P<0.05;与M组比较:2)P<0.05
2.2SB431542对高糖刺激足细胞中Cdk5/p35表达的影响Western印迹检测结果显示,应用SB431542后,HG+SB431542组足细胞中phospho-Smad-2蛋白表达水平显著降低(图2),提示高糖刺激引起的TGF-β1通路活化被抑制。应用SB431542后,HG+SB431542组足细胞中Cdk5和p35的蛋白表达水平有明显降低,显著低于NG组和HG组(P<0.05),并与SB431542的浓度密切相关,呈浓度依赖性降低,10μmol/L SB431542的抑制效果最显著(图2)。定量PCR的检测结果显示,HG+SB431542组足细胞内Cdk5和p35的mRNA表达水平同SB431542的浓度密切相关,呈浓度依赖性降低,显著低于NG组和HG组(P<0.05,表2)。
2.3抑制Cdk5激酶活性对高糖及TGF-β1刺激足细胞凋亡的影响高糖和TGF-β1培养足细胞后,细胞凋亡率显著升高〔(20.01±1.72)%和(22.03±1.59)%〕,明显高于NG组〔(5.53±0.81)%,P<0.05〕,而应用Roscovitine后,HG+ROS组和TGF-β1+ROS组足细胞的凋亡率出现降低〔(14.65±1.57)%和(17.24±1.05)%〕,显著低于高糖和TGF-β1培养的细胞(P<0.05)。见表3~表5。
表2SB431542对高糖刺激足细胞中Cdk5/p35蛋白表达的影响(n=3,OD值,x±s)

组别Cdk5p35NG组0.24±0.050.23±0.13HG3h组0.61±0.241)0.56±0.061)HG6h组0.88±0.221)0.77±0.181)HG12h组1.14±0.161)1.09±0.111)
与NG 组比较:1)P<0.05,表3同

图2 Western印迹检测不同浓度SB431542处理高糖培养足细胞后Cdk5/p35蛋白的表达

组别Cdk5p35NG组1.00±0.231.00±0.11HG3h组2.12±0.251)4.56±0.541)HG6h组5.79±0.581)7.33±1.061)HG12h组9.66±0.931)12.7±1.371)
表4Cdk5/p35、p-Smad-2蛋白在各组足细胞中的
表达(n=3,OD值,x±s)
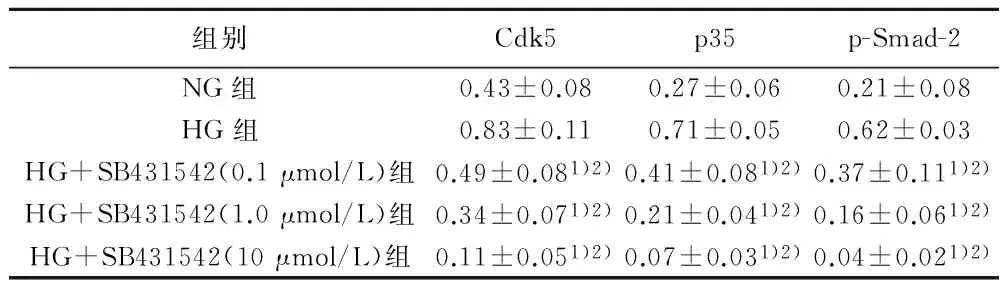
组别Cdk5p35p-Smad-2NG组0.43±0.080.27±0.060.21±0.08HG组0.83±0.110.71±0.050.62±0.03HG+SB431542(0.1μmol/L)组0.49±0.081)2)0.41±0.081)2)0.37±0.111)2)HG+SB431542(1.0μmol/L)组0.34±0.071)2)0.21±0.041)2)0.16±0.061)2)HG+SB431542(10μmol/L)组0.11±0.051)2)0.07±0.031)2)0.04±0.021)2)
与NG 组比较:1)P<0.05;与HG组比较:2)P<0.05,下表同
表5Cdk5/p35 mRNA在各组足细胞中的表达(n=3,x±s)

组别Cdk5p35NG组1.00±0.231.00±0.11HG组2.57±0.584.73±0.35HG+SB431542(0.1μmol/L)组0.93±0.181)2)0.58±0.281)2)HG+SB431542(1.0μmol/L)组0.79±0.251)2)0.68±0.141)2)HG+SB431542(10μmol/L)组0.67±0.231)2)0.41±0.111)2)
3讨论
足细胞是附着于肾小球基底膜外侧的高度分化的上皮细胞,同毛细血管内皮细胞、基底膜共同构成肾小球滤过屏障,对维持肾小球的正常结构和功能具有重要作用。足细胞的各种病理改变肥大、缺失、凋亡,均可导致肾小球滤过屏障的结构破坏和选择性通透功能的进行性损伤,从而产生大量蛋白尿,并最终引起肾小球硬化和肾衰竭〔6,7〕。
Cdk5是脯氨酸限定性丝/苏氨酸蛋白激酶,属于细胞周期素依赖性蛋白激酶家族中的特殊成员。Cdk5主要表达于神经系统的神经元和胶质细胞中,可以通过与Cdk5调节蛋白Cdk5R1(p35)、截短型Cdk5R1(p25)或Cdk5R2(p39)结合而被激活〔8〕。最新文献证实,Cdk5在多种非神经元细胞中发挥了重要生理功能作用,例如:胰腺β细胞、单核细胞、中性白细胞、白血病细胞、肌细胞、上皮细胞、内皮细胞、脂肪细胞等〔9〕。在胰腺β细胞中,提高细胞外的葡萄糖浓度会诱导p35表达,增强Cdk5的活性,从而影响胰岛素基因的转录〔10〕。尽管这种调节的生理重要性还不是很清楚,但是高糖诱导的Cdk5/p35的调节异常可能是2型糖尿病病情进展过程中导致β细胞功能障碍和凋亡的病理生理机制。
在肾脏中,Cdk5主要表达与足细胞中,对维持足细胞的分化、增殖和结构形态具有重要作用。研究显示,Cdk5/p35的异常表达与DN中肾功能损伤、足细胞凋亡密切相关〔2,11〕。本结果提示高浓度的葡萄糖是引起足细胞中Cdk5/p35表达增高的主要原因,而高渗透对此则没有影响。
在非神经细胞中,Cdk5调节多种复杂生物进程的功能多样性提示Cdk5的活性调控具有严格的调节机制。然而,有关Cdk5活性调控机制的知识仍然有限。公认的对Cdk5活性具有显著调节作用的是Cdk5调节蛋白p35和p39。这两种调节蛋白可被多种细胞因子、生长因子,神经营养因子等通过转录水平上调表达,并通过与Cdk5的特异性结合调控其激酶活性〔8,9〕。但在糖尿病肾组织损伤中,高糖引起Cdk5/p35表达增高的调控机制尚不清楚。
TGF-β是一种多功能的细胞因子,可以自分泌和(或)旁分泌的方式通过与细胞膜表面的受体相结合,激活相应的信号传导通路,如Smads通路,发挥对细胞增殖、分化和凋亡的调节作用〔12,13〕。TGF-β1介导的足细胞损伤在DN蛋白尿的产生、肾小球硬化等病理过程中发挥了重要作用〔14〕。研究显示,以TGF-β1刺激原代培养的神经元,可显著增加神经元中Cdk5/p35的表达及Cdk5的蛋白激酶活性〔4〕。但在高糖刺激的足细胞中,Cdk5/p35表达增高是否同TGF-β信号通路相关,尚未有文献报道。本文结果提示SB431542能有效抑制高糖刺激引起的TGF-β1信号通路活化。同时,高糖刺激引起的Cdk5/p35的表达上调被显著抑制,其蛋白和mRNA表达水平均显著低于HG组,显示出明显的浓度依赖性,以10 μmol/L SB431542处理的抑制效果最明显。Roscovitine是Cdk5的激酶活性抑制剂,应用其处理高糖及TGF-β1培养的足细胞后,高糖及TGF-β1诱导的足细胞凋亡有显著的降低,提示高糖刺激可通过TGF-β1信号通路的活化上调足细胞内Cdk5/p35的表达水平,从而诱导足细胞凋亡,这可能是糖尿病(DM)足细胞损伤的原因之一。
本研究结果提示TGF-β1可能是高糖刺激上调表达Cdk5/p35从而引起足细胞凋亡的原因。深入的机制研究阐明Cdk5/p35在(DM)及其并发症,特别是DN中的作用,有助于开发出针对性的新的治疗方式,以减少DM并发症的发生,改善DM病人的生活质量。
4参考文献
1Diez-Sampedro A,Lenz O,Fornoni A.Podocytopathy in diabetes:a metabolic and endocrine disorder〔J〕.Am J Kidney Dis,2011;58(4):637-46.
2Liu W,Zhang Y,Hao J,etal.Nestin protects mouse podocytes against high glucose-induced apoptosis by a Cdk5-dependent mechanism〔J〕.J Cell Biochem,2012;113(10):3186-96.
3Utreras E,Prochazkova M,Terse A,etal.TGF-β1 sensitizes TRPV1 through Cdk5 signaling in odontoblast-like cells〔J〕.Mol Pain,2013;9:24.
4Utreras E,Keller J,Terse A,etal.Transforming growth factor-β1 regulates Cdk5 activity in primary sensory neurons〔J〕.J Biol Chem,2012;287(20):16917-29.
5Mundel P,Reiser J,Zúiga Mejía Borja A,etal.Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines〔J〕.Exp Cell Res,1997;236(1):248-58.
6Diez-Sampedro A,Lenz O,Fornoni A.Podocytopathy in diabetes:a metabolic and endocrine disorder〔J〕.Am J Kidney Dis,2011;58(4):637-46.
7Najafian B,Alpers CE,Fogo AB.Pathology of human diabetic nephropathy〔J〕.Contrib Nephrol,2011;170:36-47.
8Cheung ZH,Ip NY.Cdk5:a multifaceted kinase in neurodegenerative diseases〔J〕.Trends Cell Biol,2012;22(3):169-75.
9Contreras-Vallejos E,Utreras E,Gonzalez-Billault C.Going out of the brain:non-nervous system physiological and pathological functions of Cdk5〔J〕.Cell Signal,2012;24:44-52.
10Ubeda M,Kemp DM,Habener JF.Glucose-induced expression of the cyclindependent protein kinase 5 activator p35 involved in Alzheimer’s disease regulates insulin gene transcription in pancreatic beta-cells〔J〕.Endocrinology,2004;145:3023-31.
11张悦,周毅,张怡,等.Cdk5抑制剂Roscovitine对糖尿病大鼠肾功能及nestin表达的影响〔J〕.中国药理学通报,2013;29(8):1177-8.
12Tossidou I,Schiffer M.TGF-β/BMP pathways and the podocyte〔J〕.Semin Nephrol,2012;32(4):368-76.
13Lee HS.Mechanisms and consequences of TGF-β over expression by podocytes in progressive podocyte disease〔J〕.Cell Tissue Res,2012;347(1):129-40.
14Herman-Edelstein M,Weinstein T,Gafter U.TGFβ1-dependent podocyte dysfunction〔J〕.Curr Opin Nephrol Hypertens,2013;22(1):93-9.
〔2014-09-17修回〕
(编辑赵慧玲/曹梦园)
〔中图分类号〕R322.61
〔文献标识码〕A
〔文章编号〕1005-9202(2016)08-1795-04;
doi:10.3969/j.issn.1005-9202.2016.08.003
通讯作者:刘巍(1979-),男,博士,副教授,硕士生导师,主要从事糖尿病肾病发病机制研究。
基金项目:河北省自然科学基金资助项目(No.p013206139);河北省高等学校科学技术研究项目(No.Q2013002);河北省医学科学研究重点课题计划(No.20130140,No.20130461)
1河北医科大学诊断学教研室
第一作者:李宏博(1976-),男,硕士,实验师,主要从事糖尿病肾病发病机制研究。
