钙磷涂层镁合金CaP-AZ31B对小鼠前成骨细胞生物学性能的影响
2016-06-02张涛夏虹尹庆水李梅张余杨小明蓝国波
张涛,夏虹,尹庆水,李梅,张余,杨小明,蓝国波
钙磷涂层镁合金CaP-AZ31B对小鼠前成骨细胞生物学性能的影响
张涛,夏虹,尹庆水,李梅,张余,杨小明,蓝国波
【摘要】目的研究钙磷涂层镁合金CaP-AZ31B对小鼠前成骨细胞MC3T3-E1生物学性能的影响。方法实验分为镁合金(AZ31B)组、钛合金组和CaP-AZ31B组,观察MC3T3-E1细胞在3组材料表面2、6、24 h的细胞黏附率;倒置显微镜观察MC3T3-E1细胞与3组材料浸提液共培养1、3、5、7 d的细胞形态,同时采用CCK法和BCA法检测其细胞增殖活力和细胞内总蛋白。结果随着培养时间的延长,3组材料的细胞黏附率、细胞增殖活力、细胞内总蛋白量均显著增加(P<0.05)。其中CaP-AZ31B组2、6、24 h细胞黏附率>钛合金组>AZ31B组(P<0.05);MC3T3-E1细胞在3组材料浸提液中贴壁均良好,大多呈长梭形;CaP-AZ31B组各时相点细胞增殖活力均优于AZ31B组(P<0.05);细胞内总蛋白量比较,CaP-AZ31B组>钛合金组>AZ31B组(P<0.05)。结论与镁合金、钛合金相比,钙磷涂层镁合金材料可明显增强小鼠成骨细胞的黏附能力和增殖能力,促进细胞内总蛋白的表达,具有良好的生物相容性。
【关键词】镁;合金;磷酸钙类;涂层;生物相容性材料;小鼠;成骨细胞;细胞,培养的;黏附;增殖
作者单位:510010广州军区广州总医院骨科医院全军创伤骨科研究所全军热区创伤救治与组织修复重点实验室(张涛,夏虹,尹庆水,李梅,张余,杨小明,蓝国波);510010广州华博生物制药研究所(张涛)
钛合金是目前骨科常用的植入材料,但难以在人体内降解,需行二次内固定取出术,不但增加患者的痛苦,而且加重其经济负担。可降解镁合金能够弥补钛合金材料的上述缺陷,但降解速度较快,难以满足临床需要。运用表面改性技术对镁合金进行钙磷涂层可有效延缓镁合金的降解速度,但目前尚不明确钙磷涂层镁合金对成骨细胞黏附、增殖等生物学性能的影响。本研究通过观察小鼠前成骨细胞(MC3T3-E1细胞)在钙磷涂层镁合金表面的黏附性能,以及该合金浸提液对MC3T3-E1细胞增殖活性及细胞内总蛋白量的影响,旨在进一步了解其生物相容性。
1 材料与方法
1.1主要仪器、材料和试剂
24孔、96孔培养板(Corning公司,美国);倒置相差显微镜(Olympus公司,日本);TY-80s摇床(江苏省金坛市医疗仪器厂);酶联免疫检测仪(郑州博赛生物技术股份有限公司)。
镁铝合金(AZ31B)圆盘、钙磷涂层镁铝合金(CaP-AZ31B)圆盘、钛合金圆盘由中国科学院金属所提供,直径10 mm、厚3 mm。
α-MEM细胞培养液、优等胎牛血清、胰蛋白酶(Hyclone公司,美国);CCK-8试剂盒(同仁化学研究所,日本);二甲基亚砜(DMSO,Sigma-A ldrich公司,美国);BCA蛋白试剂盒(Pierce公司,美国);Triton-X100(Sigma-Aldrich公司,美国)。
1.2浸提液制备
按材料表面积/浸提介质为2.5 cm2/m L的比例[1],分别向装有CaP-AZ31B、AZ31B和钛合金材料的容器中加入含10%胎牛血清的α-MEM细胞培养液,置于37℃、5%CO2培养箱中培养24 h,分别制备出CaP-AZ31B、AZ31B和钛合金浸提液,4℃冷藏备用,24 h内使用。
1.3细胞培养及分组
采用小鼠MC3T3-E1细胞作为实验细胞,由中国科学院典型培养物保藏委员会细胞库提供。加入含10%胎牛血清的α-MEM培养液,于37℃、5%CO2及饱和湿度条件下培养,2~3 d换液1次,待细胞长至80%融合时进行传代。实验分为CaP-AZ31B组、AZ31B组和钛合金组。
1.4早期细胞黏附率测定
将CaP-AZ31B、AZ31B和钛合金试件分别置于3个24孔培养板内,每种试件18个。将MC3T3-E1细胞以1×105/孔分别接种于上述培养板中,于37℃、5%CO2培养箱中分别培养2、6、24 h,每时相点取出1个培养板,每组取出6个试件。PBS漂洗3次,吸净液体,0.25%胰蛋白酶1.0 mL消化1 min,用1.0 mL含血清培养基终止消化,1 000 r/min离心5 min,吹打制成细胞悬液,进行细胞计数,重复6次,取平均值,计算细胞黏附率。细胞黏附率=已贴壁细胞数/植入细胞总数×100%。
1.5细胞形态、增殖活力及总蛋白测定
将1×104/mL细胞悬液接种于96孔板,培养24 h后更换为3种条件浸提液,2 d换液1次,分别培养1、3、5、7 d。
1.5.1细胞形态观察使用倒置相差显微镜进行观察。
1.5.2细胞增殖活力测定弃浸提液,PBS清洗后加入CCK-8试剂20 μL后继续培养2 h,酶联免疫检测仪测定450 nm处光密度(optical density,OD)值。
1.5.3细胞内总蛋白量测定PBS冲洗3遍,加入0.2%Triton-X100 200 μL裂解细胞,4℃冰箱过夜,分别吸取25 μL各组裂解液加入新的96孔板中,然后加入200 μL BCA蛋白试剂盒显色剂,振动30 s。将细胞培养板置于37℃下孵育30 min,取出培养板,冷却至室温,酶标仪测定562 nm处OD值。根据蛋白浓度与OD值之间的函数关系计算各种样品的吸附蛋白量,每组重复6次。
1.6统计学方法
应用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(x-±s)表示,多组比较采用多因素方差分析,组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1早期细胞黏附率
如表1所示,随着时间的延长,3组材料细胞黏附率均显著增加,不同时相点之间比较,差异均有统计学意义(P<0.05)。CaP-AZ31B组2、6、24 h细胞黏附率>钛合金组>AZ31B组,组间比较,差异有统计学意义(P<0.05)。
2.2细胞形态
如图1所示。3组材料浸提液培养的细胞均贴壁良好,大多呈长梭形,未见明显的细胞密度差异。其中CaP-AZ31B组MC3T3-E1细胞增殖良好,未见明显细胞死亡,局部可见部分脱落的钙磷涂层颗粒。
2.3细胞增殖活力
如表2所示,随着培养时间的延长,3组细胞增殖活力均逐渐增加(P<0.05)。其中CaP-AZ31B组培养1、3、5、7 d时细胞增殖活力均优于AZ31B组(P<0.05);3、5 d时低于钛合金组(P<0.05),1、7 d时与钛合金组比较,差异无统计学意义(P>0.05)。
2.4细胞内总蛋白量
如表3所示,随着培养时间的延长,3组细胞内总蛋白量均逐渐增加(P<0.05),且在每个时相点均表现为CaP-AZ31B组>钛合金组>AZ31B组(P<0.05)。
表1 不同时相点3组材料细胞黏附率比较结果(±s,n = 6,%)
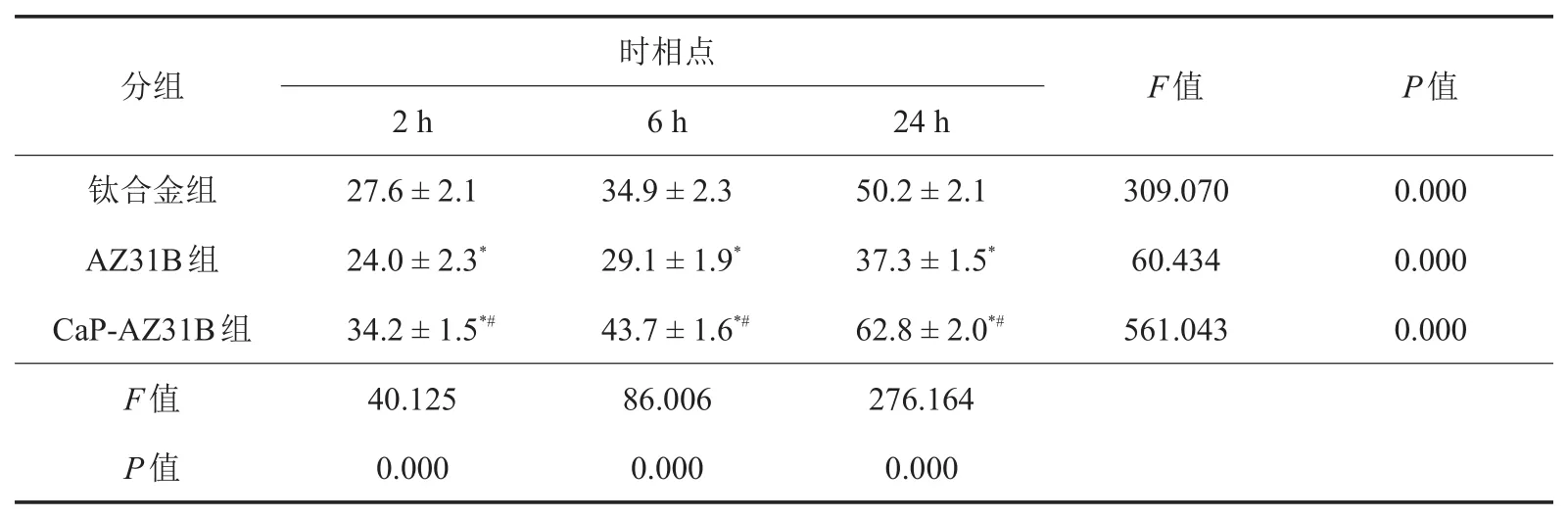
表1 不同时相点3组材料细胞黏附率比较结果(±s,n = 6,%)
注:AZ31B:镁合金;CaP-AZ31B:钙磷涂层镁合金;与钛合金组比较,*P<0.05;与AZ31B组比较,#P<0.05
分组钛合金组AZ31B组CaP-AZ31B组F值P值时相点2 h 27.6±2.1 24.0±2.3*34.2±1.5*#40.125 0.000 6 h 34.9±2.3 29.1±1.9*43.7±1.6*#86.006 0.000 24 h 50.2±2.1 37.3±1.5*62.8±2.0*#276.164 0.000 F值309.070 60.434 561.043 P值0.000 0.000 0.000
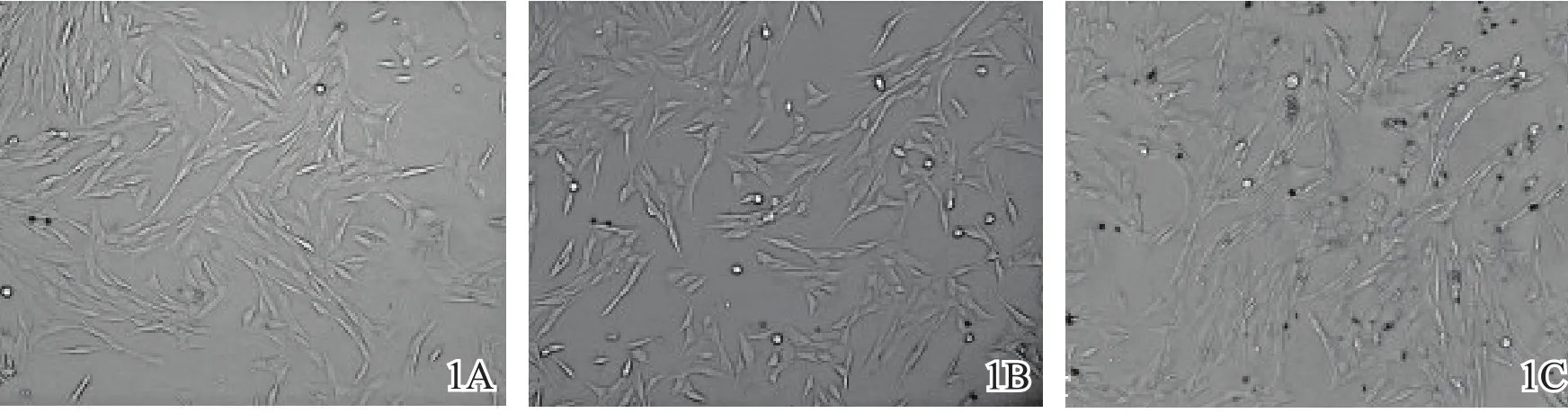
图1 小鼠前成骨细胞与3组材料浸提液共培养5 d倒置显微镜形态(×100)1A钛合金组1B镁合金组1C钙磷涂层镁合金组可见部分脱落的钙磷涂层颗粒
表2 不同时相点3组细胞增殖活力(OD值)比较结果(x-±sn = 6)

表2 不同时相点3组细胞增殖活力(OD值)比较结果(x-±sn = 6)
注:OD:光密度;AZ31B:镁合金;CaP-AZ31B:钙磷涂层镁合金;与钛合金组比较,*P<0.05;与AZ31B组比较,#P<0.05
分组钛合金组AZ31B组CaP-AZ31B组F值P值时相点1 d 0.368±0.011 0.291±0.011*0.360±0.018#80.369 0.000 3 d 0.722±0.009 0.548±0.012*0.689±0.020*#220.544 0.000 5 d 0.973±0.021 0.731±0.019*0.918±0.020*#193.966 0.000 7 d 1.192±0.071 0.891±0.082*1.134±0.079#26.718 0.000 F值705.554 294.012 483.505 P值0.000 0.000 0.000

表3不同时相点3组细胞内总蛋白量比较结果(x-±s,n = 6,μg/mL)
3 讨论
镁元素是构成骨组织中无机成分的主要元素,可以促进骨组织的再生和骨基质的分泌,在人体代谢过程中担负十分重要的作用[2]。镁合金是一种可降解的金属材料,前期研究表明镁合金具有良好的生物学效应[3];但降解速度较快,因此导致单纯无涂层镁合金降解周围环境的pH值改变,具有一定的细胞毒性[4]。为了降低镁合金的降解速度,减轻其所带来的细胞毒性,学者们开始尝试表面改性技术,如钙磷涂层、氟涂层等[5-7],有效延缓了镁合金的降解。
钙磷涂层是骨科植入材料最常用的涂层,研究表明,该涂层不但可以延缓镁合金的降解,而且还能提高其生物相容性能[8-9]。但作为潜在的骨科植入材料,钙磷涂层镁合金对成骨细胞和成骨环境究竟有何影响,是值得我们深入研究的问题。考虑到目前骨科常用的植入材料为医用钛合金,因此我们设置钛合金组及未涂层镁合金组为对照组,对比研究钙磷涂层镁合金对成骨细胞生物学性能的影响。
3.1成骨细胞黏附性能
黏附是植入材料与成骨细胞接触的第一步,它将直接影响成骨细胞在其表面的增殖及分化。影响黏附的因素包括材料表面的形貌、粗糙度、表面元素成分及金相结构等[10-11],这些影响因素不是孤立存在的,而是通过共同作用来影响细胞在材料表面的黏附。
3.1.1镁合金的细胞黏附性能左林等[12]进行镁合金(含Zn 2%、Mn 0.8%、Ca 1.0%)大鼠成骨细胞黏附试验,认为镁合金不利于大鼠成骨细胞黏附。另有学者证实镁合金植入生物体后,可在其表面形成磷酸盐类物质,进而周围会产生大量成骨细胞,表明镁具有良好的骨诱导能力[13];Yang等[14]将AZ31镁合金植入动物体内,亦发现材料降解后表面有Ca-P物质沉积,合金表面的生物活性有所增强。本试验结果亦表明,镁合金植入体内后具有良好的生物活性,证实镁合金的降解虽然改变了局部的酸碱性能,但机体存在的动态血液循环和强大的酸碱缓冲系统,在一定程度上消除了酸碱性能对其黏附增殖能力的影响。
3.1.2钙磷涂层镁合金的细胞黏附性能Park等[15]的研究结果证实钙磷涂层镁合金能刺激成骨细胞MC3T3-E1细胞分化,进而促进骨折快速愈合;Xu等[16]应用磷酸钙涂层镁合金进行体外成纤维细胞培养,结果发现细胞黏附和增殖良好;Iskandar等[17]以大鼠骨髓间充质干细胞为试验细胞,采用直接接触试验研究,结果同样表明磷酸钙涂层对细胞具有较好的黏附性能。本研究结果发现,成骨细胞能够顺利在合金材料表面黏附;随着黏附时间的延长,MC3T3-El细胞在钙磷涂层镁合金表面黏附率逐渐增加,且其黏附率明显优于未涂层镁合金和钛合金。其原因可能是钙磷涂层不仅增加了镁合金表面的粗糙度和表面积,而且还改变了材料表面的元素组成(从单纯的镁铝锌金属元素到钙磷元素),同时弱化了酸碱性能对细胞黏附能力的影响。
3.2成骨细胞增殖活力及细胞功能
如前所述,在镁合金表面进行钙磷涂层,可有效延缓镁合金的降解速度,减少镁合金周围环境的pH值改变,降低细胞毒性,提高生物相容性。郭磊等[18]通过体外直接接触细胞毒性试验和MTT比色法试验,证实钙磷涂层镁合金材料具有良好的生物相容性,其碱性磷酸酶活性显著高于Ca-P/ Ti-6Al-4材料组和AZ31B材料组,对成骨细胞的增殖和分化功能具有正性调节作用;Lu等[19]的研究结果也表明,纯镁表面制备β-磷酸三钙涂层可明显提高其细胞相容性;亦有学者应用β-TCP涂层镁合金进行体外实验,通过免疫印迹法检测到骨形成蛋白-2水平的高表达[20]。
本研究的细胞增殖活力检测结果显示,钙磷涂层镁合金具有良好的生物学性能,对成骨细胞无细胞毒性,其细胞增殖活力显著优于无涂层镁合金;进一步的倒置显微镜观察显示,MC3T3-E1细胞贴壁良好,形态大多呈长梭形,表明钙磷涂层镁合金浸提液对MC3T3-E1细胞生长增殖无不良影响。在此基础上,我们针对钙磷涂层镁合金是否影响成骨细胞功能进行了相关研究,细胞内总蛋白结果表明钙磷涂层镁合金浸提液培养的细胞其胞内总蛋白量显著高于镁合金组及钛合金组,提示钙磷涂层对于成骨细胞功能具有一定的促进作用。
综上所述,钙磷涂层镁合金可增强小鼠成骨细胞的黏附能力和增殖能力,促进细胞内总蛋白的表达,具有良好的生物相容性。但本研究为体外实验,其植入体内后对成骨细胞增殖分化及成骨分化基因的表达有无影响,还有待进一步的研究。
参考文献
[1]国家药品监督管理局. GB/T 16886.5-2003医疗器械生物学评价第5部分:体外细胞毒性试验[S].北京:中国标准出版社,2003.
[2]Daronch M,Rueggeberg FA,Moss L,et al. Clinically relevant issues related to preheating composites[J]. J Esthet Restor Dent,2006,18(6):340-350.
[3]张涛,尹庆水,夏虹,等.镁合金AZ31B对骨骼肌细胞黏附及增殖的影响[J].中国矫形外科杂志,2012,20(22):2074-2077.
[4]Drynda A,Hassel T,Hoehn R,et al. Development and biocompatibility of a novel corrodible fluoride-coated magnesium-calcium alloy w ith improved degradation kinetics and adequate mechanical properties for cardiovascular applications[J]. J Biomed Mater Res A,2010,93(2):763-775.
[5]Hiromoto S,Inoue M,Taguchi T,et al. In vitro and in vivo biocompatibility and corrosion behaviour of a bioabsorbable magnesium alloy coated w ith octacalcium phosphate and hydroxyapatite[J]. Acta Biomater,2015,11:520-530.
[6]Lu Y,Wan P,Zhang B,et al. Research on the corrosion resistance and formation of double-layer calcium phosphate coating on AZ31 obtained at varied temperatures[J]. Mater Sci Eng C Mater Biol Appl,2014,43:264-271.
[7]Sun W,Zhang G,Tan L,et al. The fluoride coated AZ31B magnesium alloy improves corrosion resistance and stimulates bone formation in rabbit model[J]. Mater Sci Eng C Mater Biol Appl,2016,63:506-511.
[8]Zhang T,Wu XN,Pu XB,et al. Comparative study of different coatings on magnesium alloys:the effect on MSC proliferation and osteogenic differentiation[J]. J Biomate Tissue Eng,2015(5):579-585.
[9]张涛,尹庆水,夏虹,等.钙磷涂层镁合金对兔骨骼肌细胞生物学行为的影响[J].中国骨科临床与基础研究杂志,2013,5 (1):21-27.
[10]Prasanna N,Pallavi Reddy Y,Kavitha S,et al. Degree of conversion and residual stress of preheated and room-temperature composites[J]. Indian J Dent Res,2007,18 (4):173-176.
[11]Conserva E,Lanuti A,Menini M. Cell behavior related to implant surfaces w ith different m icrostructure and chem ical composition:an in vitro analysis[J]. Int J Oral Maxillofac Implants,2010,25(6):1099-1107.
[12]左林,柏树令,潘锋,等.镁合金表面含硅涂层对成骨细胞的黏附、形态和细胞周期的影响[J].解剖学杂志,2011,34(2):152-155.
[13]Zhai Z,Qu X,Li H,et al. The effect of metallic magnesium degradation products on osteoclast-induced osteolysis and attenuation of NF-κ B and NFATc1 signaling[J]. Biomaterials,2014,35(24):6299-6310.
[14]Yang JX,Cui FZ,Lee IS,et al. In vivo biocompatibility and degradation behavior of Mg alloy coated by calcium phosphate in a rabbit model[J]. J Biomater Appl,2012,27 (2):153-164.
[15]Park KD,Lee BA,Piao XH,et al. Effect of magnesium and calcium Phosphate coatings on osteoblastic responses to the titanium surface[J]. J Adv Prosthodont,2013,5(4):402-408.
[16]Xu LP,Pan F,Yu G,et al. In vitro and in vivo evaluation ofthe surface bioactivity of a calcium phosphate coated magnesium alloy[J]. Biomater,2009,30(8):1512-1523.
[17]Iskandar ME,Aslani A,Liu H. The effects of nanostructured hydroxyapatite coating on the biodegradation and cytocompatibility of magnesium implants[J]. J Biomed Mater Res A,2013,101(8):2340-2354.
[18]郭磊,刘魁,高晓宇,等.磷酸钙涂层的AZ31B镁合金材料对成骨细胞功能的影响[J].中国现代医学杂志,2009,19(2):161-163.
[19]Lu YJ,Tan LL,Xiang HL,et al. Fabrication and characterization of Ca-Mg-P containing coating on pure magnesium [J]. J Mater Sci Technol,2012,28(7):636-641.
[20]Chai H,Guo L,Wang X,et al. In vitro and in vivo evaluations on osteogenesis and biodegradability of a β-tricalcium phosphate coated magnesium alloy[J]. J Biomed Mater Res A,2012,100(2):293-304.
短篇论著
The influence of magnesium alloy w ith calcium phosphate coating(CaP-AZ31B)on the biological properties of m ouse osteoblasts
ZHANG Tao*,XIA Hong,YIN Qingshui,LI Mei,ZHANG Yu,YANG Xiaoming,LAN Guobo. *Hospital of Orthopaedics,Orthopaedic Trauma Institute of PLA,the Key Lab of Trauma & Tissue Repair of Tropical Area of PLA,Guangzhou General Hospital of Guangzhou Military Command,Guangzhou,Guangdong 510010,China
【Abstract】Objective To study the influence of magnesium alloy w ith calcium phosphate coating (CaP-ZA31B)on the biological properties of mouse osteoblast precursor cells(MC3T3-E1). Methods In this study,they were divided into CaP-ZA31B group and two control groups[magnesium alloy(AZ31B)group andbook=37,ebook=37titanium alloy group]. Adhesion rates of MC3T3-E1 cells on the surface of the materials in 3 groups 2,6,and 24 hours after co-culture were observed;Cell morphology of MC3T3-E1 1,3,5,7 days after co-culture w ith leach liquor of materials in 3 groups were determ ined by using inverted m icroscope,and w ith CCK assay and BCA assay,MC3T3-E1 proliferation activities were detected,at the same time,total protein of MC3T3-E1 was also calculated in each group. Results As time of co-culture went by,adhesion rate,proliferation viability as well as total protein of MC3T3-E1 in 3 groups all increased significantly(P<0.05). At different time-points,cell adhesion rate of MC3T3-El cell in CaP-AZ31B group>titanium alloy group>AZ31B group(P<0.05). MC3T3-E1 cell in leach liquor of material in each group showed good attachment to the wall,which most of cells presented fusiform. Cell proliferation viability in CaP-AZ31B groups was better than that in AZ31B group at different time-point(P<0.05);As for total protein of MC3T3-E1,CaP-AZ31B group>titanium alloy group>AZ31B group(P<0.05). Conclusion Compared to AZ31B or titanium alloy,CaP-AZ31B has better biocompatibility w ith mouse osteoblast precursor cells because the material could enhance cell adhesion and proliferation viability,and improve the expression level of intracellular total protein more significantly.
【Key words】Magnesium;Alloys;Calcium phosphates;Coating;Biocompatible materials;M ice;Osteoblasts;Cells,cultured;Adhesion;Proliferation
中图分类号:R329.24,R336
文献标识码:A
文章编号:1674-666X(2016)02-098-06
DOI:10.3969/j.issn.1674-666X.2016.02.006
基金项目:国家自然科学基金项目(30872642);广东省科技计划项目(2014A020215025);广东省自然科学基金项目(2015A030313607);军队“十二五”计划课题重点项目(BWS11C065);广东省药学会研究基金(2015ZT06)
通信作者:夏虹,E-mail:gzxiahong2@126.com
Corresponding author:XIA Hong,E-mail:gzxiahong2@126.com
收稿日期:(2016-01-12;修回日期:2016-02-28)(本文编辑:白朝晖)
