恩替卡韦和干扰素序贯作用对HepG2.2.15细胞HBVDNA复制的影响
2016-06-01杨伟,赵超,李婧,丁扬,王雪
杨 伟,赵 超,李 婧,丁 扬,王 雪
解放军第89医院传染科,山东 潍坊 261021
论著·肝相关疾病
恩替卡韦和干扰素序贯作用对HepG2.2.15细胞HBVDNA复制的影响
杨 伟,赵 超,李 婧,丁 扬,王 雪
解放军第89医院传染科,山东 潍坊 261021
目的 探讨恩替卡韦(Entecavir,ETV)与干扰素(IFNα-2b)序贯作用对HepG2.2.15细胞HBV DNA复制的影响。方法 将培养HepG2.2.15细胞分组,单独组中分别加入不同浓度ETV的配制液(1.5 μg/ml、5 μg/ml、10 μg/ml)或IFNα-2b配制液(5 000 IU/ml、10 000 IU/ml、15 000 IU/ml);联合组中联合加入ETV和IFNα-2b配制液;序贯组中先后加入ETV和IFNα-2b序贯配制液。在不同时点,采用MTT法检测HepG2.2.15细胞增殖情况,采用实时荧光定量法检测各组细胞培养上清液中HBV DNA水平,酶联免疫法(ELISA)检测上清液中HBsAg与HBeAg水平。结果 随着时间延长,序贯组对HepG2.2.15的HBV DNA复制抑制作用明显大于其他两组(P<0.05);对HBsAg与HBeAg的抑制作用随时间的延长而加强(P<0.05)。结论 ETV与IFNα-2b序贯作用于HepG2.2.15细胞,对HepG2.2.15细胞HBV DNA复制有明显的抑制作用,且作用强于单独或联合使用。
恩替卡韦;干扰素α-2b;HepG2.2.15细胞;HBV DNA;序贯作用
乙肝病毒(hepatitis B virus,HBV)感染是我国引起肝硬化、肝功能衰竭及肝细胞癌的主要原因[1]。恩替卡韦(Entecavir,ETV)是目前临床常用的核苷酸类似物药物,它能阻止病毒DNA链的延伸,使病毒停止扩增,但需长期用药,且远期疗效有待观察。干扰素α-2b(interferon α-2b,IFNα-2b)是一种多功能免疫调节因子,其抗HBV机制可能涉及多方面[2]。虽然上述两种药物的抗病毒效果已取得共识,但在采用单独、联合或序贯使用药物抗病毒治疗等方式上仍存在较大争议,一方面认为序贯抗病毒治疗可以引起病毒的耐药性,导致后序治疗更加困难[3],而另一方面认为序贯抗病毒治疗可以很好的控制乙肝患者体内的病毒数量,改善患者的生活质量[4]。本实验以体外的HepG2.2.15细胞建立HBV DNA复制模型,从体外实验角度探讨上述各种治疗方法的优缺点,为HBV临床治疗提供参考。
1 材料与方法
1.1 主要材料及试剂 HepG2.2.15细胞株购自上海瑞鹿生物科技有限公司。精制小牛血清及DMEM培养基购自美国GIBCO公司。ETV由福建广生堂股份有限公司生产,ETV液制备:ETV 2片(0.5 mg/片),研磨成粉,加入20 ml磷酸盐缓冲液(PBS)溶液,室温搅拌2 h,过滤除菌,调整为1.5 μg/ml、5 μg/ml、10 μg/ml,4 ℃保存备用。重组人IFNα-2b注射液(安福隆)3 000 000 U、由天津华利达生物有限公司生产,干扰素液制备:取母液30 ml,加入2 970 μl完全培养基,混匀,调整为5 000 IU/ml、10 000 IU/ml、15 000 IU/ml,-20 ℃保存备用。阴性对照液:取1%二甲亚砜(DMSO) 30 μl母液加入2 970 μl完全培养基,混匀。
1.2 分组及药物处理方法 从液氮罐中取出HepG2.2.15细胞,迅速水浴后,将其加入含有细胞培养液的离心管中,混匀离心弃去上清后浆细胞悬液置于含有5 ml的细胞培养基中,放入细胞培养箱。待细胞长成单层后,用0.25%的胰酶消化,每周传代一次,将HepG2.2.15细胞分为:(1)单独ETV组:96孔板,10 000细胞/孔,培养24 h后分别加入3种浓度ETV液200 μl,在2、4、6 d收集培养上清液用于检测;(2)单独IFNα-2b组:96孔板,10 000细胞/孔,培养24 h后分别加入上述3种不同浓度IFNα-2b 200 μl,同上收集上清液;(3) 联合作用组:96孔板,10 000细胞/孔,培养24 h后加入ECT与IFNα-2b混合药液,同上收集上清液;(4) 序贯作用组:取中等浓度(5 μg/ml)ETV溶液加入培养基中处理3 d,补加中等浓度(10 000 IU/ml)500 μl的IFNα-2b处理1 d,取上清液0.5 ml,再加IFNα-2b(10 000 IU/ml)500 μl,2 d后留取上清0.5 ml,-70 ℃冻存。上述各组每孔复设4个复孔;(5) 阴性对照组:取母液30 μl,加入2 970 μl完全培养基混匀,在相应时点取标本进行各项指标检测。
1.3 ETV与IFNα-2b对HepG2.2.15细胞增殖影响的检测 MTT细胞增殖及细胞毒性检测试剂盒购自北京Solarbio科学技术有限公司。将各组的细胞板吸取孔内液体留存后,每孔加入90 μl新鲜培养液,再加入110 μl MTT溶液,继续培养4 h,然后吸取上清,每孔加入110 μl Formazan溶解液,置摇床上低速振荡10 min,使结晶充分溶解。酶联免疫检测(ELISA)490 nm处各孔的吸光值。阳性对照为1%的DMSO溶液,阴性对照为未加入药液的培养基留置最后一孔作为空白孔。
1.4 HBV DNA的检测 取上述细胞培养上清液3 μl进行HBV DNA定量测定,采用PCR-荧光探针“一管法”,BioRadcfx96型全自动荧光扩增仪购自美国BioRad公司,试剂盒购自北京鑫诺美迪基因检测技术有限公司,产品标准编号为YZB/国0443-2013,操作按说明书进行。1.5 HBsAg与HBeAg水平的检测 取上述细胞培养上清液50 μl用于HBsAg与HBeAg检测,采用 ELISA,试剂盒购自北京生物技术研究所,操作按说明书进行。
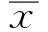
2 结果
2.1 ETV、IFNα-2b对HepG2.2.15细胞增殖的影响单独作用时,不同浓度ETV对HepG2.2.15细胞的增殖无明显抑制作用,而不同浓度的IFNα-2b对HepG2.2.15细胞有一定抑制率,与ETV组比较,差异有统计学意义(P<0.05,见表1)。
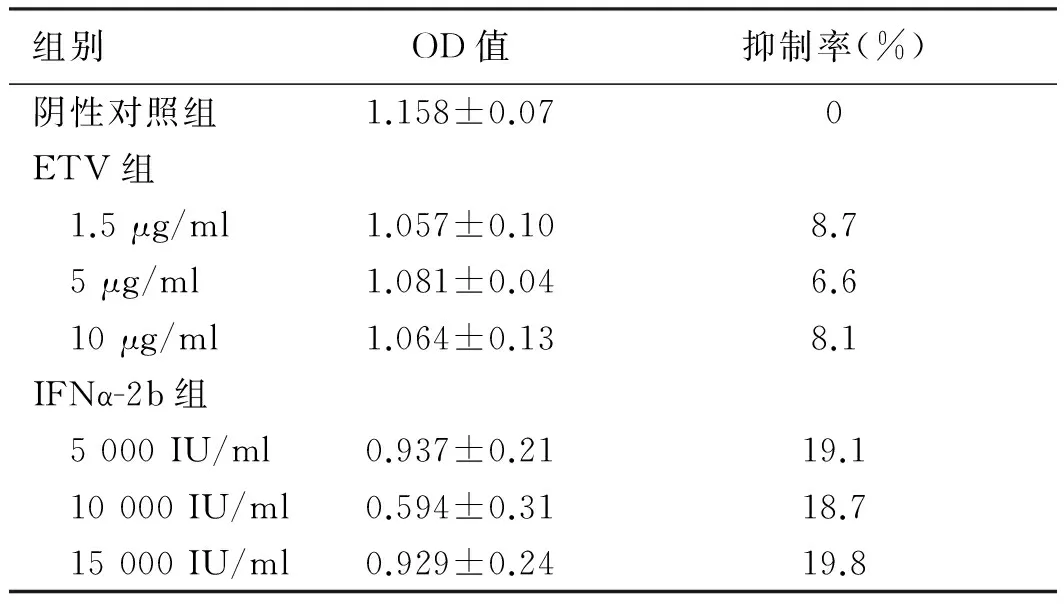
表1 ETV、IFNα-2b单独作用对HepG2.2.15细胞生长的抑制作用Tab 1 The inhibition effect of HepG2.2.15 cells replication by individual treatment with ETV and IFNα-2b
2.2 各组对HepG2.2.15细胞HBsAg与HBeAg表达的影响 随着时间的延长,IFNα-2b组、联合作用组、序贯作用组对HBsAg分泌抑制作用明显增强(P<0.05);单用IFNα-2b组与联合作用组差异无统计学意义(P>0.05);序贯组抑制率明显强于其余各组,差异有统计学意义(P<0.05,见表2)。另IFNα-2b组、联合作用组、序贯作用组对HBeAg抑制作用明显强于ETV组(P<0.05);单用IFNα-2b组与联合作用组差异无统计学意义(P>0.05);序贯组对HBeAg抑制作用强于其余各组,差异有统计学意义(P<0.05,见表3)。
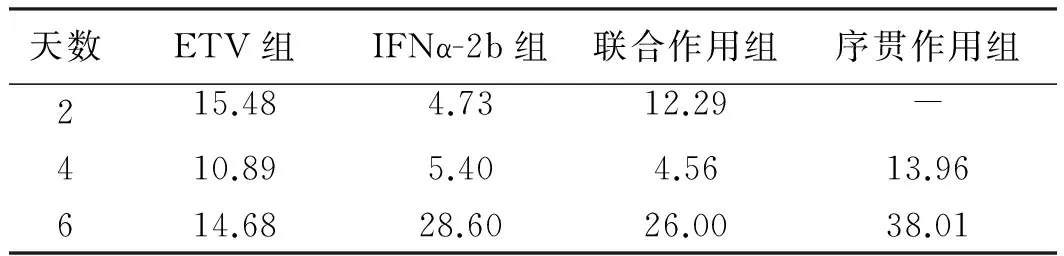
表2 ELISA法检测HepG2.2.15细胞培养上清HBsAg的抑制率(%)Tab 2 The HBsAg inhibition ratio of the supermatant HepG2.2.15 cells by ELISA (%)
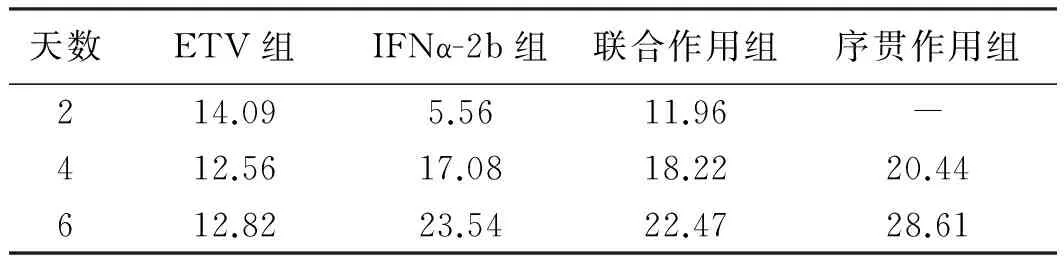
表3 ELISA法检测HepG2.2.15细胞培养上清HBeAg的抑制率(%)Tab 3 The HBeAg inhibition ratio of the supermatant HepG2.2.15 cells by ELISA (%)
2.3 各组对HBV DNA复制的抑制作用 各实验组对HBV DNA有明显的抑制作用,且随着时间的延长,抑制作用增强;但各实验组之间抑制率差异无统计学意义(P<0.05,见表4)。

表4 各组HBV DNA定量检测情况(copies/ml)Tab 4 The quantitative detection results of HBV DNA in each group (copies/ml)
3 讨论
ETV是核苷酸类似物的代表性药物,它能阻止病毒在肝细胞内逆转录过程中DNA链的延伸,使病毒停止扩增。然而只有长期用药才能最大限度的维持病毒的低水平,大量临床资料证明核苷酸类似物对于HBV ccDNA无直接清除作用[5],且容易诱导病毒产生耐药的变异,导致用药期间病毒的反跳。IFNα-2b是一种多功能免疫调节因子,可诱导细胞产生抗病毒蛋白,具有特殊的抗病毒作用[6]。HepG2.2.15细胞株是由2个头尾相连的HBV DNA全基因重组质粒沾染受体细胞HepG2而获得的,可在体外增殖,在细胞培养上清中分泌HBsAg、HBeAg和完整的DANE颗粒,同时还能产生大量的复制中间体,是目前各实验室广泛用于筛选和评价体外抗HBV药物良好的实验模型[2]。
本实验采用HepG2.2.15细胞株为模型,观察上述不同用药方法时,各项指标被药物抑制的动力学效果。实验结果表明,ETV对HepG2.2.15细胞的自身增殖无明显抑制作用,而IFNα-2b对HepG2.2.15细胞自身增殖有明显抑制作用,与临床上观察到单用干扰素抗病毒治疗时,其疗效和毒副作用均大于核苷酸类药物的现象一致。虽然各实验组对HBV DNA都有较高的抑制率,但随着时间的延长,联合组和序贯组对HepG2.2.15细胞分泌HBsAg、HBeAg有明显抑制作用,以序贯组作用最强,差异有统计学意义,提示序贯疗法可能成为一种治疗乙肝的有效方式。可是由于实验时间过短,药物能否导致病毒变异这一情况未能在本实验中体现,因此序贯疗法能否长时间在人体内有这种实验学现象仍需进一步探索和验证。本实验结果部分支持了基于“路线图”联合治疗,及序贯治疗的有效性和可行性。但在临床治疗应用时,患者体质状况、病毒的变异程度、治疗费用对患者依从性的影响及社会的费用效益比等,都影响治疗方案的选择,所以在临床治疗时,我们应综合各种因素判断,慎重选择适当的治疗方法。
[1]European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis B [J]. J Hepatol,2009,50(2): 227-242.
[2]Guidotti LG,Chisari FV. Cytokine-mediated control of viral infections [J]. Virology,2000,273(2): 221-227.
[3]Janssen HL,van Zonneveld M,Senturk H,et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HbeAg-positive chronic hepatitis B: a randomised trial [J]. Lancet,2005,365(9454): 123-129.
[4]Tian Q,Zuo WZ,Cao YW,et al. Clinic efficacy of sequential therapy with Lamivudine and recombinant human interferon α-1b combination compared to Lamivudine or recombinant human interferon α-1b monotherapy in HBeAg positive chronic hepatitis B patients [J]. Progress in Modern Biomedicine,2011,11(19): 3694-3695. 田群,左维泽,曹玉文,等. 拉米夫定与IFNα-1b序贯治疗HBeAg阳性慢性乙肝患者临床疗效观察[J]. 现代生物医学进展,2011,11(19): 3694-3695.
[5]Werle-Lapostorlle B,Bowden S,Locarnini S,et al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovior dipivxil therapy [J]. Gastroenterology,2004,126(7): 1750-1758.
[6]Xu YL,Liu LJ,Hou LJ,et al. Effect of interferon α2a combined with interleukin-2 on proliferation of HepG2.2.15 cells and replication of hepatitis B virus in vitro [J]. Chinese Journal of Biologicals,2013,26(7): 970-972. 徐艳玲,刘令九,侯丽娟,等. 干扰素α2a与白细胞介素-2联合作用对体外HepG2.2.15细胞增殖及乙型肝炎病毒复制的影响[J]. 中国生物制品学杂志,2013,26(7): 970-972.
(责任编辑:王全楚)
The effect on replication of HBV DNA in HepG2.2.15 cells by the sequential treatment with Entecavir following interferon α-2b
YANG Wei,ZHAO Chao,LI Jing,DING Yang,WANG Xue
Department of Infectious Disease,the 89th Hospital of PLA,Weifang 261021,China
Objective To investigate the effect on replication of HBV DAN in HepG2.2.15 cells by the sequential treatment with Entecavir (ETV) following interferon α-2b (IFNα-2b). Methods In individual groups,HepG2.2.15 cells were treated with various concentrations of ETV (1.5 μg/ml,5 μg/ml,10 μg/ml) and IFNα-2b (5 000 IU/ml,10 000 IU/ml,15 000 IU/ml) individually; in combination group,HepG2.2.15 cells were treated with ETV and IFNα-2b combination; in sequential groups,HepG 2.2.15 cells were treated with ETV following IFNα-2b. The method of determined proliferation was MTT; HBV DNA copies were detected by Real time PCR-fluorescence probing in one-tube method from the supermatant of HepG 2.2.15 cells; HBsAg and HBeAg expressions from the supermatant were measured by ELISA at different time points. Results Compared with the individual groups or the combination group,sequential group had more powerful inhibition effects on HBV DNA replication,the more powerful inhibition expressions of HBsAg and HBeAg in HepG2.2.15 cells. Conclusion The sequential treatment with ETV following IFNα-2b has more powerful effect on replication of HBV DNA than the individual treatment or combination treatment.
Entecavir; Interferon α-2b; HepG2.2.15 cells; HBV DNA; Sequential treatment
杨伟,硕士,主任医师,硕士生导师,研究方向:肝病。E-mail:ywcyw723@sina.com
10.3969/j.issn.1006-5709.2016.04.012
R512.6+2
A
1006-5709(2016)04-0408-03
2015-09-20
