不同强度激光对递增负荷运动大鼠心脏炎性损伤和CD8+T淋巴细胞表达的影响
2016-06-01麻晓鸽王松涛覃飞贡文武24
麻晓鸽,王松涛,覃飞,贡文武24
(华南师范大学 体育科学学院,广东 广州 510006)
不同强度激光对递增负荷运动大鼠心脏炎性损伤和CD8+T淋巴细胞表达的影响
麻晓鸽,王松涛,覃飞,贡文武24
(华南师范大学 体育科学学院,广东 广州 510006)
摘 要:观察递增负荷运动大鼠心脏炎症损伤和CD8+T淋巴细胞的改变及其关系,探讨不同强度激光治疗对大强度运动心脏的保护作用。8周龄雄性SD大鼠随机分为对照组(C),54只;实验组54只,分为低强度激光+运动组(LE)、高强度激光+运动组(HE)、运动组(E),每组18只。各组分别在2、4、6周末时取材,评定大鼠心脏系数、心脏整体形态、心肌病理积分、心肌CD8+T淋巴细胞及心肌细胞凋亡情况。结果:与C组比较,E组大鼠6周末时心肌细胞呈现明显炎性浸润,心肌纤维扭曲、肿胀及断裂,病理积分呈显著性差异(P<0.05);大鼠血清TNF-α增加、心肌CD8+T淋巴细胞浸润、心肌细胞凋亡指数增加呈非常显著性差异(P<0.01)。同时期(2、4、6周末)LE组与E组比较,心肌细胞炎性略轻。6周末时LE组CD8+T淋巴细胞及心肌细胞凋亡数较C组均上升,而较E组均非常显著性下降(P<0.01)。结果说明低激光治疗可在一定程度上减轻心肌内炎症浸润和致炎性因子,降低心肌病理程度,抑制心肌细胞的凋亡进程。
关 键 词:运动医学;心肌炎性损伤;递增负荷运动;低强度激光;CD8+T淋巴细胞;大鼠
科学合理的运动训练可使心脏产生良好的适应,提高心肌功能,而不当的大强度运动或训练则可对机体造成不同程度的损伤,尤其是心脏作为最敏感的动力泵血器官,易产生病理性心肌损伤。已有研究证实,重复性的大强度应力刺激会导致心肌炎症、心肌纤维化、心衰和室壁运动异常等[1]。心肌细胞凋亡及局部炎症因子浸润可能是导致大强度运动诱发心肌损伤和心功能障碍的重要机制之一[2]。有的研究也证实免疫系统和炎症在多种代谢性疾病,如胰岛素抵抗、2型糖尿病、动脉粥样硬化、非酒精性脂肪肝等疾病的发生发展过程中起着重要作用[3]。因此,炎症可能是心血管疾病和大强度运动所致心功能异常的重要启动因素。T淋巴细胞介导的细胞免疫是机体致病的重要机制,其介导的细胞免疫形式主要是CD4+T细胞介导的迟发型超敏反应及CD8+T淋巴细胞介导的细胞毒性反应,而CD8+T淋巴细胞在多种免疫性及炎症性疾病,如获得性免疫缺陷综合征、肿瘤等的发生发展中发挥着重要作用。但目前,CD8+T淋巴细胞在心肌细胞病变中的免疫调节作用仍然不清。因此,探讨大强度递增负荷运动导致的心肌损伤及其相关免疫调节机制,对于解决运动医学和临床医学领域的相关疾病和健康问题均具有重要意义。激光医学的发展促进了运动医学领域对激光的重视。激光束作用于生物组织时,不会造成生物组织不可逆的损伤,但可刺激机体产生一系列生理生化反应,对组织或机体起到调节、增强或抑制作用。低强度激光(Low-level laser therapy,LLLT)在调节炎症反应、减缓疼痛、抑制深层组织损伤等方面疗效已得到公认[4-5],而运动性心肌损伤的激光调节作用,目前尚缺乏研究。综上所述,我们推测低强度激光可能会在调节大强度递增负荷运动所致心脏结构和功能性异常中发挥重要作用,其机制可能涉及CD8+T淋巴细胞介导的炎症性免疫反应。因此,本研究在大鼠递增负荷运动模型基础上,通过检测炎症因子TNF-α、心肌组织学改变、心肌CD8+T淋巴细胞表达和心肌细胞凋亡等情况,揭示大负荷运动所致的心肌炎症性损伤,并探讨CD8+T淋巴细胞在其中的调控机制。同时,采用两种不同强度的激光(低强度和高强度)进行干预治疗,进一步探索不同强度激光对递增负荷大鼠心肌炎性改变和CD8+T淋巴细胞表达的影响,为运动性心脏损伤的保护提供相应的干预靶点及实验支持。
1 研究对象与方法
1.1 研究对象及分组
108只SPF 8周龄雄性SD大鼠(广东省中医药大学动物实验中心,许可证号:SCXK(粤)2008-0020;NO:0043379,粤监证字F2008A002,体重180~200 g)。分笼饲养,每笼4~5只,温度(24±2) ℃,相对湿度45%~65%,自然光照,自由摄取食物和水。动物处置符合《关于善待实验动物的指导性意见》(2006,科技部)。
大鼠随机分为对照组(C,54只),正常喂养,不运动,用于判别大鼠生长对实验指标的影响。实验组54只分为低强度激光+运动组(LE,18只)、高强度激光+运动组(HE,18只)、运动组(E,18只)3组,分别进行递增负荷运动和激光治疗干预。各组在第2、4、6周末时随机抽样,取材测定相关指标。
1.2 运动方案
运动组和激光治疗组大鼠进行逐级递增负荷跑台运动训练6周,坡度为0°,30 min/次,1次/d,6 d/周(周日休息)。第1周运动负荷为10 m/min,第2周负荷递增至20 m/min,随后每周递增负荷量为5 m/min,至第6周,跑台速度达到40 m/min最大负荷强度。
1.3 激光治疗方案
激光治疗采用He-Ne半导体激光治疗仪,每天在大鼠运动后2 h,分别采用低强度(1 mW,6.79 J/cm2)和高强度(2 mW,13.58 J/cm2)激光,在大鼠鼻翼两侧照射2 min。
1.4 测试指标及方法
主要试剂:R-TNF-α试剂盒(Multisciences,中国);CD8+T细胞试剂盒(Abcam,UK);TUNEL凋亡检测试剂盒(Roche,USA)。
1)组织取材:大鼠末次运动后休息1 d,隔日晨质量分数10%水合氯醛(3.5~4.5 mL/kg)腹腔注射麻醉,打开腹腔,腹主动脉取血,静置后离心取血清,-80 ℃保存待测。立即取出心脏放入预冷的生理盐水中,洗去血迹,去除结缔组织,用滤纸吸干,分别记录心脏质量(Hw)与体质量分数(Bw);后放入质量分数10%的中性甲醛内固定,待HE及免疫组化分析。
2)大鼠心肌组织切片、HE染色及病理学检测:心肌组织切片经过常规HE染色,观察心肌纤维变化及心脏组织炎症细胞浸润情况;参照Rezkalla[6]的方法计算心肌病理组织学积分,即每张切片随机取5个400倍视野,计算每个视野中炎性细胞浸润及坏死面积与整个面积的比值。无病变计0分、病变面积<25%计1分、25%~50%计2分、50%~75%计3分、>75%计4分,以此判定心肌炎症的变化情况。
3)免疫组化法(SP法)检测心肌组织中CD8+T淋巴细胞的表达:常规脱蜡、水化,枸橼酸修复液高压抗原修复5~8 min。质量分数3%H2O2室温下孵育15 min,以阻断内源性过氧化氢酶活性,PBS洗涤,滴加鼠抗兔CD8+T细胞(1∶100)单克隆抗体。4 ℃冰箱过夜,PBS洗涤,均匀滴加生物素标记的抗鼠IgG抗体-HRP多聚体,37 ℃孵育20 min,PBS洗涤,DAB显色,苏木素复染,脱水、透明、封片。阴性对照组采用PBS代替一抗,其他步骤相同。光镜下观察,每张片子随机选取10个400倍视野,每个视野计算阳性细胞数目(阳性细胞为胞膜棕黄染色),并将CD8+T淋巴阳性细胞所占浸润炎症细胞数的平均百分比作为阳性细胞百分率。
4)TUNEL法检测心肌细胞凋亡:切片脱蜡、水化,PBS冲洗后蛋白酶K消化,TDT酶/生物素-dUTP反应液等处理,具体严格按照试剂盒说明进行操作。光镜下正常细胞核呈蓝色,凋亡细胞核呈现棕黄色。结果判定:随机选取10个400高倍视野的心肌细胞总数及阳性染色心肌细胞数目,按照Nsrula方法计算,公式:阳性细胞数/细胞总数×100%计算心肌细胞凋亡百分率。
1.5 数据统计学处理
所有数据均采用SPSS18.0统计软件处理,测试结果以均数±标准差(±s)表示。正态性检验采用Kolmogorov-Smirnov Test法;方差齐性检验采用Homogeneity of Variances法。正态分布数据采用单因素方差分析(one-way ANOVA),若方差齐性,以最小显著差法(LSD法)进行两两比较;若方差不齐,以Dennett’s T3法进行两两比较。
2 研究结果及分析
2.1 六周递增负荷运动大鼠心肌炎性改变
实验中对照组(C)大鼠正常喂养,不运动,用于判别生长对大鼠实验指标的影响。结果发现,对照组各指标(心肌组织病理检测,细胞因子TNF-α、心肌CD8+T淋巴细胞和心肌凋亡指数)在各周之间无显著性差异(P>0.05),提示6周的自然生长周期对上述各指标均无显著影响。但与对照组(C)比较,6周递增负荷运动(E)可导致大鼠心肌呈现显著的炎性改变(见表1)
表1 递增负荷运动所致心肌炎性改变(±s)
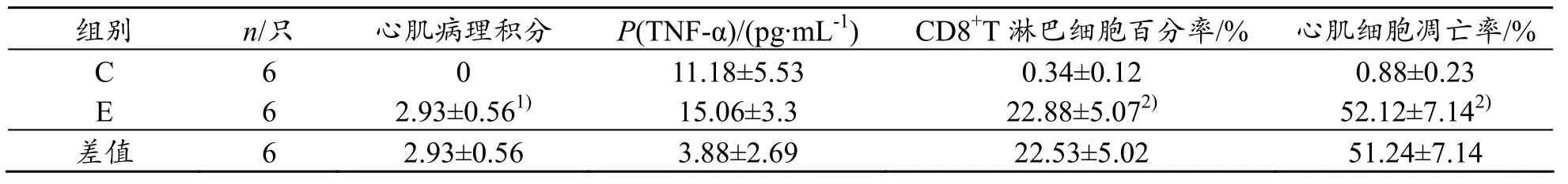
表1 递增负荷运动所致心肌炎性改变(±s)
与C组比较,1)P<0.05,2)P<0.01
组别 n/只 心肌病理积分 Ρ(TNF-α)/(pg·mL-1) CD8+T淋巴细胞百分率/% 心肌细胞凋亡率/% C 6 0 11.18±5.53 0.34±0.12 0.88±0.23 E 6 2.93±0.561) 15.06±3.3 22.88±5.072) 52.12±7.142)差值 6 2.93±0.56 3.88±2.69 22.53±5.02 51.24±7.14
2.2 激光对6周递增负荷运动大鼠心肌炎性损伤的影响
1)心脏重量及心脏系数。
研究结果显示不同时间点(2、4、6周)的低强度激光治疗组(LE)的心脏质量、体质量和心脏系数均低于同时间段的HE和E组,尤其是6周的E组大鼠心脏质量、体质量都较2周的HE组和6周的LE组高,差异非常显著(P<0.01);其他组之间差异则不显著(见表2)。
表2 激光对6周递减运动负荷小鼠心脏质量、体质量和心脏系数的影响(±s)

表2 激光对6周递减运动负荷小鼠心脏质量、体质量和心脏系数的影响(±s)
1)各组2周与4周比较,P<0.05;2)4周与6周比较,P<0.05;3)2周与6周比较,P<0.05;4)2周与6周比较,P<0.01;5) E组与LE组比较,P<0.05;6)LE与HE比较,P<0.01
心脏质量/g 体质量/g 心脏系数组别n/ 只 2周 4周 6周 2周 4周 6周 2周 4周 6周E 6 1.012 4± 0.135 0 1.066 9± 0.122 7 1.116 1± 0.151 8 278± 17.81 288.83± 25.33 317.4± 16.473)0.003 64± 0.000 358 0.003 69± 0.000 214 0.003 52± 0.000 346 LE 6 0.968 1± 0.045 4 1.093 5± 0.064 4 0.940 0± 0.0516 12)5)273.17± 22.5 308.25± 18.151)307.17± 16.193)0.003 56± 0.000 202 0.003 55± 0.000 206 0.003 06± 0.000 195 HE 6 1.012 2± 0.084 7 1.123 7± 0.125 8 1.249 4± 0.207 94)6)274± 23.58 295± 28.71 327.4± 48.424)0.003 71± 0.000 377 0.003 84± 0.000 579 0.003 90± 0.000 9606)
2)心肌组织病理学。
心肌组织切片经过HE染色,参照Rezkalla等[6]的方法计算心肌病理组织学积分。结果见图1、表3。
研究发现正常(C)组大鼠心肌细胞形态正常,细胞横纹清晰,胞浆嗜酸性染色,胞核完整,肌原纤维排列整齐,纤维互联呈网状,间质细胞正常,无病理改变。
随运动周期的增加,从第2周末开始,E组大鼠心肌开始呈现变形性坏死,肌原纤维扭曲,并呈现波浪状样改变。大鼠心肌炎症程度和病理损伤程度随运动负荷递增不断加深,6周末E组大鼠心肌细胞炎性浸润表现最为明显,心肌组织可见大量浸润炎症细胞,肌原纤维肿胀、扭曲变样,并有散在性的局灶性坏死区,部分融合成片(黑色箭头所示)。
而LE组大鼠心肌相较同时期的E组大鼠心肌细胞炎性表达相对较轻,但至6周末,心肌细胞内仍然存在条索状的细胞核聚集现象。HE组大鼠心肌细胞炎性细胞浸润现象与同期E组比,有轻微改善,但仍可见大量炎性细胞浸润,心肌纤维断裂,坏死病变广泛。低、高强度的激光治疗都可在一定程度上改善同时期大鼠心肌细胞损伤病变,但尚不能完全逆转由递增跑台运动所致的炎性浸润现象(见图1)。
其病理程度评分见表3,运动组(E)心肌炎症表达在2周末时较轻,但4周末时心肌的炎症因子表达面积已超过25%,评分大于1,到了6周末心肌炎症病变面积增加到50%左右,病理积分达2.93±0.56(P<0.01),说明随运动负荷和训练期限的增加,心肌炎性变化不断累积。但是LE和HE组的心肌病变程度比同一阶段(4周、6周)的E组轻(P<0.01),且LE组心肌病理积分明显低于HE组(P<0.01)。

图1 大鼠心肌组织病理切片(HE染色40×10)
表3 大鼠心肌病理积分(±s)

表3 大鼠心肌病理积分(±s)
时间点 E组 LE组 HE组2周末 0.52±0.22 0.43±0.18 0.48±0.13 4周末 1.17±0.231) 1.01±0.271) 1.14±0.271)6周末 2.93±0.562)3) 2.01±0.262)3)4) 2.45±0.412)3)5)6)
1)2周与4周比较,P<0.01;2)4周与6周比较,P<0.01;3)2周与6周比较,P<0.01;4)E组与LE组比较,P<0.01;5)LE与HE组比较,P<0.01;6)E组与HE组比较, P<0.01
3)细胞因子TNF-α。
从两者的变化趋势上看,随着运动强度和训练期限的增加,E组的TNF-α表达量在4周末时上升至最高(P<0.01),却在6周末时稍微回落。不同时间段(2、4、6周)LE组的TNF-α表达量均低于E和HE组。但LE和HE组,随着运动时间的延长,TNF-α的表达量在4周末时升至最高(P<0.01),6周末时稍微降低,但仍与2周末时存在非常显著性差异(P<0.01)(见表4)。
表4 大鼠TNF-α的变化(±s)
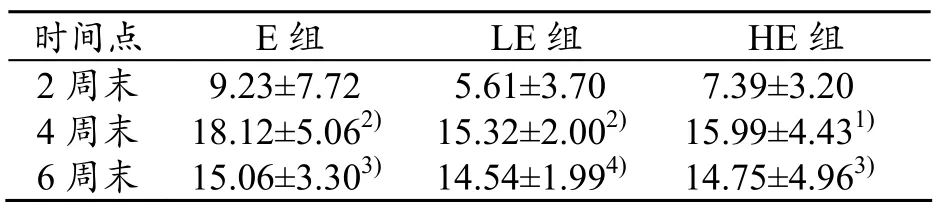
表4 大鼠TNF-α的变化(±s)
1)2周与4周组比较, P<0.05;2)2周与4周比较,P<0.01;3)2周与6周组比较,P<0.05,4)2周与6周比较,P<0.01
时间点 E组 LE组 HE组2周末 9.23±7.72 5.61±3.70 7.39±3.20 4周末 18.12±5.062)15.32±2.002)15.99±4.431)6周末 15.06±3.303)14.54±1.994) 14.75±4.963)
4)心肌CD8+T细胞。
从图2看出,E组大鼠心肌组织中可见棕黄色的CD8+T淋巴细胞,且多分布于变性坏死的心肌细胞周围,6周末E组心肌组织中仍可见大量颜色较深的黄色颗粒呈团簇状分布((22.81±5.07)%,P<0.01),提示CD8+T细胞浸润明显增多,心脏损伤严重。
LE组大鼠心肌组织中CD8+T淋巴细胞阳性表达量从2周末开始逐渐增加,但较同时期的E组(2、4、6周)而言,阳性表达量明显较低(P<0.01)。而相对于HE组,同周期的CD8+T淋巴细胞的阳性表达量基本与LE组持平,却又低于E组(P<0.01),说明两种强度的激光治疗都可减缓心肌组织炎性表达(见表5)。
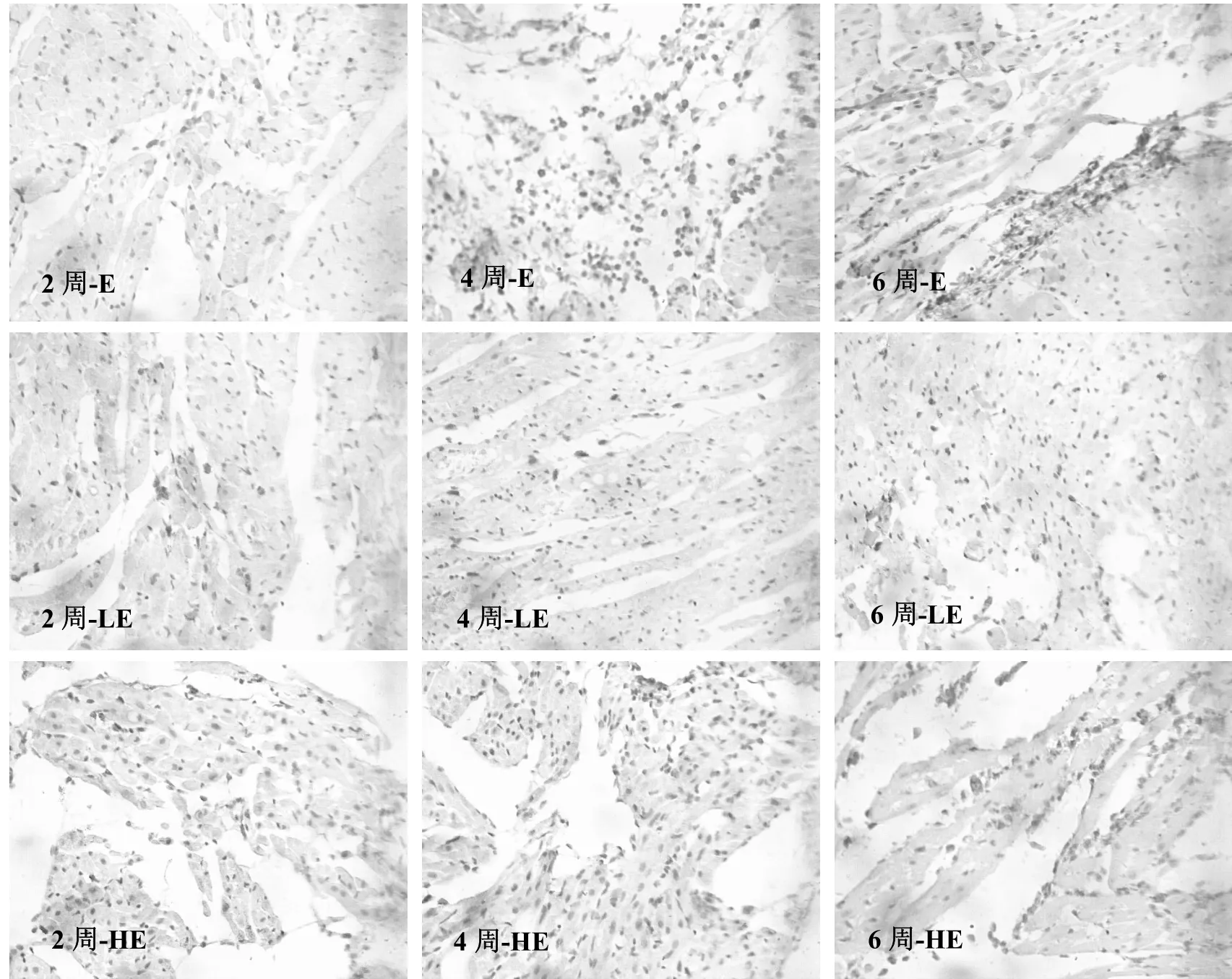
图2 大鼠心肌CD8+T淋巴细胞免疫组化染色(40×10)
表5 大鼠CD8+ T淋巴细胞百分率(±s) %

表5 大鼠CD8+ T淋巴细胞百分率(±s) %
时间点 E组 LE组 HE组2周末 5.43±1.08 2.61±0.604) 3.15±0.47 4周末 13.03±2.031) 4.15±0.694) 6.55±1.401)5)7)6周末 22.81±5.072)3) 10.75±1.872)3)4) 15.32±2.012)3)4)6)7)
1)2周与4周组比较, P<0.01;2)4周与6周组比较, P<0.01;3)2周与6周组比较, P<0.01;4)E组与LE组比较, P<0.01;5)LE组与HE组比较,P<0.05,6)LE组与HE组比较,P<0.01;7)E组与HE组比较,P<0.01
5)心肌细胞凋亡率。
运用TUNEL法进行原位末端标记与光镜下观察,同时参照Nsrula计算公式,计算出阳性细胞表达量(见表6)。结果显示随运动强度和期限增加,E组大鼠的心肌细胞凋亡率逐渐增加,尤其是到了6周末,表现最为严重((52.12±7.14)%,P<0.01),细胞排列杂乱无序,胞核破裂溢出,凋亡细胞出现明显的核浓缩及破裂现象,呈现阳性深褐色着染。
LE组心肌细胞凋亡率相与同期的E组(4、6周末)比较,相对较小(P<0.01),但随运动强度增加心肌凋亡率亦增大,表现为心肌细胞排列相对松散,单阳性细胞着色相对于运动组较浅。HE组大鼠心肌细胞凋亡率随运动强度增加而逐渐增加,相对于E组轻,但高于LE组(6周末时,P<0.01),提示两种强度激光照射均可抑制心肌细胞凋亡,但HE组抑制心肌细胞凋亡的效果次于LE组。
表6 大鼠心肌细胞凋亡率(±s) %
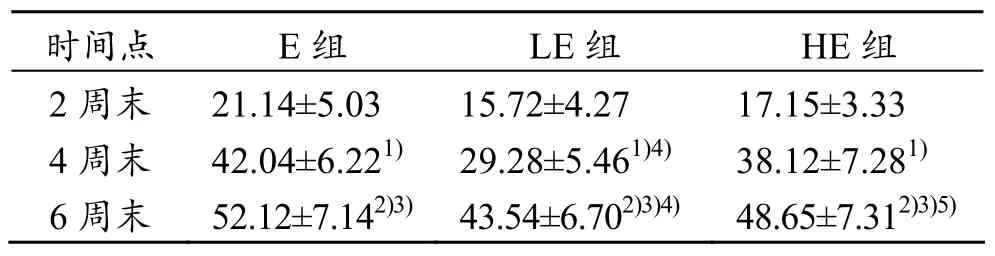
表6 大鼠心肌细胞凋亡率(±s) %
1)2周与4周组比较,P<0.01;2)4周与6周组比较,P<0.01;3)2周与6周组比较,P<0.01;4)E组与LE比较, P<0.01;5)LE与HE组比较, P<0.01
时间点 E组 LE组 HE组2周末 21.14±5.03 15.72±4.27 17.15±3.33 4周末 42.04±6.221) 29.28±5.461)4) 38.12±7.281)6周末 52.12±7.142)3)43.54±6.702)3)4) 48.65±7.312)3)5)
3 讨论
研究指出,过度运动负荷或过度训练可使心肌细胞排列紊乱,甚至部分断裂,导致收缩力下降[7]。动物实验也表明,不同强度耐力训练的大鼠心肌细胞表现出不同程度的凋亡现象,尤其是持续的大强度运动训练可使心肌细胞产生不可逆的病理性改变[8]。本实验发现,随着运动负荷的逐渐增加和训练期限的延长,大鼠心肌纤维断裂、肿胀,炎性因子TNF-α表达,及心肌细胞凋亡也逐渐增多,说明长期大负荷递增运动可导致心肌炎性细胞浸润,诱发炎症性损伤。炎症细胞可释放各种细胞因子,通过不同的促炎及抗炎途径调节心肌组织对各种应激因素的应答反应。本研究观察了CD8+T淋巴细胞以及细胞因子TNF-α在长期递增负荷运动诱导的心肌损伤中的作用,分析运动性心肌损伤的免疫调节机制。
TNF-α是细胞因子网络中的关键成分,过量的TNF-α可介导免疫损伤及一些严重的病理生理过程。TNF-α主要由心肌单核-巨噬细胞及心肌细胞产生,心脏既是TNF-α的产生场所,同时也是其作用的靶器官,可参与多种心脏疾病的发生发展过程,且心肌产生的TNF-α足以造成严重的心肌疾病[9]。本研究发现6周递增负荷运动过程中,TNF-α表达呈增加趋势,4周时达最高。结合同时期的心肌病理学变化,提示TNF-α参与了递增负荷运动过程中心肌的炎症反应,在其发生发展过程中发挥着重要作用。6周递增负荷运动,由于运动负荷的不断增加导致大鼠心肌组织内炎症累积,进而产生相应的病理性改变。TNF-α作为一种炎症前细胞因子,其升高可激活淋巴细胞增殖分裂,活化巨噬细胞、趋化各种炎性细胞,如调节IL-1 和IL-6等的表达,进而促进中性粒细胞在心肌内的黏附、聚集,并释放可溶性介质,导致心肌微血管的阻塞和心肌损伤不断加重[10-11]。综上所述,组织内免疫细胞因子TNF-α的升高,不仅抑制心肌细胞正常的生理功能,还可导致心肌细胞出现自身损害加重、心脏重构等病理性变化。
本研究采取激光照射作为大强度递增负荷运动心肌炎性损伤的干预手段,选取鼻翼两侧激光照射的处理方式,因鼻腔内血管相对丰富,鼻黏膜下层有多支血管构成网状血管层,且鼻黏膜和鼻腔内的小血管壁都较薄弱,因此激光较易穿透组织而作用于血细胞,以达到治疗的目的。既往研究均证实低强度激光(Low-level laser therapy,LLLT)在调节炎症反应、减缓疼痛、抑制深层组织损伤等方面都具有良好疗效[12],且运动后激光照射可以减轻运动所致的肌肉损伤及炎症反应[13]。结合本研究发现,激光照射组(LE和HE)大鼠血清中TNF-α相较同时期的E组减少,而此时心肌内的炎症细胞表达亦减少,心肌病理积分相对E组降低,说明心肌组织由坏死后炎症反应逐渐转变为心肌组织的修复,提示激光治疗可在心肌损伤的缓解、修复和改善中发挥重要作用。本研究也与大部分临床心血管疾病研究结果一致,证明低强度激光治疗可减轻机体的炎症反应,减少炎症细胞浸润及炎症因子的表达量,达到保护心肌的目的[14],其机制可能是激光束发射的近红外光子可增加ROS表达和NO释放量,激活转录因子如NF-κB信号通路,促进细胞存活、增殖和迁移[15-16];相反高强度激光却具有一定的抑制效应[17]。
Nishimura[18]研究发现,CD8+T细胞在组织炎症发生发展过程中起重要作用,可通过分泌趋化因子,激活巨噬细胞引起炎症,诱导MHC-I类分子表达,这可能是心肌成纤维细胞表型发生转变的始动环节,激活免疫应激反应,最终诱导心肌朝着纤维化的方向发展。本研究发现CD8+T淋巴细胞在正常大鼠心肌组织内不表达或低表达状态[19],但随运动负荷递增,CD8+T淋巴细胞在心肌组织中表达量明显升高。Khan[20]指出心肌炎症的发展进程及严重程度均取决于T细胞介导的细胞免疫反应,TH细胞在炎症反应中发挥重要调控作用,即CD8+T细胞在心肌炎时浸润增加,参与心肌细胞损伤过程并作用于心肌炎的发展。同时CD8+T淋巴细胞可通过TNF-α的过度表达,诱导胶原含量增加,干预心肌纤维化进程,同时TNF-α也是细胞凋亡家族的重要成员[21]。结合本研究CD8+T淋巴细胞在各组的变化趋势(见表6),我们认为递增负荷运动可刺激CD8+T淋巴细胞促进心肌的巨噬细胞浸润和活化,增强促炎性因子和趋炎性因子(如TNF-α)的表达,进而加重心肌的炎症进程。与之相关的研究表明,6周递增负荷运动,运动组大鼠胸腺的CD8+T淋巴细胞在2、4、6周中均明显高于对照组[22],推测可能是运动后抑制性T细胞被激活,以控制抗原暴露所致的自身免疫损伤;但抑制性T细胞过度激活却又影响其他亚型T细胞功能,导致训练后免疫抑制;而过度训练也使抑制性巨噬细胞增多,提高抑制性T细胞功能,进一步加剧训练后的免疫抑制[23]。结合本研究结果,推测递增负荷运动致使心肌承受的应力负荷增加,心肌内炎症反应累积,在此基础上激活了CD8+T淋巴细胞的效应,炎性因子TNF-α的表达增加,心肌病理损伤加重。但低强度激光却通过下调CD8+T淋巴细胞及TNF-α的炎性表达,延缓心肌内的炎症发展进程,以达到改善心肌的目的。
作为生命过程的一种生理现象,细胞凋亡和增殖都是生命的正常现象,以维持内环境稳态。Phaneuf等[24]研究认为运动导致细胞凋亡属于正常的机体调节过程,通过排斥部分无不良反应的破坏细胞,以保证组织处在最佳的机能状态。而研究运动对心肌和骨骼肌细胞凋亡的关系时发现,不管是短时间还是长时间的运动都会导致肌细胞损伤[25]。如常芸[8]、张钧[26]和金其贯[27]等,研究不同强度耐力训练、力竭运动或超负荷运动后大鼠心肌细胞凋亡情况,发现过度训练可导致大鼠心肌细胞凋亡增加,提示心肌细胞凋亡参与由超负荷运动所致的心脏病理性失代偿的转变过程,导致运动性心脏损伤。本研究结果显示,6周递增负荷运动过程中,随运动负荷强度递增,大鼠心肌细胞凋亡发生率逐渐增加,而激光组心肌细胞凋亡明显少于同时期运动组,提示低强度激光可作为对抗心肌细胞凋亡的重要调控方式。DE等[28]研究指出,激光在对抗炎症反应过程中表现为双刃剑的剂量依赖性关系,这就意味着中等强度激光在“治疗窗”会激发照射部位产生生物学反应;而超出此范围则不能产生任何效应。本研究中,LE组心肌细胞凋亡率明显低于HE组也恰与此结论一致。
低强度激光具有安全、有效、易操作和可实施性强等特点。本研究在运动医学领域及其他临床医学领域的研究均证实,低强度激光可作为抵抗心血管疾病的抗炎症损伤、减轻疼痛、促进细胞增殖的有效手段。
参考文献:
[1] HUANG C J,WEBB H E,ZOURDOS M C,et al. Cardiovascular reactivity,stress,and physical activity[J]. Front Physiol,2013(7)4:314.
[2] LANCEL S,PETILLOT P,FAVORY R,et al. Expression of apoptosis regulatory factors during myocardial dysfunction in endotoxemic rats[J]. Crit Care Med,2005,33(3):492-496.
[3] LANCASTER G I,FEBBRAIO M A. The immunomodulating role of exercise in metabolic disease[J]. Trends Immunol,2014,35(6):262-269.
[4] VALE F A,MOREIRA M S,DE ALMEIDA F C,et al. Low-level laser therapy in the treatment of recur-
rent aphthous ulcers:a systematic review[J]. Scientific World Journal,2015:150412.
[5] FARIVAR S,MALEKSHAHABI T,SHIARI R. Biological effects of low level laser therapy[J]. J Lasers Med Sci,2014,5(2):58-62.
[6] 覃飞,张馨蕾,阮洋,等. 低强度激光和有氧运动对大鼠围绝经期骨结构和骨代谢的影响[J]. 体育学刊,2013,20(6):126-132.
[7] 常芸. 运动性心律失常研究现状与展望[J]. 中国运动医学杂志,2015,34(1):59-68.
[8] 常芸,袁箭锋,祁永梅,等. 运动心脏重塑与微损伤发生中的细胞凋亡现象[J]. 中国运动医学杂志,2003,22(4):344-349.
[9] HILGENDORFF A,MUTH H,PARVIZ B,et al. Statins differ in their ability to block NF-kappaB activation in human blood monocytes[J]. Int J Clin Pharmacol Ther,2003,41(9):397-401.
[10] FRANGOGIANNIS N G,SMITH C W,ENTMAN M L. The inflammatory response in myocardial infarction [J]. Cardiovasc Res,2002,53(1):31-47.
[11] GUREVITCH J,FROLKIS I,YUHAS Y,et al. Anti-tumor necrosis factor-alpha improves myocardial recovery after ischemia and reperfusion[J]. J Am Coll Cardiol,1997,30(6):1554-1561.
[12] HAMBLIN M R. Introduction to experimental and clinical studies using low-level laser (light) therapy (LLLT)[J]. Lasers Surg Med,2010,42(6):447-449. [13] DE ALMEIDA P,LOPES-MARTINS R Á,TOMAZONI S S,et al. Low-level laser therapy improves skeletal muscle performance,decreases skeletal muscle damage and modulates mRNA expression of COX-1 and COX-2 in a dose-dependent manner[J]. Photochem Photobiol,2011,87(5):1159-1163.
[14] YANG Z,WU Y,ZHANG H,et al. Low-level laser irradiation alters cardiac cytokine expression following acute myocardial infarction:a potential mechanism for laser therapy[J]. Photomed Laser,2011,29:391-398.
[15] AVCI P,NYAME T T,GUPTA G K,et al. Low-level laser therapy for fat layer reduction:a comprehensive review[J]. Lasers Surg Med,2013,45(6):349-357.
[16] MANCHINI M T,SERRA A J,FELICIANO R,et al. Amelioration of cardiac function and activation of anti-inflammatory vasoactive peptides expression in the rat myocardium by low level laser therapy[J]. PLoSOne,2014,9(7):e101270.
[17] WANG L,HU L,GRYGORCZYK R,et al. Modulation of extracellular ATP content of mast cells and DRG neurons by irradiation:studies on underlying mechanism of low-level-laser therapy[J]. Mediators Inflamm,2015:630361.
[18] NISHIMURA S,MANABE I,NAGASAKI M,et al. CD8+effector T cells contribute to macrophage recuriment and adipose tissue inflammation in obesity[J]. Nat Med,2009,15:914-920.
[19] CALDERÓN J,MAGANTO-GARCIA E,PUNZÓN C,et al. The receptor slamf1 on the surface of myeloid lineage cells controls susceptibility to infection by Trypanosoma cruzi[J]. PLoS Pathog,2012,8(7):e1002799.
[20] KHAN I M,DAI PERRARD XY,PERRARD J L,et al. Attenuated adipose tissue and skeletal muscle inflammation in obese mice with combined CD4+and CD8+T cell deficiency[J]. Atherosclerosis,2014,233(2):419-428.
[21] LI Y Y,FENG Y Q,KADOKAMI T,et al. Myocardial extracellular matrix remodeling in transgenic mice overexpressing tumor necrosis factor alpha can be modulated by anti-tumor necrosis factor alpha therapy [J]. Proc Natl Acad Sci U S A,2000,97(23):12746-12751.
[22] 胡晓燕,郝选明. 补充黄芪多糖对递增负荷训练大鼠免疫指标的影响[J]. 武汉体育学院学报,2012,46(2):59-62.
[23] GOH J,NIKSIRAT N,CAMPBELL K L. Exercise training and immune crosstalk in breast cancer microenvironment: exploring the paradigms of exercise-induced immune modulation and exercise-induced myokines[J]. Am J Transl Res,2014,11,6(5):422-438.
[24] PHANEUF S,LEEUWENBURGH C. Apoptosis and exercise[J]. Med Sci Sports Exerc,2001,33(3):393-396.
[25] POLLACK M,PHANEUF S,DIRKS A,et al. The role of apoptosis in the normal aging brain,skeletal muscle,and heart[J]. Ann N Y Acad Sci,2002,959:93-107.
[26] 张钧,许豪文,杨小英,等. 运动对心肌细胞凋亡的影响[J]. 体育科学,2002,22(5):92-94.
[27] 金其贯,邓荣华,李宁川,等. 过度训练对大鼠心肌细胞凋亡的影响[J]. 中国运动医学杂志,2000,19(4):356-358.
[28] DE OLIVEIRA A R,VANIN A A,DE MARCHI T,et al. What is the ideal dose and power output of low-level laser therapy (810 nm) on muscle performance and post-exercise recovery? Study protocol for a double-blind,randomized,placebo-controlled trial[J]. Trials,2014,27(15):69.
Effects of laser of different intensities on the myocardial inflammatory injury and CD8+T lymphocyte expression of rats exercising with an incremental load
MA Xiao-ge,WANG Song-tao,QIN Fei,GONG Wen-wu
(School of Physical Education,South China Normal University,Guangzhou 510006,China)
Abstract:In order to observe the changing of and relationship between the myocardial inflammatory injury and CD8+T lymphocyte expression of rats exercising with an incremental load, and to probe into the function of laser therapy of different intensities on protecting a heat undergoing a high intensity exercise, the authors divided 8-week old male SD rats randomly into a control group (C) consisting of 54 rats, and an experiment group consisting of 54 rats, including a low intensity laser + exercise group (LE), a high intensity laser + exercise group (HE), and an exercise group (E), each of which consisted of 18 rats, sampled the rats in the groups in weeks 2, 4 and 6 respectively, evaluated their heart coefficients, overall heart shapes, myocardial pathological scores, apoptosis of myocardial CD8+T lymphocytes and cardiocytes, and revealed the following findings: as compared with the rats in group C, the rats in group E in week 6 showed significant cardiocytes inflammatory infiltrating, myocardial fibers twisting, swelling and rupturing, a significantly different pathological score (P<0.01), increased serum TNF-α, myocardial CD8+T lymphocytes filtrating, and a very significantly increased cardiocyte apoptosis index; as compared with the rats in group E in the same period (week 2, 4 or 6), the rats in group LE had slightly lighter myocardial inflammation; in week 6, the numbers of apoptosis of CD8+T lymphocytes and cardiocytes increased as compared with those of the rats in group C, yet decreased significantly as compared with those of the rats in group E (P<0.01). The saidbook=138,ebook=143findings indicate that laser therapy can, to a certain extent, alleviate myocardial inflammatory infiltration and inflammatory factors, reduce the degree of myocardial pathology, and restrain the process of apoptosis of cardiocytes.
Key words:sports medicine;myocardial inflammatory injury;exercising with an incremental load;low intensity laser;CD8+T lymphocyte;rats
作者简介:麻晓鸽(1984-),女,博士研究生,研究方向:运动与心血管健康。E-mail:mxg84@163.com 通讯作者:王松涛教授。
基金项目:广东省体育局2014年科研项目(GDSS2014181);华南师范大学2014年研究生创新基金(2014bsxm03)。
收稿日期:2015-08-20
中图分类号:G804.5
文献标志码:A
文章编号:1006-7116(2016)03-0137-08
