PCNA、Survivin蛋白在人绒癌细胞株BeWo合体化过程中表达变化的研究
2016-05-31易莉莎林耀华张国正
易莉莎,林耀华,张国正
·论著·
PCNA、Survivin蛋白在人绒癌细胞株BeWo合体化过程中表达变化的研究
易莉莎,林耀华,张国正
【摘要】目的:通过检测人绒癌细胞株BeWo合体化过程中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、生存素(Survivin)蛋白表达的变化,探讨滋养细胞合体化后增殖性的变化,为恶性滋养细胞肿瘤,尤其是耐药恶性滋养细胞肿瘤的临床治疗提供新的思路和方法。方法:利用毛喉素(forskolin)诱导BeWo细胞株融合;应用逆转录聚合酶链反应(RT-PCR)检测促融素(Syncytin)在forskolin作用不同时间的BeWo细胞株中的表达;应用蛋白质印迹(Western blotting)检测PCNA、Survivin蛋白在forskolin作用不同时间的BeWo细胞株中的表达;应用噻唑蓝比色分析实验(MTT)法检测forskolin作用不同时间的绒癌细胞株BeWo的增殖能力。结果:①forskolin作用后的BeWo细胞株Syncytin基因的表达增强,且随着forskolin作用时间的延长,Syncytin的表达更强,于48 h达到高峰。②forskolin作用后的BeWo细胞株PCNA、Survivin蛋白的表达降低。③forskolin作用后的BeWo细胞株的增殖能力下降,且不同作用时间的差异有统计学意义;forskolin作用的时间越长,BeWo细胞株增殖能力下降越明显。结论:人绒癌细胞株BeWo合体化后PCNA、Survivin蛋白的表达降低,说明人绒癌细胞株BeWo合体化后增殖性降低,推测诱导滋养细胞合体化可能对临床治疗恶性滋养细胞肿瘤具有一定作用。
【关键词】增殖细胞核抗原;微管相关蛋白质类;福司柯林;细胞融合
(J Int Reprod Health/Fam Plan,2016,35:9-12)
妊娠滋养细胞肿瘤(gestational trophoblastic tumor,GTT)是由妊娠滋养细胞异常发育及增殖所致的与妊娠相关的肿瘤。中国位于该病的高发地区,葡萄胎在中国的发病率为0.8‰~1.0‰,该病已经成为严重威胁中国育龄妇女生命健康的恶性疾病之一[1]。GTT对化疗十分敏感,早期GTT患者治愈率高达90%以上,但晚期及耐药患者的治愈率仅为30%~40%,故解决GTT耐药复发问题已经成为该病的研究重点[2]。细胞融合是指在外力(诱导剂或促融剂)作用下,两个或两个以上的异源(种、属间)细胞或原生质体相互接触,从而发生膜融合、胞质融合和核融合并形成杂种细胞的现象。细胞滋养细胞通过增殖、分化,最终融合形成合体滋养细胞。细胞滋养细胞合体化过程中细胞滋养细胞分化到一定阶段出现可逆的凋亡早期事件。本研究基于以上理论,意在通过研究人绒癌细胞株BeWo合体化后增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及生存素(Survivin)蛋白的表达变化,初步探讨滋养细胞合体化与恶性滋养细胞肿瘤耐药的关系,为临床恶性滋养细胞肿瘤治疗提供新的思路及方法。
1 材料与方法
1.1材料人绒癌细胞株BeWo(北京协和医科大学基础细胞库),Ham′s F12培养基(Gibco公司),胎牛血清(四季青生物公司),毛喉素(forskolin)由华诚生物技术有限公司惠赠,鼠抗人Survivin多克隆抗体(美国Santa Cruze公司),兔抗人PCNA多克隆抗体(北京博奥森生物技术公司),PCR mix和逆转录试剂盒(Fermantas MBI公司),促融素(Syncytin)引物(北京三博远志生物技术有限责任公司)。
1.2方法
1.2.1细胞培养和处理BeWo细胞株用含15%胎牛血清的Ham′s F12培养基在37℃、5% CO2中培养。细胞贴壁生长,0.125%胰酶和0.01%乙二胺四乙酸(EDTA)消化传代。取指数生长期的BeWo细胞(约占培养皿的70%~80%),分为4组,用终浓度为100 mmol/L forskolin分别作用0,24,48,72 h,其中作用0 h组为空白对照。
1.2.2逆转录聚合酶链反应(RT-PCR)检测Syncytin基因的表达常规消化并收集细胞,按总RNA提取试剂盒fast200说明提取总RNA,再按照逆转录试剂盒说明将总RNA逆转录成cDNA。之后按PCR mix试剂盒说明进行PCR扩增。以β-actin作为内参,引物序列见表1。RT-PCR反应条件为94℃预变性5 min,94℃变性30 s,57℃退火45 s,72℃延伸45 s,30个循环,最后72℃延伸7 min。各扩增产物经2%琼脂糖凝胶电泳,采用BandScan分析软件分析电泳结果。
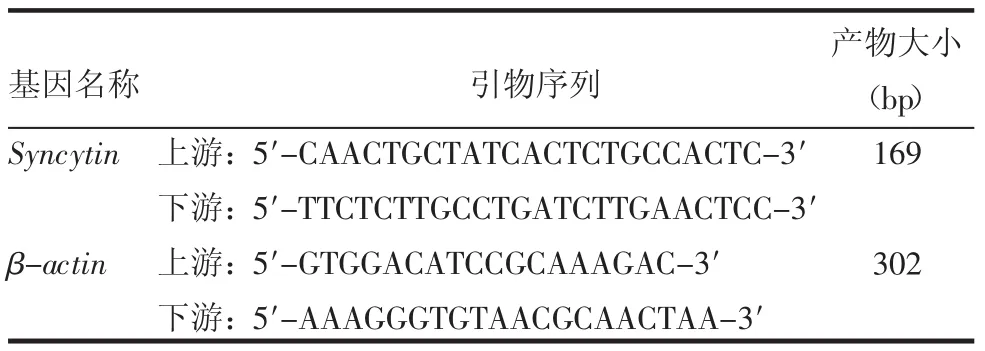
表1 基因的引物序列
1.2.3蛋白质印迹(Western blotting)检测forskolin作用不同时间的BeWo细胞株中Survivin蛋白及PCNA蛋白的表达蛋白质提取:常规消化、传代细胞。当细胞增长至80%时,各培养皿更换含100 mmol/L forskolin的培养基,分别作用0,24,48,72 h。吸净培养基,4℃磷酸盐缓冲液(PBS)洗细胞3次,将PBS吸净,加入Triple裂解缓冲液200 μL,将裂解物转移至2.5 mL离心管,充分混匀后离心,将上清液吸出,留待蛋白定量和实验。
十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳和免疫印迹:采用Bradford法测定蛋白质浓度,以30 μg/孔上样,在12%(体积分数)的SDS-PAGE凝胶中进行电泳分离,电转移法23 V 12 h将蛋白从SDS-PAGE凝胶转移至醋酸纤维素膜,在含0.5 g/L脱脂奶粉的TBST中37℃封闭1 h,分别加入一抗(鼠抗人Survivin多克隆抗体,稀释度为1∶200或兔抗人PCNA多克隆抗体,稀释度为1∶200),4℃孵育过夜,TBST充分漂洗(3 min×6次),加入二抗(辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG,稀释度1∶2 000),37℃作用1 h,TBST充分漂洗(3 min×6次),二氨基联苯胺(DAB)显色,观察结果。数据分析采用凝胶成像系统。
1.2.4噻唑蓝比色分析实验(MTT)检测forskolin作用不同时间的BeWo细胞株的增殖情况常规消化细胞,吹打均匀,调整细胞浓度为106个/L~107个/L,取上述细胞悬液200 μL接种于96孔培养板中培养。该实验分为实验组和对照组。当细胞增长至80%时,取出96孔板,更换培养基,实验组用含100 mmol/L forskolin的培养基继续培养24,48,72 h,对照组用不含forskolim的培养基继续培养24,48,72 h。加入5 mg/L的MTT 20 μL,继续培养4 h,倒出培养液,加入150 μL二甲基亚砜振荡溶解10 min。空白对照调零,酶联免疫检测仪检测波长为490 nm时各孔的吸光度值(A值)。该实验过程中每组各设8个复孔,重复6次。
1.3统计学方法每组实验至少重复3次以上,电泳图谱扫描图像用BandScan软件进行灰度分析。实验数据应用SPSS 13.0统计软件进行处理,定量资料正态分布的数据用均数±标准差(±s)表示,两组间比较采用重复测量方差分析,2组各时间点比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1检测forskolin作用不同时间的BeWo细胞株中Syncytin基因的表达forskolin作用后的BeWo细胞株Syncytin基因的表达增强,且随着forskolin作用时间的延长,Syncytin的表达增强,于48 h达到高峰,见图1。
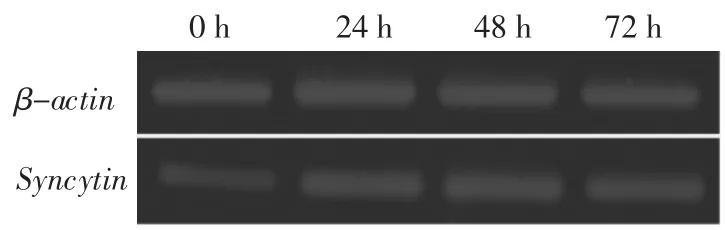
图1 forskolin作用不同时间的BeWo细胞株中Syncytin基因的表达
2.2forskolin作用不同时间的BeWo细胞株中Survivin蛋白及PCNA蛋白的表达
2.2.1Survivin蛋白的表达forskolin作用后的BeWo细胞株Survivin蛋白的表达下降,且随着forskolin作用时间的延长,其表达Survivin蛋白减弱,见图2。
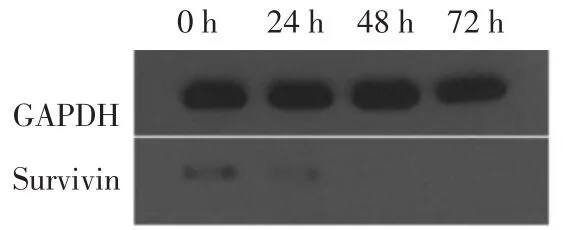
图2 forskolin作用不同时间的BeWo细胞株中Survivin蛋白的表达
2.2.2 PCNA蛋白的表达forskolin作用后的BeWo细胞株PCNA蛋白的表达下降,且随着forskolin作用时间的延长,其表达PCNA蛋白降低,见图3。
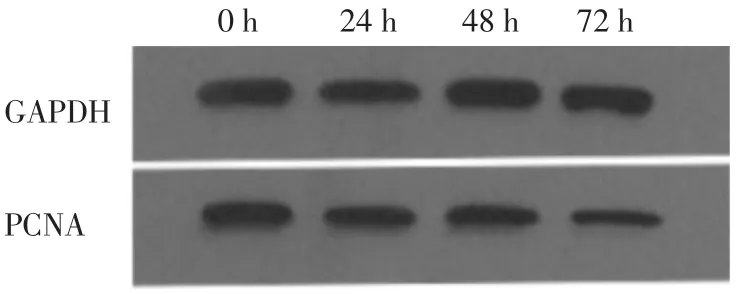
图3 forskolin作用不同时间的BeWo细胞株中PCNA蛋白的表达
2.3MTT检测forskolin作用不同时间的BeWo细胞株的增殖能力forskolin处理后的BeWo细胞株的增殖能力下降,差异有统计学意义(均P<0.05)。随着forskolin作用时间延长,BeWo细胞株增殖能力下降越明显(F时间=7.642,P=0.001;F组别=5.702,P=0.021;F交互=1.301,P=0.611),见表2。

表2 forskolin作用不同时间的BeWo细胞株的增殖情况
3 讨论
GTT是一类来源于胎盘妊娠滋养细胞的常见妇科恶性肿瘤,好发于生育年龄妇女,其发病率存在明显的地区差异。在北美洲,葡萄胎妊娠的发生率为0.6‰~1.1‰,而在东南亚国家及犹太人种族葡萄胎妊娠的发生率比北美及欧洲高7~10倍。由于中国庞大的妊娠妇女基数,使GTT成为严重威胁中国育龄妇女生命健康的恶性疾病之一。GTT亦是人体内能用化疗药物完全治愈的实体肿瘤之一。据报道,无转移和低危转移的滋养细胞肿瘤患者的治愈率几乎达100%。复发、晚期和耐药病例是GTT治疗的难点,也是患者的主要死因,约占死亡原因70%,故解决GTT耐药、复发的问题已经成为该肿瘤的研究重点。
3.1细胞融合细胞融合在细胞生物界中是非常少见的现象。在人体组织中存在3种典型的合胞体组织,即合体滋养细胞层、横纹肌纤维、软骨或破骨细胞。晶状体纤维可能也具有融合活性。细胞合体化是一种特殊的分化途径,在生物体的正常生长、发育过程中起了非常重要的作用。在正常妊娠过程中,胎盘绒毛组织中细胞滋养细胞通过增殖、分化,最终融合形成合体滋养细胞,在胎盘正常结构的形成和维持胎儿正常生长、发育等方面起了重要作用。目前关于滋养细胞合体化的具体机制尚不明了。有研究认为这可能与滋养细胞特异性表达的一种膜糖蛋白Syncytin有关。
Syncytin是人类内源性逆转录病毒基因HERVWE1编码的膜糖蛋白,由538个氨基酸组成的,具有促进细胞融合的作用。Blond等[3]将表达HERV-W Env的质粒转染亲代的TE671细胞(人成神经管细胞瘤细胞系),使之暂时表达HERV-W Env,1~2 d后发现可导致大量的多核巨细胞和合胞体形成,表明Syncytin可介导细胞的融合。Syncytin的表达受到多种因素的影响。有资料显示,低氧、超氧化物岐化酶(superoxide dismutase-1,SOD-1)可以抑制Syncytin的表达,而粒细胞-巨噬细胞刺激因子、表皮生长因子、forskolin、环磷酸腺苷(cAMP)、地塞米松、雌激素、人绒毛膜促性腺激素(hCG)、胶质细胞缺失因子1(GCM-1)等可以诱导Syncytin的表达[4]。forskolin是一种常用的腺苷酸环化酶激活剂,其可以通透细胞,激活腺苷酸环化酶,引起细胞内cAMP水平的升高,诱导Syncytin的表达。国内外许多研究证实forskolin可以通过诱导Syncytin的表达促进细胞的融合。Borges等[5]应用细胞质荧光标记方法来观察forskolin诱导绒癌细胞株BeWo融合,结果发现两种不同细胞质荧光染料标记的细胞在forskolin作用下共同培养一段时间后同一细胞的细胞质中出现了两种不同的荧光,说明forskolin可以诱导BeWo细胞株融合,且于forskolin作用48 h达到高峰。本研究应用RT-PCR检测了forskolin作用不同时间后BeWo细胞株中Syncytin mRNA的表达,结果发现Syncytin在forskolin处理后的细胞中表达增强,且随着forskolin作用时间的延长,其表达增强,并于48 h达到高峰,证实了forskolin可以诱导Syncytin基因的表达。
3.2细胞融合与细胞增殖妊娠滋养细胞包括细胞滋养细胞和合体滋养细胞两种。细胞滋养细胞是一种具有增殖能力的细胞,其可以通过增殖、分化,最终融合形成合体滋养细胞。细胞滋养细胞融合形成合体滋养细胞后在形态和生化等方面发生了特征性的改变。合体滋养细胞是一种多核细胞,处于细胞分化的终末期,已脱离细胞周期,不具有合成、转录相关基因的能力,但能分泌多种激素,如hCG、雌激素、孕激素、人胎盘泌乳素等。Martin等[6]通过亚显微结构和酶组织化学研究,发现合体滋养细胞中出现许多细胞老化现象,如核糖体的丢失、内质网的脱粒、染色质的凝集以及与细胞能量代谢有关的酶的失活。本研究应用MTT检测了forskolin作用不同时间的BeWo细胞株的增殖情况,发现同对照组比较,forskolin处理后的BeWo细胞株的增殖能力下降,且随着forskolin作用时间的延长,其增殖能力下降越明显,说明forskolin诱导融合后的BeWo细胞株增殖能力下降。
PCNA由Miyachi等首次发现,广泛表达于各类组织的增殖细胞中,是一种与细胞周期相关的多肽链,在DNA主链复制、修复,正常细胞周期循环中必不可少,同时也是一种细胞周期调控蛋白,存在于细胞核中,作为DNA聚合酶的辅助蛋白,直接参与细胞增殖过程中DNA复制,其表达水平反映肿瘤细胞增殖情况[7-8]。Survivin由Ambrosini等首次从人类基因组库中分离出来,是迄今已知最强的凋亡抑制蛋白,具有抑制细胞凋亡、促进细胞增殖、参与细胞周期调控、参与并促进血管形成等功能,其主要表达于胚胎和发育的胎儿组织中,在大多数分化成熟的正常成人组织中没有表达[9-10]。Survivin、PCNA蛋白都是与细胞增殖相关的蛋白,其表达下降说明细胞的增殖下降。本研究发现forskolin处理后的BeWo细胞株中Survivin和PCNA蛋白的表达均下降,且随着forskolin作用时间的延长,其表达减弱,进一步说明forskolin诱导融合后的BeWo细胞株的增殖能力下降。
合体滋养细胞是处于分化终末期的细胞,已脱离细胞周期,不再具有细胞增殖的能力。肿瘤的发生是一个多途径、多步骤的过程。原癌基因、癌基因的激活和抑癌基因的失活,扰乱了细胞正常的增殖、分化调控,导致细胞增殖失控。而细胞凋亡的抑制,导致细胞存活期延长,死亡率下降。细胞的过度增殖和细胞凋亡的抑制打破了细胞增殖和凋亡的平衡,破坏了机体内细胞的平衡,导致肿瘤的产生。肿瘤治疗的目的在于杀伤肿瘤细胞。目前临床上治疗肿瘤最常用的方法是放疗和化疗。虽然其治疗肿瘤的机制是多方面的,但近来许多研究发现放疗和化疗均可引起肿瘤细胞凋亡,且可能是肿瘤细胞死亡的主要方式。本研究发现合体化后的BeWo细胞株中参与细胞增殖的PCNA蛋白和抑制细胞凋亡的Survivin蛋白的表达均下降,说明合体化后BeWo细胞株细胞增殖能力降低,细胞凋亡增加,推测细胞合体化可能可以增强滋养细胞肿瘤对化疗药物的敏感性。但关于滋养细胞合体化是否能够改善滋养细胞肿瘤的耐药性及其具体机制有待进一步研究。
参考文献
[1]王慰敏,安瑞芳.葡萄胎的诊治进展[J].实用妇产科杂志,2009,25(5):259-261.
[2]安瑞芳,谢丽,王姝,等.妊娠滋养细胞疾病中各型滋养细胞增殖情况的研究[J].实用妇产科杂志,2008,24(12):720-723.
[3]Blond JL,Lavillette D,Cheynet V,et al. An envelope glycoprotein of the human endogenous retrovirus HERV-W is expressed in the human placenta and fuses cells expressing the type D mammalian retrovirus receptor[J]. J Virol,2000,74(7):3321-3329.
[4]王若红,姚源蓉,谢炳玓,等. Syncytin 1的细胞特异性表达及其转录调控研究[J].中国现代医学杂志,2011,21(35):4363-4366.
[5]Borges M,Bose P,Frank HG,et al. A two -colour fluorescence assay for the measurement of syncytial fusion between trophoblastderived cell lines[J]. Placenta,2003,24(10):959-964.
[6]Martin BJ,Spicer SS. Ultrastructural features of cellular maturation and aging in human trophoblast[J]. J Ultrastruct Res,1973,43(1):133-149.
[7]Strzalka W,Ziemienowicz A. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation [J]. Ann Bot,2011,107(7):1127-1140.
[8]居红格,沈淑萍,耿红,等. P16、P53、PCNA在膀胱癌中的表达及意义[J].包头医学院学报,2009,25(6):12-13.
[9]赵祯,匡安仁.凋亡抑制蛋白Survivin研究进展[J].现代生物医学进展,2012,12(24):4761-4764.
[10]曲贝贝,左金华.凋亡抑制基因Survivin的研究进展[J].中华临床医师杂志,2014,8(15):2842-2846.
[本文编辑王昕]
Expressions of PCNA and Survivin Proteins in BeWo Cells during Syncytial Process
YI Li-sha,LIN Yao-
hua,ZHANG Guo-zheng.
Department of Obstetrics and Gynecology,Guangzhou Women and Children′s Medical Center,Guangzhou 510623,China(YI Li-sha,ZHANG Guo-zheng);Department of Obstetrics and Gynecology,The First Affiliated Hospital of Nanhua University,Hengyang 421001,Hunan Province,China(LIN Yao-hua)
Corresponding author:ZHANG Guo-zheng,E-mail:zhang710923@163.com
【Abstract】Objective:To observe the expression changes of PCNA and Survivin proteins in the choriocarcinoma cell line(BeWo)during its fusion, so as to explore the proliferation change after the fusion of trophoblast cells. The study could be helpful for developing a new therapy of gestational trophoblastic tumor (GTT), especially drug-resistant GTT. Methods:The intercellular fusion of the cultured BeWo cells was induced by forskolin. The expression of Syncytin mRNA in the treated BeWo cells was detected by RT-PCR, and the expressions of PCNA and Survivin proteins were detected by Western blotting. The proliferation of BeWo cells was detected by MTT. Results:①The expression of Syncytin gene in the BeWo cell treated with forskolin was increased with a time-dependent manner, which reached its peak in 48 hours.②The expressions of PCNA and Survivin proteins in BeWo cell after treatment were significantly decreased.③The proliferation of the BeWo cell treated with forskolin was significantly decreased with a time -dependent manner. Conclusions:The lowered expressions of PCNA and Survivin proteins in those fusion choriocarcinoma cells means the lowered proliferation, suggesting that the induced intercellular fusion of trophoblast cells may be helpful to treat those malignant GTT.
【Keywords】Proliferating cell nuclear antigen;Microtubule-associated proteins;Forskolin;Cell fusion
作者单位:510623广州市妇女儿童医疗中心妇产科(易莉莎,张国正);南华大学附属第一医院妇产科(林耀华)
通信作者:张国正,E-mail:zhang710923@163.com
收稿日期:(2015-06-05)
