“物质的检验与鉴别”高考试题分类突破探析
2016-05-30洪云龙
洪云龙


“物质的检验与鉴别”是高考化学实验题中的高频考点,几乎年年必考.为了让高三学生对此知识内容在高考中的考查特点有个完整、系统的认识,笔者在充分研究的基础上,将近几年全国各地高考化学试题进行加工整理、分类突破,希望能对高考复习备战起一些参考与帮助作用.
1.常见离子的检验
例1 (2011年天津卷)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( ).
解析 原溶液滴入BaCl2有白色沉淀,此溶液可能含有SO2-4、CO2-3、SO2-3、Ag+等(相应生成物均是白色沉淀),故A项错误;振荡、静置,CCl4萃取了I2(氯水氧化I-生成I2)分成两层, CCl4在下层且因溶解I2而呈紫色,故B项正确;蘸取溶液进行焰色反应,火焰呈黄色,原溶液一定有Na+,但K+可能有也可能无,故C项错误;滴加稀NaOH溶液后还须加热,若不加热即使原溶液含有NH+4也可能没有NH3生成,不会使试纸变蓝,故D项错误.答案:B
点评 中学阶段常见阳离子的检验有:H+、Fe3+、Fe2+、Al3+、NH+4、Cu2+、Na+、Mg2+、K+、Ag+等,常见阴离子的检验有:OH-、Cl-、Br-、I-、SO2-4、SO2-3、NO-3、CO2-3、HCO-3、AlO-2等,复习时要掌握离子检验的原理、操作、试剂、现象等,还要了解可能有哪些离子对离子检验造成干扰.
2.常见气体的检验和鉴别
例2 (2014年重庆卷)下列实验可实现鉴别目的的是 ( ).
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
解析 SO2、SO3均能与KOH反应,都没有明显现象,A项错误;Br2(g)、NO2都是红棕色气体且有强氧化性,都能氧化KI而生成I2,使淀粉显蓝色,B项错误;偏铝酸的酸性弱于碳酸,CO2通入偏铝酸钠溶液中生成氢氧化铝沉淀,醋酸酸性强于碳酸,CO2通入醋酸钠溶液无现象,C项正确;氯化钡和硝酸银反应生成氯化银沉淀,与硫酸钾反应生成硫酸钡沉淀,现象相同不能鉴别,D项错误.答案:C
点评 中学阶段必须掌握如下气体的检验:可燃气体(如H2、CO、CH4、CH2=CH2、 等)、酸性气体(如CO2、SO2、H2S、HCl等)、碱性气体(如NH3)、强氧化性气体(如O2、Cl2、NO2等)、其他气体(如NO等).
3.有机物的检验和鉴别
例3 (高考组合题)下列检验和鉴别方法正确的是( ).
A.(2010年天津卷)用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
B.(2009年四川卷)将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质一定属于醛类
C.(2013年江苏卷)将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.(2013年海南卷)用燃烧法鉴别乙醇、苯和四氯化碳
解析 碳碳双键、醛基都能被酸性KMnO4氧化,KMnO4溶液都褪色,故A项错误;能发生银镜反应的官能团为醛基,但醛基还可存在于甲酸、甲酸某酯或甲酸盐中,B项错误;能使溴水褪色的气体除了乙烯还有SO2等,C项错误;乙醇燃烧火焰为蓝色,苯燃烧伴有浓烟,四氯化碳不能燃烧,D项正确.答案:D
点评 有机物的检验和鉴别大多数是考查官能团的检验和鉴别,所以复习时要注意总结以下常见官能团的特征反应、所需试剂、条件要求、实验现象:饱和烃、碳碳双键、碳碳叁键、卤原子、醇羟基、酚羟基、醛基、羧基、酯基等.
4.物理方法鉴别物质
例4 (高考组合题)下列实验不能达到目的的是( ).
A.(2014年海南卷)CCl4可用于鉴别溴水和碘水
B. (2013年江苏卷)用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C. (2010年天津卷)用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.(2014年福建卷)用可见光束照射以区别溶液和胶体
解析 CCl4萃取溴水和碘水中的Br2和I2,分成两层,下层颜色各不同(橙红色、紫红色),故A项正确;焰色反应呈黄色的溶液只说明其中含有钠元素,不能说明是钠盐溶液,如NaOH溶液也行,B项错误;1-溴丙烷有3种等效氢原子,其核磁共振氢谱有3个峰,而2-溴丙烷有2种等效氢原子,其核磁共振氢谱有2个峰,故C项正确;用可见光束照射,胶体有丁达尔现象而溶液没有,D项正确.
答案:B
点评 物理方法鉴别物质,常有:(1)观察法,观察鉴别物质的状态、颜色等;(2)嗅试法,判断气体或有挥发性物质的不同气味;(3)焰色法,常用于金属或金属离子的检验;(4)水溶法,观察被鉴别物质在水中的溶解情况、密度及溶液颜色变化等;(5)其他方法,如丁达尔效应、核磁共振氢谱法等.
5.选择试剂鉴别物质
(1)仅用一种试剂鉴别多种物质
例5 (2009年重庆卷)下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( ).
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)3PO4 NaBr CuSO4 AlCl3 (KOH溶液)
解析 A项分别滴入FeCl3,有红褐色沉淀的是Ba(OH)2,呈血红色的是KSCN,将Ba(OH)2滴入另2种溶液,有白色沉淀的是Mg(NO3)2,无现象的是NaCl;B项分别滴入H2SO4,有气泡但无气味的是NaHCO3,有刺激性气味的是(NH4)2SO3,有白色沉淀的是Na2SiO3,无现象的是NaNO3;C项分别滴入AgNO3,K2CO3和CaCl2均有白色沉淀,故无法鉴别;D项分别滴入KOH并加热,产生现象分别是:刺激性气味、无现象、蓝色沉淀、白色沉淀,故可鉴别.答案:C
点评 仅用一种试剂鉴别时要考虑:(1)被鉴别物质的水溶性、密度、颜色等;(2)被鉴别物质的特性、阴阳离子的性质特点等;(3)已检出的物质或产物可用作后续鉴定试剂.
(2)不用任何试剂鉴别多种物质
例6 (2009年北京卷)下列各组物质的无色溶液,不用其他试剂即可鉴别的是( ).
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4
④Ca(OH)2 Na2CO3 BaCl2
A.①② B. ②③ C. ①③④ D. ①②④
解析 ①中Na2SO4与另两种溶液相互滴加无明显现象,KOH和AlCl3相互滴加现象不同:KOH逐滴加入AlCl3中立刻产生沉淀,而AlCl3滴入KOH中一段时间后才出现大量沉淀,可以鉴别;②相互滴加能产生两种白色沉淀的是Ba(OH)2,向产生的两种沉淀中分别滴加NaHCO3或H2SO4,能将一种沉淀溶解的是H2SO4,可以鉴别;③和④相互滴加时无法鉴别.答案:A
点评 不用试剂鉴别时可考虑如下6法:(1)特征连锁法,先鉴别出某一特征的物质(根据色、味、态、硬度、挥发性、水溶性等),再用这种物质去鉴别其他物质,进行连锁式鉴别;(2)加热法,若待检物均无明显外观特征,可考虑用加热出现不同现象加以鉴别;(3)焰色反应法,利用焰色反应将待检物质的不同阳离子鉴别开来;(4)互滴法,利用两溶液互滴现象不同加以鉴别;(5)逐一检出法,首先利用两种物质(或溶液)之间的特征反应鉴别出两种物质(或溶液),再利用此两种物质逐一鉴别出其他物质;(6)简明列表法,即两两混合,列出表格,记录反应现象,比较、分析表格的不同混合现象确定出每一种物质.
(3)限选或任选试剂鉴别多种物质
例7 (2011年重庆卷)不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( ).
A.盐酸、硫酸 B.盐酸、氢氧化钠溶液
C.氨水、硫酸 D.氨水、氢氧化钠溶液
解析 此题实际是限选2种试剂来鉴别4种物质.滴加盐酸可鉴别出AgNO3溶液和K2SO3溶液,另两种溶液可用硫酸鉴别出BaCl2,或可用NaOH鉴别出Mg(NO3)2溶液,故A、B项可鉴别;C项滴加氨水可鉴别出AgNO3溶液(先出现白色沉淀,后又溶解)和Mg(NO3)2溶液(白色沉淀),另两种溶液再用硫酸能够鉴别,C项可以;D项两种试剂均不能鉴别出BaCl2和K2SO3溶液.答案:D
点评 若以主观题(简答题等)的形式进行考查,要求我们限选或任选试剂来鉴别多种物质,那么在选择试剂时应遵循如下原则:操作步骤简单,试剂使用最少,现象最明显.
6.检验与推断物质的成分
高考试题往往就某一物质(样品、混合溶液等,可以是纯净物或混合物)的成分进行检验、分析、推断,其中尤以检验与推断混合溶液的离子成分最为常见.
(1) 定性检验与推断物质的成分
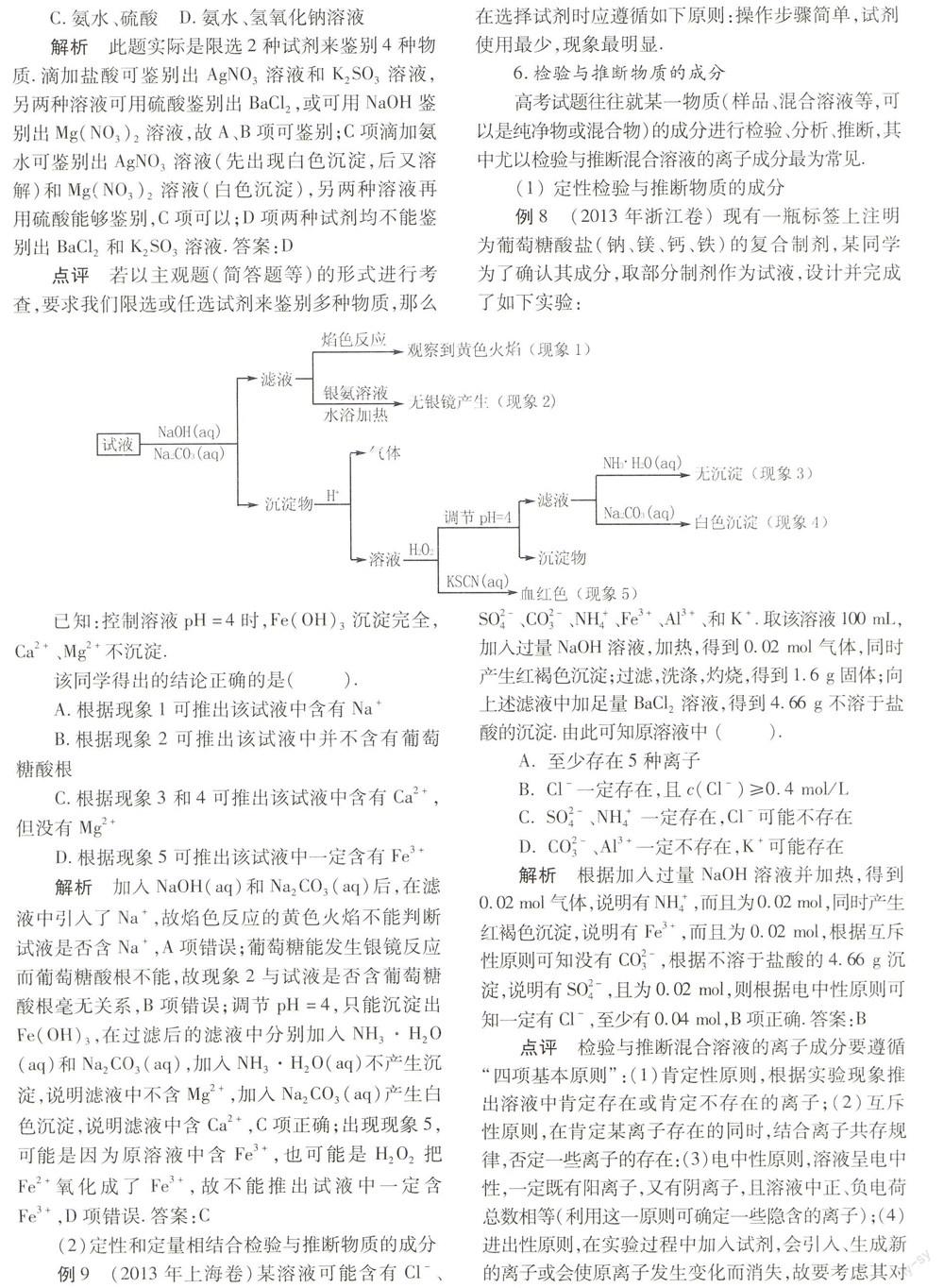
例8 (2013年浙江卷) 现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验: 已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀.
该同学得出的结论正确的是( ).
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe3+
解析 加入NaOH(aq)和Na2CO3(aq)后,在滤液中引入了Na+,故焰色反应的黄色火焰不能判断试液是否含Na+,A项错误;葡萄糖能发生银镜反应而葡萄糖酸根不能,故现象2与试液是否含葡萄糖酸根毫无关系,B项错误;调节pH=4,只能沉淀出Fe(OH)3,在过滤后的滤液中分别加入NH3·H2O(aq)和Na2CO3(aq),加入NH3·H2O(aq)不产生沉淀,说明滤液中不含Mg2+,加入Na2CO3(aq)产生白色沉淀,说明滤液中含Ca2+,C项正确;出现现象5,可能是因为原溶液中含Fe3+,也可能是H2O2把Fe2+氧化成了Fe3+,故不能推出试液中一定含Fe3+,D项错误.答案:C
(2)定性和定量相结合检验与推断物质的成分
例9 (2013年上海卷)某溶液可能含有Cl-、SO2-4、CO2-3、NH+4、Fe3+、Al3+、和K+.取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀.由此可知原溶液中 ( ).
A. 至少存在5种离子
B. Cl-一定存在,且c(Cl-)≥0.4 mol/L
C. SO2-4、NH+4一定存在,Cl-可能不存在
D. CO2-3、Al3+一定不存在,K+可能存在
解析 根据加入过量NaOH溶液并加热,得到0.02 mol气体,说明有NH+4,而且为0.02 mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02 mol,根据互斥性原则可知没有CO2-3,根据不溶于盐酸的4.66 g沉淀,说明有SO2-4,且为0.02 mol,则根据电中性原则可知一定有Cl-,至少有0.04 mol,B项正确.答案:B
点评 检验与推断混合溶液的离子成分要遵循“四项基本原则”:(1)肯定性原则,根据实验现象推出溶液中肯定存在或肯定不存在的离子;(2)互斥性原则,在肯定某离子存在的同时,结合离子共存规律,否定一些离子的存在:(3)电中性原则,溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中正、负电荷总数相等(利用这一原则可确定一些隐含的离子);(4)进出性原则,在实验过程中加入试剂,会引入、生成新的离子或会使原离子发生变化而消失,故要考虑其对离子的检验、判断造成的干扰.
7 设计物质检验方案
例10 (2014年福建卷实验题节选)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,易被空气氧化.检测Na2S2O5晶体在空气中已被氧化的实验方案是:
解析 Na2S2O5中S元素的化合价为+4,若被氧气氧化则生成SO2-4,检验Na2S2O5晶体在空气中已被氧化的方案相当于检验SO2-4.
答案:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,若有白色沉淀生成,则证明Na2S2O5晶体已被氧化.
点评 分析近年高考试题,设计物质检验方案往往是融合在综合实验题中进行考查,一般以填空题或简答题的形式出现.在叙述检验方案时要注意语言的规范性,答题模板一般为:取少许某样品(固体或溶液)于某仪器(多为试管)中→溶解(限固体)→加入某试剂(气体要用“通入”)→操作→描述现象→得出结论.
8.物质检验综合实验
例11 (2013年四川卷)为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.
(1)请完成下表:
【实验结论】 Fe的氧化产物为Fe2+和Fe3+.
Ⅱ.AgNO3的热稳定性
用如图1所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
图1
(2)装置B的作用是
.
(3)经小组讨论并验证该无色气体为O2,其验证方法是
.
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】 试管中残留的黑色固体可能是:
ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验. 【实验评价】 根据上述实验,不能确定固体产物成分的实验是
(填实验编号).
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有
.
解析 (1)检验Fe3+用KSCN溶液,反应后溶液变成红色;在Fe3+和Fe2+混合溶液中检验Fe2+可用K3[Fe(CN)6]溶液,加入K3[Fe(CN)6]溶液后,有蓝色沉淀生成;(2)固体加热产生气体通入溶液或水槽的实验装置需防止倒吸;(3)O2用带火星的木条检验,木条复燃证明是O2;(4)已知Ag2O可溶于氨水,单质Ag不溶于氨水,Ag和Ag2O都溶于稀硝酸,且Ag与稀硝酸反应生成NO气体.实验a可确定固体中含有Ag但不含Ag2O,故此实验可证明是设想ⅰ;实验b虽确定含有Ag但不能确定是否含有Ag2O,故此实验只能排除设想ⅱ,但不能证明究竟是设想ⅰ还是设想ⅲ.根据上述分析可知只能采用实验a的结论,故AgNO3固体分解的产物为Ag、NO2、O2.
答案:(1)溶液呈红色 K3[Fe(CN)6]溶液 产生蓝色沉淀 (2)防倒吸 (3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为O2 (4) b Ag、NO2、O2
点评 这是一道物质检验型的综合探究实验题,考查了常见离子、气体、物质组成成分的检验知识.从中可看出,高考综合实验题的命制不管如何创新变化,构思复杂,但实际考查的知识落点都不很高,大多是我们已学过的知识技能,所以只要我们在平时复习时注意夯实双基,强化训练,总结提高,就能以不变应万变,从容自如地应对高考.总之,化学实验的复习只有注重研究近几年高考化学试题的考查特点,领会试题的考查意图和高考命题方向,才能在复习中有的放矢,提高效率.
(收稿日期:2015-01-13)
