NO与NO2相互转化实验的改进
2016-05-30周沛仪
周沛仪
人教版化学必修1模块编排了NO和NO2的性质实验,这是一个探究实验,要求学生自行设计,使所给的NO2气体尽可能多地被水吸收。
但在实验操作中,水吸收后NO2产生NO并被空气氧化的现象非常模糊,而且NO散布在空气中会造成室内污染。
为了更直观地观察NO被氧化成NO2,使氮氧化物最大限度地被水吸收,同时杜绝所造成的污染,我对实验做了如下改进设计。
一、实验用品
圆底烧瓶,抽滤瓶,锥形瓶,分液漏斗,玻璃管,橡胶管,T型管,橡皮塞,止水夹。MnO2粉末,10%H2O2溶液,极稀NaOH溶液,酚酞试液,NO2气体。实验装置如图1所示。
二、实验步骤
1.圆底烧瓶中充满事先制备好的NO2气体。
2.锥形瓶中加入少量MnO2粉末,球形分液漏斗中加入一定量30ml至50ml10%的H2O2溶液。
3.抽滤瓶中加入一定量极稀的NaOH溶液,并滴加两滴酚酞试液。
4.关闭止水夹1、3,打开止水夹2、4,将分液漏斗中一定量的H2O2溶液加入锥形瓶中,锥形瓶中产生的气体经止水夹2进入密闭的抽滤瓶,气体产生的压力将抽滤瓶中的红色碱性酚酞溶液通过玻璃管压入圆底烧瓶中,形成喷泉。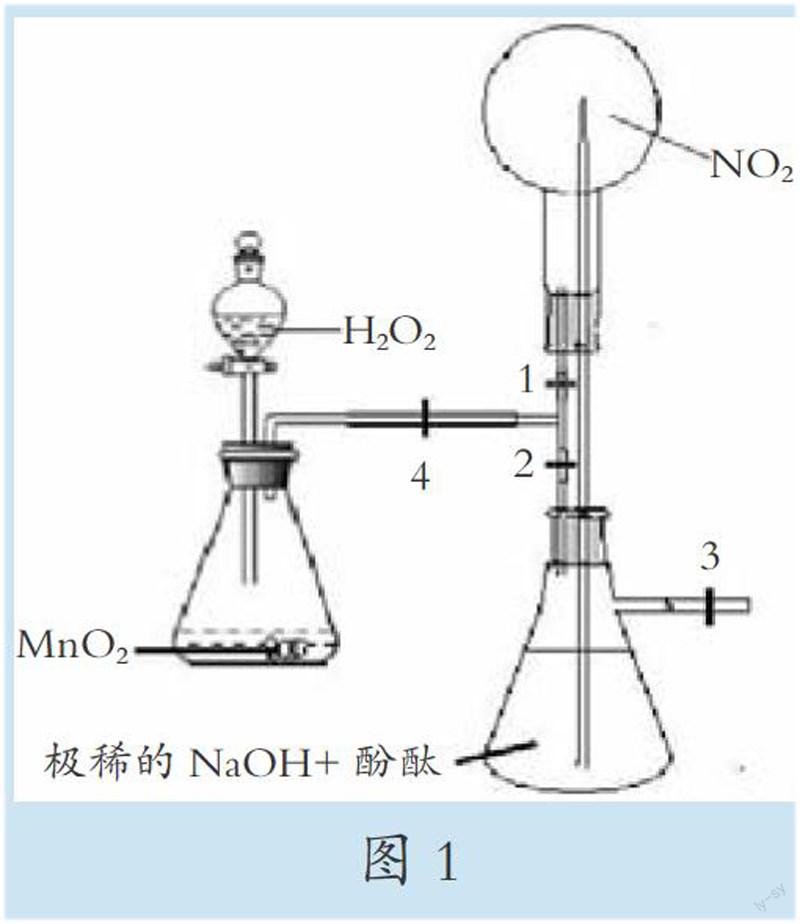
溶液与烧瓶中的NO2反应,造成瓶内压强下降,使抽滤瓶中的红色溶液在烧瓶与抽滤瓶间压强差的作用下持续不断地涌进烧瓶中,形成喷泉。进入烧瓶后溶液红色消失变成无色,气体的颜色由红棕色逐渐变淡,直至近乎无色。
5.喷泉停止后,打开止水夹1,关闭止水夹2,继续从分液漏斗向锥形瓶中加入一定量的H2O2溶液,产生的氧气经止水夹1进入烧瓶中,可清楚地看到烧瓶上方的气体逐渐由无色变为红棕色。
6.关闭止水夹1,打开止水夹2,使锥形瓶中产生的气体进入抽滤瓶,并形成压强差,把抽滤瓶中的溶液压入烧瓶中形成喷泉。随着新产生的NO2的不断溶解,烧瓶内溶液上方气体的颜色不断变浅,直至近乎无色。
7.重复多次,或保持所充氧气过量时,可使产生的NO全部被氧化成NO2,从而全部被溶液吸收。
三、原理
1.利用锥形瓶中产生的氧气涌入抽滤瓶产生的高压与烧瓶中NO2溶于碱液造成的低压,形成较大的压强差,把抽滤瓶中的碱液吸入烧瓶中。
为加快NO2与水的反应,在吸入溶液中加入少量NaOH,一方面通过NaOH+HNO3=NaNO3+H2O加快可逆反应3NO2+H2O 2HNO3+NO的平衡移动,另一方面,通过溶液进入烧瓶后性质由碱变酸指示剂的颜色变化,增加实验的可视性。
2.实验开始时,关闭止水夹1、3,打开止水夹2、4,使锥形瓶和导管中的空气进入到抽滤瓶中形成高压,从而保证后面关闭止水夹2、打开止水夹1时,进入烧瓶中的氧气纯度较高。
3.对于止水夹3,一方面可通过压力调节控制喷泉的形态、喷射速度以及喷射时间,另一方面,万一系统内压过大,可进行减压。
四、优点
1.增强可视性
通过溶液颜色由红色到无色,气体的颜色在红棕色和无色之间的颜色切换,使学生更直观地感受其中的化学变化,从而更深入地理解其中所涉及化学反应方程式的含义。
2.减少污染
由于有毒的NO2和NO气体被控制在圆底烧瓶反复经历溶解-氧化-再溶解的过程,尤其是保持烧瓶中氧气过量的情况下,所有NO最终都会被氧化成NO2而被溶液完全吸收,因此做到了有毒气体在室内空气中的零排放,符合实验设计的绿色环保理念。(指导老师:李银秀)
