浅析中学化学常见计量仪器的使用
2016-05-30胡牧野

摘 要:化学是一门以实验为基础的自然科学,实验是化学的灵魂。熟练掌握中学化学的各种化学仪器使用与操作是做好化学实验的前题,也能培养学生良好的学习习惯,严谨的科学作风。下面就中学化学中一些常见的计量仪器的使用与注意事项,以及在實验中的误差分析浅析一下。
关键词:计量仪器;实验误差;误差分析
中学化学中常见的计量仪器主要有托盘天平、量筒、容量瓶、滴定管等。下面一一进行分析:
1 托盘天平(精密度要求不高的称量,能准确到0.1g)
1.1 使用注意事项
1)称量前天平要放平稳,游码放在刻度尺的零处,调节天平左、右的平衡螺母,使天平平衡。
2)称量时把称量物放在左盘,砝码放在右盘。砝码要用镊子夹取,先加质量大的砝码,再加质量小的砝码。
3)称量干燥的固体药品应放在纸上称量。
4)易潮解、有腐蚀性的药品(如氢氧化钠),必须放在玻璃器皿里称量。
5)称量完毕后,应把砝码放回砝码盒中,把游码移回零处。
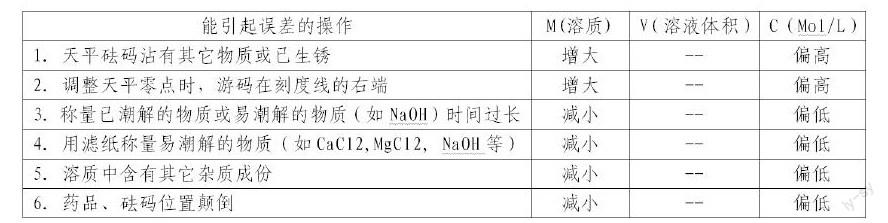
1.2 误差分析
配制一定溶质的质量分数溶液和配制一定物质的量浓度溶液及称量一些物质的质量常用到托盘天平。下面以配制一定物质的量浓度溶液为例分析,其误差主要有这几方面:
2 量筒(用来量度液体体积,精确度不高)
2.1使用注意事项
1)能加热和量取热的液体,不能作反应容器,不能在量筒里稀释溶液。
2)液时,量简必须放平,视线要跟量简内液体的凹液面的最低处保持水平,再读出液体体积。
3)量取已知体积的液体,应选择比已知体积稍大的量筒,否则会造成误差过大。如量取15mL的液体,应选用容量为20mL的量筒,不能选用容量为50mL或100mL的量筒。
4)量取液体时应在室温下时行。
2.2 误差分析
量筒在中学化学实验中用的比较多的化学仪器之一,主要在量取溶液的体积,如在一定物质的量浓度溶液的配制,在量气装置中气体的量取中均用到到量筒。如下例:实验室用98.0%密度为1.840g/cm3的浓H2SO4溶液配制500ml 0.500mol/L H2SO4溶液。其主要误差是读数引起的:
1)定量读数时,就是我们在量取规定体积的溶液。如在配制一定物质的量浓度溶液的中。正确操作时眼睛应与刻度平视,眼睛的视线注视刻度的同时,边滴加溶液,当量筒中的溶液的凹液面的最低处与眼睛和刻度在一条直线上时,就停止滴加溶液,此时三点在一直线上。而如果仰视刻度,就会使溶液的凹液面的最低处处于正确位置之上,导致滴加液体过多,在一定物质的量浓度溶液配制中,溶质的量就偏大,溶质的物质的量浓度就会偏高。如果俯视,结果就会偏低。
2)未定量读数时,就是说我们在量取未知体积的液体,而要求读出未知液体的体积。正确读数是眼睛平视,读出眼睛与溶液的凹液面的最低处成一直线时与量筒相交点的量筒上的刻度。如果仰视,同样读出眼睛与溶液的凹液面的最低处成一直线时与量筒相交点的量筒上的刻度,这样读出的刻度是比正确读数是偏小了。如果俯视,结果就会偏大了。
3 容量瓶
用于准确配制一定体积和一定浓度的溶液。使用前检查它是否漏水。
1)使用注意事项:
a.只能配制容量瓶上规定容积的溶液。
b.容量瓶的容积是在20℃时标定的,
转移到瓶中的溶液的温度应在20℃左右。
2)误差分析:
原理:(M-溶质的摩尔质量,配制某种溶液时是定值)
根据配制原理,要分析该实验中的误差,必正确认识到错误的操作是影响了溶质的量还是溶液的体积。物质的量浓度与溶质的量(nB)成正比,与溶液体积V(aq)成反比。分析定容时仰视和俯视,其分析如下:正确操作时眼睛应与刻度线平视,眼睛的视线应注视刻度线的同时,边用胶头滴管滴加溶液,当容量瓶细颈中的溶液的凹液面的最低处与眼睛和刻度线在一条直线上时,就停止滴加溶液,此时三点在一直线上。而如果仰视刻度,就会使溶液的凹液面的最低处处于正确位置之上,导致滴加液体过多,在一定物质的量浓度溶液配制中,溶液的体积的量就偏大,其所配溶液物质的量浓度就偏低;如果俯视,结果就会偏高。
4 滴定管
用于准确量取一定体积液体的仪器。带玻璃活塞的滴定管为酸式滴定管,带有内装玻璃球的橡皮管的滴定管为碱式滴定管。
4.1 使用注意事项
1)酸式、碱式滴定管不能混用。
2)25mL、50mL滴定管的估计读数为±0.01mL。
3)装液前要用洗液、水依次冲洗干净,并要用待装的溶液润洗滴定管。
4)调整液面时,应使滴管的尖嘴部分充满溶液,使液面保持在“0”或 “0”以下的某一定刻度。读数时视线与管内液面的最凹点保持水平。
4.2 误差分析
滴定管的0刻度在上,而大刻度在下面,还有一段体积没有刻度显示。在中和滴定的实验中,错误的操作对实验结果会有不同的影响,学生分析误差时可能不知从何着手。分析误差时应注意思维的有序性,首先依题意列出相关计算式,再区别不变量和变化量,然后抓住变化量对实验结果的影响进行实际分析。
c碱=(c酸×V酸)/(V碱×n)或c待=(c标×V标)/(V待×n)
(n表示酸碱反应的物质的量之比)
在实际计算时,标准液浓度和待测液体积是已知数据,是不变量。滴定管中所消耗的标准体积V标随不同操作而发生变化。从上式可知V标与c待成正比。V标增大的操作会使所计算出待测液浓度都偏大,反之偏小。
参考文献:
《化学》必修1和必修2,普通高中课程标准实验教科书,人民教育出版社。
作者简介:胡牧野(1979-),男,汉族,湖南洞口人,本科,研究方向:化学教育。
