高考化工流程试题命题特点及解决对策
2016-05-30颜建河
颜建河


题海无边。对于我们每个学生来说,题目永远做不完,做不穷尽,也没有必要。立足基础,掌握核心知识,学会总结反思,学会迁移运用,才是致胜之法宝,才能做到不变应万变。以化工流程为背景的框图题,是近年来的必考试题之一,可谓高考中的“新宠儿”,试题涉及了课标要求的全部重要核心知识点,着力考查学生独立思考、灵活运用所学知识分析问题和解决问题的能力。这类试题以新颖、鲜活的真实情景,融元素、化合物、理论、结构、性质、实验等诸多方面的知识于一体,具有考查知识面广、综合性强、思维容量大的特点,备受命题者垂青,成为高考化学科目的“主打”题目。立足课本知识,采用正向逆向思维、发散收敛思维、横向思维等多种方式进行综合分析、推理,才能追寻到解决这类问题的“切入点”,最终顺利地完成对整个题目的解答。
特点之一——以化学原理为背景命题,从原理方面进行切入。
考题以物质的制备流程为主线,题干主要以框图转化和熟知反应现象等知识作为题目材料予以呈现。着力考查学生运用化学平衡原理、化学反应与能量变化、电化学等知识来解决化工生产中实际问题的能力。其解决对策就是读懂框图,获取有用信息(核心反应),分析流程中的每一步骤,运用化学反应原理分析制备产品的最佳条件,从产品物质来进行切入,准确找到解答题目的突破口。
【例1】(2015·广东)七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(1)煅粉主要含MgO和 ,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液I中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH为_______(Mg(OH)2的Ksp=5×10-12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______________。
(2)滤液I中的阴离子有_______(忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。
分析与解答:本题是一道立足于课本,而高于课本的化工流程试题,着力考查学生运用化学原理、化学反应、电化学等相关知识,综合性较强,有一定难度。为此,解答这类问题的切入口就是从原理出发(利用好溶度积、物质的分离、电极反应的书写等相关知识),同时,认真分析框图中每步的目的所在,则题中问题可迎刃而解。
(1)煅烧时CaCO3会发生分解生成CaO和CO2,煅烧MgCO3分解生成MgO和CO2;故煅烧主要含MgO和CaO;Ksp=c(Mg2+)·c2(OH-),代入得:5×10-12=5×10-6×c2(OH-),即得c(OH-)=10-3mol·L-1,pH=11。由于溶液中c(Mg2+)小于5×10-6mol·L-1,所以溶液pH大于11,不能用(NH4)2SO4代替NH4NO3的原因是加入(NH4)2SO4会生成CaSO4微溶物,在过滤时会被除去,从而造成生成的CaCO3减少。
(2)从流程中看出NO3-没有被除去,故滤液Ⅰ中的阴离子有NO3-,CaO溶于水生成Ca(OH)2,故溶液中还有OH-;若滤液中Ⅰ中仅通入CO2,过量的CO2会与CaCO3生成CaHCO3,从而导致CaCO3产率降低。
(3)Al表面的氧化膜的成分是Al2O3,该物质是两性氧化物,NaOH可以与这发生反应,NaOH溶液与Al2O3反应的离子方程式为:Al2O3+OH-=2AlO2-+H2O。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,Al作阳极,石墨作阴极;Al在阳极放电,溶液中的H+在阴极放电,破坏了水的电离平衡,使的溶液中的OH-浓度增大,与产生的Al3+结合生成Al(OH)3,总反应方程式为:2Al+6H2O2Al(OH)3↓+3H2↑。
(5)根据题意知,充电和放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,放电时负极Al失去电子变为Al3+,与溶液中的AlCl4-结合,发生反应产生的Al2Cl7-电极反应式为:Al-3e-+7AlCl4-=4Al2Cl7-。
【答案】(1)CaO,11;加入(NH4)2SO4会生成CaSO4微溶物,在过滤是会被除去,造成生成的CaCO减少 (2)NO3-,(NH4)2CO3(3)2OH-+Al2O3=2AlO2-+H2O (4)2Al+6H2O2Al(OH)3↓+3H2↑ (5)Al-3e-+7 AlCl4-=4 Al2Cl7-
特点之二——以物质制备为背景命题,从制备方面进行切入。
考题的题干主要以熟知物质的特征结构、组成等知识作为题目材料予以呈现,主要考查元素及化合物、物质结构、元素周期律、氧化还原反应等知识。其解决对策就是认真阅读题干信息,从特征结构、组成来进行切入,才能迅速、准确找到解答题目的突破口。
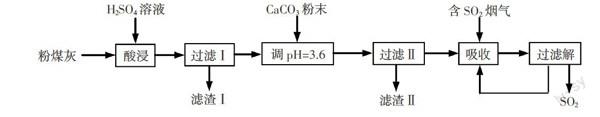
【例2】(2014·江苏)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
⑴酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
⑵加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是 (用离子方程式表示)。
⑶上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
分析与解答:本题是一道立足于课本,而高于课本的化工流程试题,着力考查学生元素及化合物、物质结构等相关知识,难度不大。为此,解决好这类题目的关键,就是认真读题,明确框图中每一步的目标,再结合题目设问,利用好硫、硅、铝等相关知识,则试题中的各个问题便可迎刃而解。
(1)酸浸时,粉煤灰中的Al2O3能与H2SO4反应生成Al2(SO4)3,而SiO2不能与H2SO4反应,因而滤渣Ⅰ为SiO2。
(2)滤液为Al2(SO4)3,调节pH=3.6,加入CaCO3粉末,发生反应生成微溶物CaSO4,因而滤渣Ⅱ为CaSO4;溶液中存在Al3++3H2O=Al(OH)3+3H+,CaCO3+2H+= Ca2++H2O+CO2↑,溶液的pH偏高,碱性增强,会促进Al3+水解,溶液中的Al3+和OH-离子反应生成Al(OH)3,所以将会导致溶液中铝元素的含量降低。
(3)+4价S具有较强还原性,溶液吸收二氧化硫生成SO32-,在溶液中SO32-易被氧化生成SO42-,所以上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量;溶液中SO32-属于弱酸根离子被氧气氧化为转化为SO42-,SO42-为强酸根离子,则溶液酸性增强,pH减小。
【答案】(1)Al2O3 + 3H2SO4=Al2(SO4)3 + 3H2O;SiO2(2)CaSO4;3CaSO4 + 2Al3+ + 3SO42- + 3H2O=2Al(OH)3 + 3CaSO4 + 3CO2↑(3)溶液中的部分SO32-被氧化成SO42-;减小。
特点之三——以实验操作为背景命题,从实验方面进行切入。
考题以考查学生实验基础知识、基本操作及基本技能为主要目标。其解答切入点就是认真读题,仔细审题,找到实验的目的所在。即从混合物中分离、提纯某一物质,利用某些物质制备另一物质所涉及的实验操作方法。
【例3】(2014·江苏)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
⑴向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为______________;该操作将I2还原为I-的目的是 ___________。
⑵操作X的名称为 。
⑶氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是______________________________;锥形瓶里盛放的溶液为 。
⑷已知:5SO32- + 2IO3- + 2H+ = I2 + 5SO42- + H2O。
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:
取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;___________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
分析与解答:本题是一道立足于课本,而高于课本的化工流程框图试题,着力考查学生化学基础知识和基本实验技能,有一定难度。为此,解决好这类题目的关键,就是认真读题,明确框图中每一步的目标,再结合题目设问及实验装置图,利用好卤素、氧化还原反应的相关知识,则试题中的各个问题便可迎刃而解。
根据题给框图分析,明确几种重要物质(离子)的氧化性强弱,融合实验装置和实验的基本操作,再结合问题就能准确回答。其正确答案如下:
(1)SO32-被I2氧化为SO42-,I2被还原为I-,结合电荷守恒和原子守恒可写出正确反应方程式为:SO32- + I2 + H2O = 2I- + SO42- + 2H+;因为I2不溶于水,而碘化物易溶于水,故将I2还原为I-的目的是使CCl4中的碘进入水层。
(2)分离有机溶剂和水溶液的混合物需要通过分液的方法;
(3)温度越高,Cl2溶解度越小,而且随温度升高,Cl2会把I2进一步氧化为IO3-,导致氧化I-的效率偏低;另外,I2也容易升华。使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);NaOH溶液。
(4)检验I2用淀粉,结合所给试剂的性质,FeCl3具有氧化性,可将I-氧化为I2,而Na2SO3具有强还原性,可将IO3-还原为I2。从水层取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-;另从水层中取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-。
【答案】(1)SO32- + I2 + H2O = 2I- + SO42- + 2H+,使CCl4中的碘进入水层。(2)分液;(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);NaOH溶液;(4)从水层取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-;另从水层中取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-。
责任编辑 李平安
