花椰菜总黄酮提取工艺优化
2016-05-30尹鹏郭新梁梓胡霞
尹鹏 郭新 梁梓 胡霞

摘要:【目的】优化花椰菜总黄酮提取工艺,为其药用开发与利用提供技术参考。【方法】以乙醇为浸提溶剂、花椰菜总黄酮含量为考察指标,选择乙醇体积分数、液料比、提取温度、提取时间4个因素进行单因素试验,每个因素各筛选4个水平进行正交试验,以优化花椰菜总黄酮提取工艺。【结果】影响花椰菜总黄酮提取效果的主次因素排序为:乙醇体积分数>提取时间>提取温度>液料比;花椰菜总黄酮最佳提取工艺条件为:乙醇体积分数60%、液料比50∶1、提取温度60 ℃、提取时间2.0 h,此条件下提取获得花椰菜总黄酮含量为0.932 mg/g。【结论】正交试验优选的乙醇浸提工艺操作简便、合理可行,是提取花椰菜总黄酮的有效方法。
关键词: 花椰菜;总黄酮;正交试验;工艺优化
中图分类号: R284.2 文献标志码:A 文章编号:2095-1191(2016)04-0640-05
0 引言
【研究意义】黄酮类化合物具有多种药理作用,可有效清除人体内自由基、改善血液循环、降低胆固醇,已广泛应用于心血管疾病的治疗(尉芹等,2001;刘品华等,2014)。花椰菜(Brassica oleracea L. var. botrytis L.)隶属十字花科(Brassicaceae)芸薹属(Brassica),为一年生植物,富含黄酮。但目前有关其黄酮提取工艺的研究较少,且获得的提取率较低,因此,优化花椰菜总黄酮提取工艺,对其药用开发与利用具有重要意义。【前人研究进展】对于结构和来源不同的黄酮类化合物,一般以其极性和水溶性大小为基础选择合适的溶剂和方法进行提取,主要采用有机溶剂萃取、热水提取、超声波提取、碱性稀醇或碱性水提取、酶解提取、微波辅助萃取等(李睿等,2009;冯宗帅等,2009;杨海荣和田建林,2009;公衍玲等,2010;戴余军等,2010)。长期以来,黄酮提取工艺的研究主要集中在药用植物方面。近年来,蔬菜黄酮的提取逐渐受到重视,如周宝利等(2012)对茄子黄酮提取工艺进行优化,得到最佳提取条件为:乙醇体积分数80%、提取温度40 ℃、提取时间80 min,料液比1∶20,在此条件下提取率为2.2%;陈建福和施伟梅(2014)利用纤维素酶辅助法优化西兰花总黄酮提取工艺,在最佳工艺条件下得到西兰花总黄酮提取率为1.251%,较传统提取方法的提取率提高了41%;张翔宇等(2015)采用超声波协同酶法提取芹菜中总黄酮,提取率为1.0184%。此外,对于南瓜总黄酮的研究相对较系统,南瓜花、苗、瓤、叶、茎中总黄酮提取条件的优化均有相关报道(王小华等,2008;张欣和曾光银,2010;周志娥等,2011;李南薇等,2011);也有丝瓜叶(杜敏华和张彩莹,2007)、大白菜球叶(李娟等,2007)、马铃薯皮(王利珍等,2011)、辣椒叶(王艳丽等,2013)总黄酮提取方面的报道。【本研究切入点】目前,有关花椰菜总黄酮提取工艺方面的研究鲜见报道。【拟解决的关键问题】选择乙醇体积分数、液料比、提取温度、提取时间为考察因素,以总黄酮含量为评价指标,在单因素试验的基础上,通过正交试验优化花椰菜总黄酮提取工艺,为花椰菜药用开发与利用提供技术参考。
1 材料与方法
1. 1 试验材料
花椰菜(金田1号,成都金田种业有限责任公司)鲜品洗净后烘干,捣碎,过50目筛备用。芦丁标准品、氢氧化钠、亚硝酸钠、硝酸铝、无水乙醇等试剂均为国产分析纯,购自合肥博美生物科技有限责任公司。主要仪器设备:BS224S电子天平(北京赛多利斯仪器系统有限公司)、GZX-GF-101-2-Ⅱ电热恒温鼓风干燥箱(上海贺德实验设备有限公司)、SHA-B水浴恒温振荡器(金坛市仪器厂)、A-88组织捣碎机(金坛市仪器厂)、TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司)、JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、T6新悦可见分光光度计(北京普析通用仪器有限责任公司)。
1. 2 标准曲线绘制
参照梁梓等(2012)、尹鹏等(2015)的方法,以总黄酮质量浓度为横坐标、吸光值为纵坐标绘制标准曲线。
1. 3 花椰菜总黄酮含量测定
称取花椰菜样品,在不同乙醇体积分数、液料比、提取温度、提取时间下浸提总黄酮,并根据标准曲线计算花椰菜总黄酮含量(梁梓等,2012;尹鹏等,2015)。
1. 4 单因素试验
1. 4. 1 乙醇体积分数对花椰菜总黄酮的提取效果 称取6份1.0 g花椰菜样品,分别加入40 mL 40%、50%、60%、70%、80%和90%乙醇,于50 ℃水浴加热1.5 h后,4000 r/min离心15 min,取上清液测吸光值。
1. 4. 2 液料比对花椰菜总黄酮的提取效果 称取6份1.0 g花椰菜样品,按液料比30∶1、40∶1、50∶1、60∶1、70∶1和80∶1分别加入50%乙醇,于50 ℃水浴加热1.5 h后,4000 r/min离心15 min,取上清液测吸光值。
1. 4. 3 提取温度对花椰菜总黄酮的提取效果 称取6份1.0 g花椰菜样品,加入40 mL 50%乙醇,分別于30、40、50、60、70和80 ℃水浴加热1.5 h,4000 r/min离心15 min后,取上清液测吸光值。
1. 4. 4 提取时间对花椰菜总黄酮的提取效果 称取6份1.0 g花椰菜样品,加入40 mL 50%乙醇,于50 ℃水浴分别加热0.5、1.0、1.5、2.0、2.5和3.0 h,取出后4000 r/min离心15 min,取上清液测吸光值。
1. 5 正交试验优化提取工艺
根据单因素试验结果,选取对花椰菜总黄酮含量提取有意义的因素水平进行正交试验,采用L16(45)正交试验优化提取工艺条件(宋利华等,2012)。因素水平见表1。
1. 6 工艺验证试验
根据正交试验结果优选出的提取工艺条件进行验证试验,3次平行试验,测定花椰菜总黄酮含量。
1. 7 统计分析
分别采用Office 2007和SPSS 13.0软件对试验数据进行处理和方差分析。
2 结果与分析
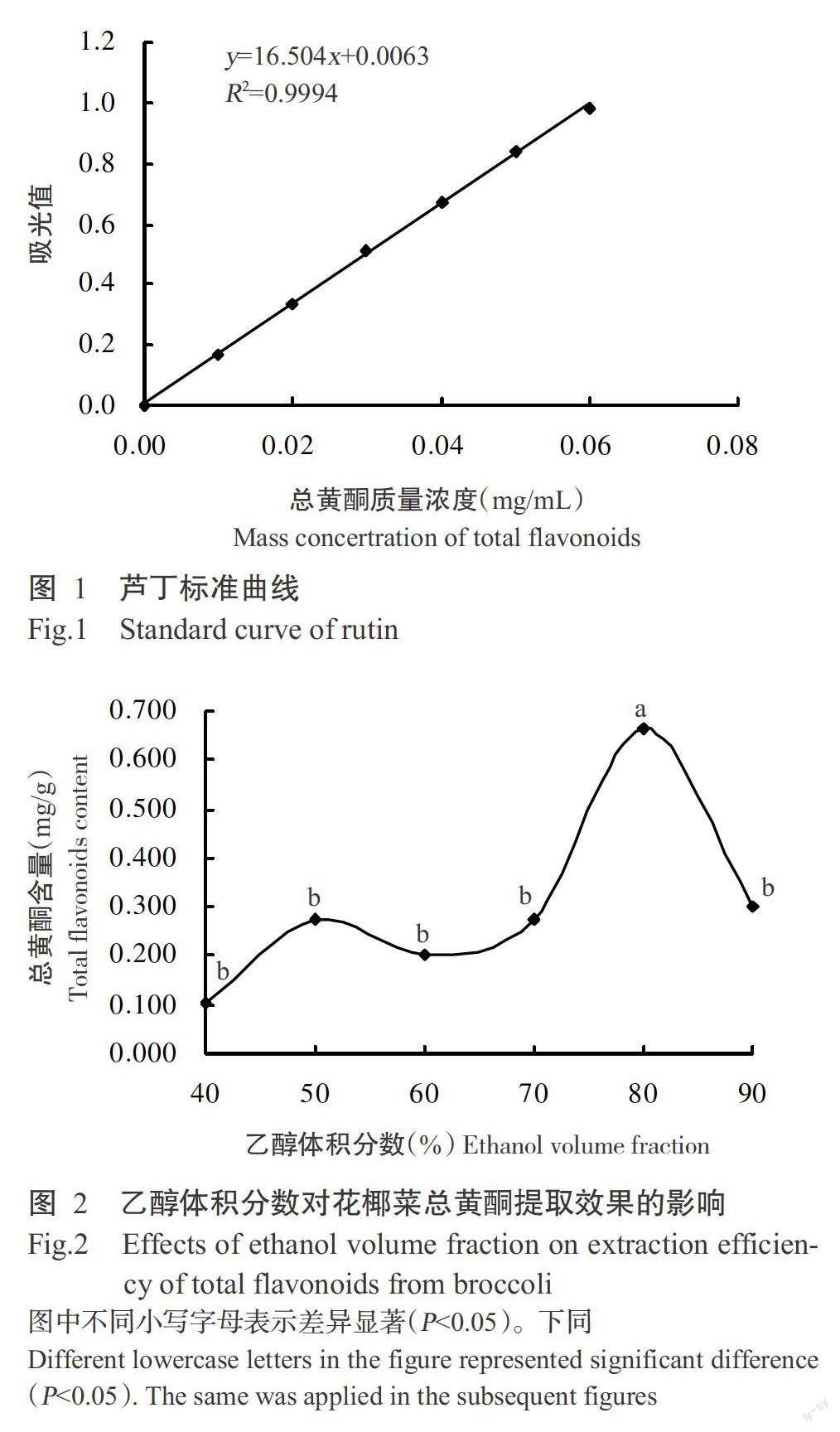
2. 1 芦丁标准曲线
芦丁标准曲线如图1所示,回归方程为:y=16.504x+0.0063(R2=0.9994),总黄酮质量浓度在0~0.06 mg/mL范围内与吸光值呈良好的线性关系。
2. 2 单因素试验结果
2. 2. 1 乙醇体积分数对花椰菜总黄酮提取效果的影响 由图2可知,随着乙醇体积分数的增大,花椰菜总黄酮含量缓慢增加,但超过80%后,总黄酮含量反而降低;乙醇体积分数为80%时,花椰菜总黄酮含量显著高于其他水平(P<0.05,下同)。因此,选择60%、70%、80%和90% 4个水平进行正交试验。
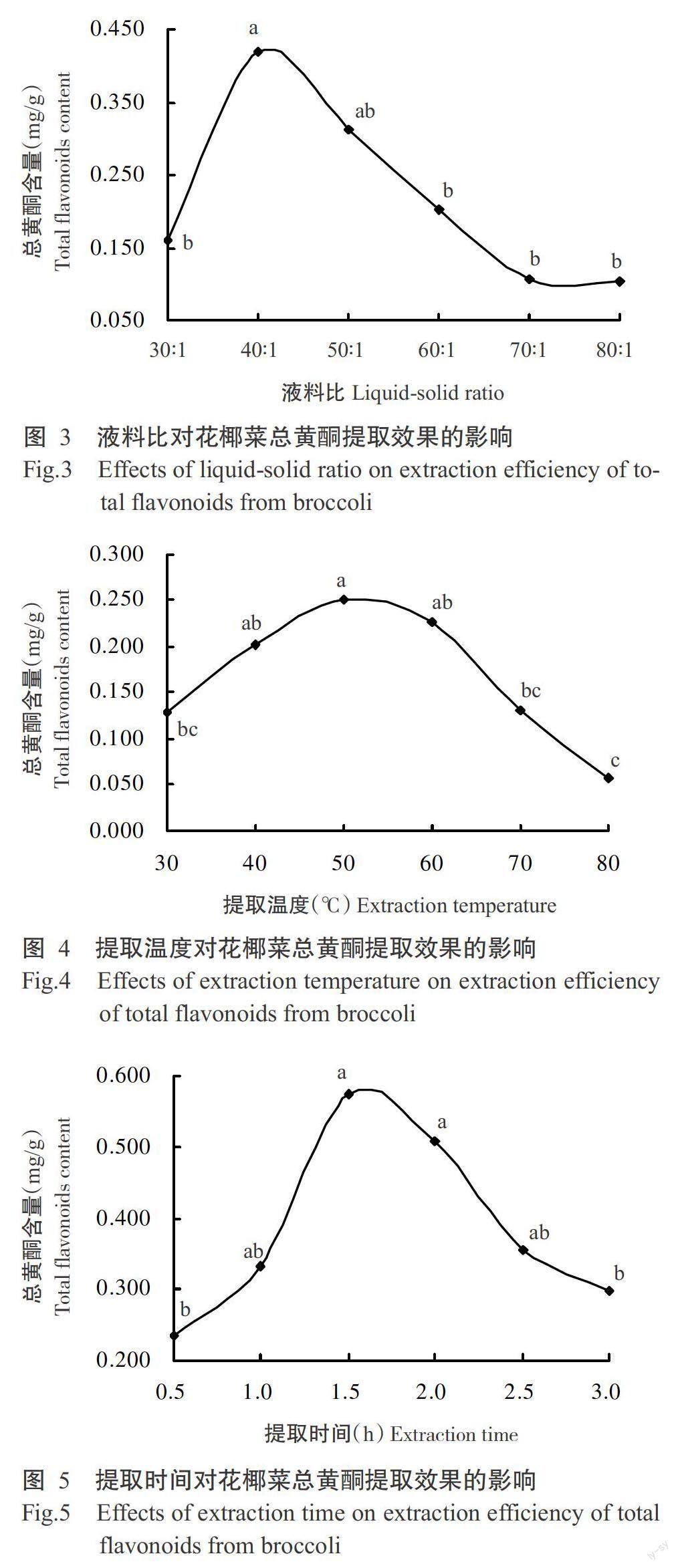
2. 2. 2 液料比对花椰菜总黄酮提取效果的影响 由图3可知,随着液料比的增加,花椰菜总黄酮含量不断增加,液料比超过40∶1后,随着液料比的继续增加,总黄酮含量却不断降低,最后逐渐趋于稳定状态;液料比为40∶1时,花椰菜总黄酮含量显著高于除50∶1之外的其他4个水平。因此,选择30∶1、40∶1、50∶1和60∶1 4个水平进行正交试验。
2. 2. 3 提取温度对花椰菜总黄酮提取效果的影响 由图4可知,随着提取温度的升高,花椰菜总黄酮含量逐渐增加,当提取温度为50 ℃时,总黄酮含量最高,显著高于30、70和80 ℃时的总黄酮含量。故选择30、40、50和60 ℃ 4个水平进行正交试验。
2. 2. 4 提取时间对花椰菜总黄酮提取效果的影响 由图5可知,随着提取时间的延长,花椰菜总黄酮含量不断增加,超过1.5 h后,随着提取时间的继续延长,总黄酮含量反而逐渐降低;提取1.5 h所得的花椰菜总黄酮含量显著高于0.5和3.0 h的总黄酮含量。因此,选择1.0、1.5、2.0和2.5 h 4个水平进行正交试验。
2. 3 正交试验结果
由表2可知,影响花椰菜总黄酮含量的各因素主次排序为:A>D>C>B,即乙醇体积分数是影响花椰菜总黄酮提取效果的主要因素,其次为提取时间和提取温度,而液料比的影响相对较小。根据极差分析得到花椰菜总黄酮提取的最佳工艺组合为A1B3C4D3,即乙醇体积分数60%、液料比50∶1、提取温度60 ℃、提取时间2.0 h;根据直观分析得到花椰菜总黄酮提取的最佳工艺组合为A1B3C3D3,即乙醇体积分数为60%、液料比为50∶1、提取温度为50 ℃、提取时间为2.0 h时,花椰菜总黄酮含量最高,为0.919 mg/g。因极差分析结果与直观分析结果不同,故需通过验证试验确定最佳提取工艺条件。
2. 4 验证试验结果
按照极差分析优选出的工艺条件进行验证试验,重复测定3次,花椰菜总黄酮平均含量为0.932 mg/g,RSD为1.56%,总黄酮含量高于正交试验中任何一组数据,说明利用正交试验的极差分析优选出的提取工艺合理可行。
3 讨论
本研究在单因素试验的基础上,选择乙醇体积分数、提取温度、提取时间、液料比4因素的4个水平进行正交试验,以优化花椰菜总黄酮提取工艺,结果表明,乙醇体积分数是影响花椰菜总黄酮提取效果的主要因素,其次是提取时间和提取温度,而液料比影响相对较小,与杜敏华和张彩莹(2007)的研究结果一致。在单因素试验中,发现乙醇体积分数为80%时,花椰菜总黄酮含量最高,之后随着乙醇体积分数的继续增大,总黄酮含量反而下降,其原因可能是当乙醇体积分数增至一定值,溶液极性显著增强,溶液中一些溶于乙醇的杂质溶出,与黄酮类物质竞争同乙醇—水分子的结合,从而致使总黄酮溶解度降低(陈婵等,2015)。今后可在乙醇体积分数方面进行深入探究,以期找出更佳的试验水平。
本研究通过正交试验优化得到花椰菜总黄酮提取工艺条件为:乙醇体积分数60%、液料比50∶1、提取温度60 ℃、提取时间2.0 h,在此条件下得到花椰菜总黄酮含量为0.932 mg/g;而周向军等(2010)利用响应面法对西兰花总黄酮提取工艺进行优化,得到最佳工艺条件为:乙醇体积分数90%、液固比30∶1、提取温度85 ℃、提取时间1.82 h,得率为0.853%。对比可知,本研究的提取工艺条件相对较温和,提取率也较高,可有效提取花椰菜总黄酮。
4 结论
正交试验优选的乙醇浸提工艺操作简便、合理可行,是提取花椰菜总黄酮的有效方法。
参考文献:
陈婵,丁玲,彭宏,林叶,郑敬森. 2015. 不同方法提取柚皮总黄酮含量的比较研究[J]. 江西农业学报,27(5):75-78.
Chen C,Ding L,Peng H,Lin Y,Zheng J S. 2015. Comparative study on content of total flavonoids extracted from shaddock peel by using different methods[J]. Acta Agriculturae Jiang-xi,27(5):75-78.
陳建福,施伟梅. 2014. 响应面法优化纤维素酶辅助提取西兰花总黄酮[J]. 四川农业大学学报,32(3): 298-304.
Chen J F,Shi W M. 2014. Optimization of cellulase assisted extraction total flavonoids from broccoli using response surface method[J]. Journal of Sichuan Agricultural University,32(3):298-304.
戴余军,江德安,肖前清. 2010. NaOH溶液提取银杏叶总黄酮方法的研究[J]. 广东农业科学,37(1): 102-104.
Dai Y J,Jiang D A,Xiao Q Q. 2010. Study on extracting total flavone with NaOH from leaves of Ginkgo biloba L.[J]. Guang-
dong Agricultural Sciences,37(1):102-104.
杜敏華,张彩莹. 2007. 丝瓜叶中总黄酮的醇提工艺优化研究[J]. 食品工业科技,28(8):148-150.
Du M H,Zhang C Y. 2007. Optimum extracting technology of flavonoids in pumpkin leaves with ethanol[J]. Science and Technology of Food Industry,28(8):148-150.
冯宗帅,吴彩娥,方升佐,杨万霞,杨剑婷,李婷婷. 2009. 青钱柳叶总黄酮超声辅助提取工艺优化[J]. 农业机械学报,40(2):130-134.
Feng Z S,Wu C E,Fang S Z,Yang W X,Yang J T,Li T T. 2009. Technology optimization of total flavonoids extraction from Cyclocarya paliurus leaves by ultrasonic assistance[J]. Transactions of the Chinese Society for Agricultural Machinery, 40(2):130-134.
公衍玲,黄山,于慧荣. 2010. 垂盆草总黄酮的酶法提取及其抑菌活性[J]. 药学实践杂志,28(2):114-115.
Gong Y L,Huang S,Yu H R. 2010. Enzymatic extraction and antibacterial activity of total flavonoids from Sedum sarmentosum[J]. Journal of Pharmaceutical Practice,28(2):114-115.
李娟,张鲁刚,张昱. 2007. 橙色大白菜球叶总黄酮提取与测定方法的研究[J]. 园艺学报,34(4):923-928.
Li J,Zhang L G,Zhang Y. 2007. A study on extraction and determination of total flavonoids in orange colour Chinese cabbages[J]. Acta Horticulturae Sinica,34(4):923-928.
李南薇,刘长海,黄凯. 2011. 南瓜苗总黄酮的提取及清除自由基能力研究[J]. 食品科学,32(8):58-60.
Li N W,Liu C H,Huang K. 2011. Extraction and free radical scavenging activity of total flavonoids from pumpkin seedlings[J]. Food Science,32(8):58-60.
李睿,张力,包玉敏,刘妍. 2009. 地梢瓜叶中总黄酮的提取及含量测定[J]. 内蒙古民族大学学报(自然科学版),24(3):272-274.
Li R,Zhang L,Bao Y M,Liu Y. 2009. Extraction and determination of total flavone in leaf of Semen Cynanchi[J]. Journal of Inner Mongolia University for Nationalities(Natural Sciences),24(3):272-274.
梁梓,汪淑芳,范晶,刘忠,刘芳,张维敏,王容. 2012. 超声波辅助法对四川九节龙总黄酮提取工艺的研究[J]. 北方园艺,(4):156-158.
Liang Z,Wang S F,Fan J,Liu Z,Liu F,Zhang W M,Wang R. 2012. Study on the ultrasonic wave assisted extraction of total flavonoids from Ardisia pusilla[J]. Northern Horticulture,(4):156-158.
刘品华,金亚蓉,刘明研,陆仕蕊,张鸭关. 2014. 臭参地上部分总黄酮含量及抗氧化活性的研究[J]. 西南农业学报,27(5):1894-1898.
Liu P H,Jin Y R,Liu M Y,Lu S R,Zhang Y G. 2014. Total flavonoids and antioxidant activity of aerial parts of Codonopsis bulleyana[J]. Southwest China Journal of Agricultural Sciences,27(5):1894-1898.
宋利华,萧伟,鹿丽丽,王振中,姜华,张怡,朱克近. 2012. 正交试验优选人参多糖的提取工艺[J]. 中草药,43(2):283-287.
Song L H,Xiao W,Lu L L,Wang Z Z,Jiang H,Zhang Y,Zhu K J. 2012. Extracting technology optimization of polysaccharides from Panax ginseng by orthogonal test[J]. Chinese Traditional and Herbal Drugs,43(2):283-287.
王利珍,赵嫦玲,闫静,梁宏光,李彦威,林建英. 2011. 马铃薯皮总黄酮的提取及纯化[J]. 太原理工大学学报,42(6):598-602.
Wang L Z,Zhao C L,Yan J,Liang H G,Li Y W,Lin J Y. 2011. Study on extraction and purification process of total flavones from potato peel[J]. Journal of Taiyuan University of Technology,42(6):598-602.
王小華,邓斌,张晓军,龙石红. 2008. 南瓜叶黄酮类化合物提取条件的优化[J]. 化学工程师,22(12):1-3.
Wang X H,Deng B,Zhang X J,Long S H. 2008. Optimization of extracting condition of flavonoids from pumpkin leaves[J]. Chemical Engineer,22(12):1-3.
王艳丽,何煜波,曹晓宁,李惠婧. 2013. 辣椒叶中总黄酮提取工艺的优化[J]. 食品与机械,29(3):138-140.
Wang Y L,He Y B,Cao X N,Li H J. 2013. Comparison and optimization on extraction methods of flavonoids from chili leaves[J]. Food & Machinery,29(3):138-140.
尉芹,王冬梅,马希汉,张康健. 2001. 杜仲叶总黄酮含量测定方法研究[J]. 西北农林科技大学学报(自然科学版),29(5):119-123.
Wei Q,Wang D M,Ma X H,Zhang K J. 2001. A study on the measurement of flavonoids in the leaves of Eucommia ulmoides[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry,29(5):119-123.
杨海荣,田建林. 2009. 艾叶最佳采收时间及水法提取总黄酮工艺研究[J]. 安徽农业科学,37(23):10997-10998.
Yang H R,Tian J L. 2009. Study on the extraction technology by water method of total flavones from Chinese mugwort leaves and their optimum harvest time[J]. Journal of Anhui Agricultural Sciences,37(23):10997-10998.
尹鹏,郭新,梁梓,胡霞. 2015. 正交试验法优选旱芹叶总黄酮提取工艺[J]. 南方农业学报,46(6):1074-1078.
Yin P,Guo X,Liang Z,Hu X. 2015. Extraction process optimization of total flavonoids from celery leaves by orthogonal test[J]. Journal of Southern Agriculture,46(6):1074-1078.
张欣,曾光银. 2010. 南瓜瓤中总黄酮的提取及含量测定[J]. 安徽农业科学,38(36):20754-20755.
Zhang X,Zeng G Y. 2010. Extraction and determination of flavonoids in gourd pulp[J]. Journal of Anhui Agricultural Sciences,38(36):20754-20755.
张翔宇,谭兴和,蔡文,卢卡,张喻. 2015. 超声波协同酶法提取芹菜中总黄酮的工艺优化[J]. 中国酿造,34(1):50-53.
Zhang X Y,Tan X H,Cai W,Lu K,Zhang Y. 2015. Optimization of total flavonoids extraction technology from celery by ultrasonic-enzyme synergistic method[J]. China Brewing,34(1):50-53.
周宝利,李兴宝,李腾飞,赵莹,宋研,尚淼. 2012. 茄子果实中黄酮提取工艺优化及不同茄子品种黄酮含量比较[J]. 食品科学,33(10):103-106.
Zhou B L,Li X B,Li T F,Zhao Y,Song Y,Shang M. 2012. Optimization of extraction process for flavonoids from eggplants and content comparison of flavonoids in different eggplant cultivars[J]. Food Science,33(10):103-106.
周向军,高义霞,汪之波,张继. 2010. 响应面法优化西兰花总黄酮提取工艺的研究[J]. 资源开发与市场,26(6):488-489.
Zhou X J,Gao Y X,Wang Z B,Zhang J. 2010. Optimization of extraction technology of total flavonoids from Brassicaolera-
cea var. Italica using response surface analysis[J]. Resource Development & Market,26(6):488-489.
周志娥,熊建华,闵嗣璠,汤凯洁,罗秋水. 2011. 南瓜花黄酮超声波辅助提取工艺的研究[J]. 湖北农业科学,50(5):1023-1025.
Zhou Z E,Xiong J H,Min S F,Tang K J,Luo Q S. 2011. Study on ultrasonic-assisted extration process of total flavonoids in pumpkin flower[J]. Hubei Agricultural Sciences,50(5):1023-1025.
(责任编辑 罗 丽)
