剑麻斑马纹病菌多聚半乳糖醛酸酶Szpg6~Szpg10基因的分子检测及其序列分析
2016-05-28吴伟怀贺春萍郑金龙习金根郑肖兰梁艳琼刘巧莲李锐易克贤
吴伟怀,贺春萍,郑金龙,习金根,郑肖兰,梁艳琼,刘巧莲,李锐,易克贤*
(1.中国热带农业科学院环境与植物保护研究所/海南省热带农业有害生物检测监控重点实验室,海口 571101;2.中国热带农业科学院热带生物技术研究所,海口 571101)
剑麻斑马纹病菌多聚半乳糖醛酸酶Szpg6~Szpg10基因的分子检测及其序列分析
吴伟怀1,贺春萍1,郑金龙1,习金根1,郑肖兰1,梁艳琼1,刘巧莲2,李锐1,易克贤1*
(1.中国热带农业科学院环境与植物保护研究所/海南省热带农业有害生物检测监控重点实验室,海口 571101;2.中国热带农业科学院热带生物技术研究所,海口 571101)
摘要:斑马纹病是剑麻生产上最严重、毁灭性病害之一。本研究基于寄生疫霉菌多聚半乳糖醛酸酶pppg6 ~ pppg10等5个基因cDNA序列设计了各基因编码区的特异引物。利用5对引物分别对不同来源的剑麻斑马纹病菌DNA进行了分子检测。检测结果表明,在被检测的剑麻斑马纹病菌菌株中均存在与寄生疫霉菌多聚半乳糖醛酸酶pppg6 ~ pppg10对应的基因Szpg6 ~ Szpg10。基因序列比对分析表明,来自斑马纹病菌的Szpg6、Szpg8基因与对应pppg6、pppg8基因之间序列高度一致。比较而言,来自斑马纹病菌的Szpg7、Szpg9以及Szpg10基因与对应同源基因之间分别存在3、6及4个核苷酸序列差异,进而导致3、5及3个推定氨基酸的变异。由此推测,来自斑马纹病菌的Szpg7、Szpg9及Szpg10基因可能与对应基因在功能上存在着一定的差异。本研究为进一步研究剑麻斑马纹病菌多聚半乳糖醛酸酶在致病过程中的作用奠定了基础。
关键词:剑麻斑马纹病菌;多聚半乳糖醛酸酶;分子检测
由烟草疫霉(Phytophoranicotianaevar.parasitica或表示为Phytophoraparasiticavar.nicotianae)引起剑麻斑马纹病是剑麻生产上最严重的、毁灭性病害之一[1-2]。该病在我国华南各剑麻产区均有不同程度地发生,对剑麻的生产威胁很大,严重影响剑麻高产稳产[3-5]。如今该病仍然是各生产单位重点盯防的对象之一。针对此病害,国内专家学者相继开展了病原菌形态及鉴定[1-2, 6],生物学特性[7-8],流行因素以及防治[9- 10]等相关研究,而关于该病原菌的多聚半乳糖醛酸酶(Polygalaturonase, PG)的相关研究还鲜见报道。
植物细胞壁是寄主与病菌互作的重要场所,病菌定植于寄主植物表面后只有穿透细胞壁的屏障并与之建立了寄生关系,才能表现出致病性,在此过程中细胞壁降解酶发挥了极其重要的作用[11]。因此,研究植物病原菌是否能分泌对细胞壁起离析破坏作用的特异性酶,对于揭示其致病过程将具有重要的理论和实践意义。目前,已从寄生疫霉菌中克隆了PG基因pppg1 ~pppg10 共10个基因[12-13]。在前期研究发现斑马纹病菌PG基因Szpg1~Szpg5的编码区与寄生疫霉PG基因pppg1~pppg5对应基因序列具有高度的相似性,其氨基酸序列一致性均在90%以上。然而pppg6 ~pppg10基因在剑麻斑马纹病菌中存在情况以及同源性情况如何,仍然未知。为此,本研究拟以这些基因序列为参考序列设计特异引物,检测PG基因在剑麻斑马纹病菌中的存在情况,并对各基因编码区进行克隆与测序,为下一步研究剑麻斑马纹病菌PG在斑马纹病菌致病过程中的作用奠定基础。
1材料与方法
1.1材料
用于本实验的剑麻斑马病菌菌株共计35个,分别采集自广东、海南及广西剑麻种植地(表1)。
1.2方法
1.2.1菌丝体收集及DNA提取
各供试菌株于已灭菌的马铃薯葡萄糖液体培养基中,28℃ 160 rpm振荡培养6天后,对菌丝体收集与真空干燥。收集的各菌丝体于液氮中充分研磨后,采用DNA提取试剂盒(E.Z.N.A Fungal DNA kit, Omega 公司,美国)进行DNA提取。
1.2.2总RNA的提取与cDNA的合成
按TRIzol R试剂盒 (Gibco-BRL) 操作方法对于马铃薯葡萄糖液体培养中培养6天的剑麻斑马纹病原菌菌丝体进行总RNA提取。cDNA的反转录合成则利用反转录试剂盒SuperscriptTM III Reverse Transcriptase进行。
1.2.3引物设计与合成
利用软件primer5.0以寄生疫霉PG基因pppg6 ~pppg10序列为参考,于各基因编码区起始密码子处设计正向引物,并于终止密码子处设计反向引物。依据引物设计的一般原则,使预设引物序列长20~25 bp。设计好的引物序列委托英潍捷基(上海)贸易有限公司Invitrogen采用普通脱盐方式进行合成。各引物序列见表2。
表135个供试剑麻斑马纹菌株
Tab.135 isolates ofPhytophoranicotianaefrom sisal
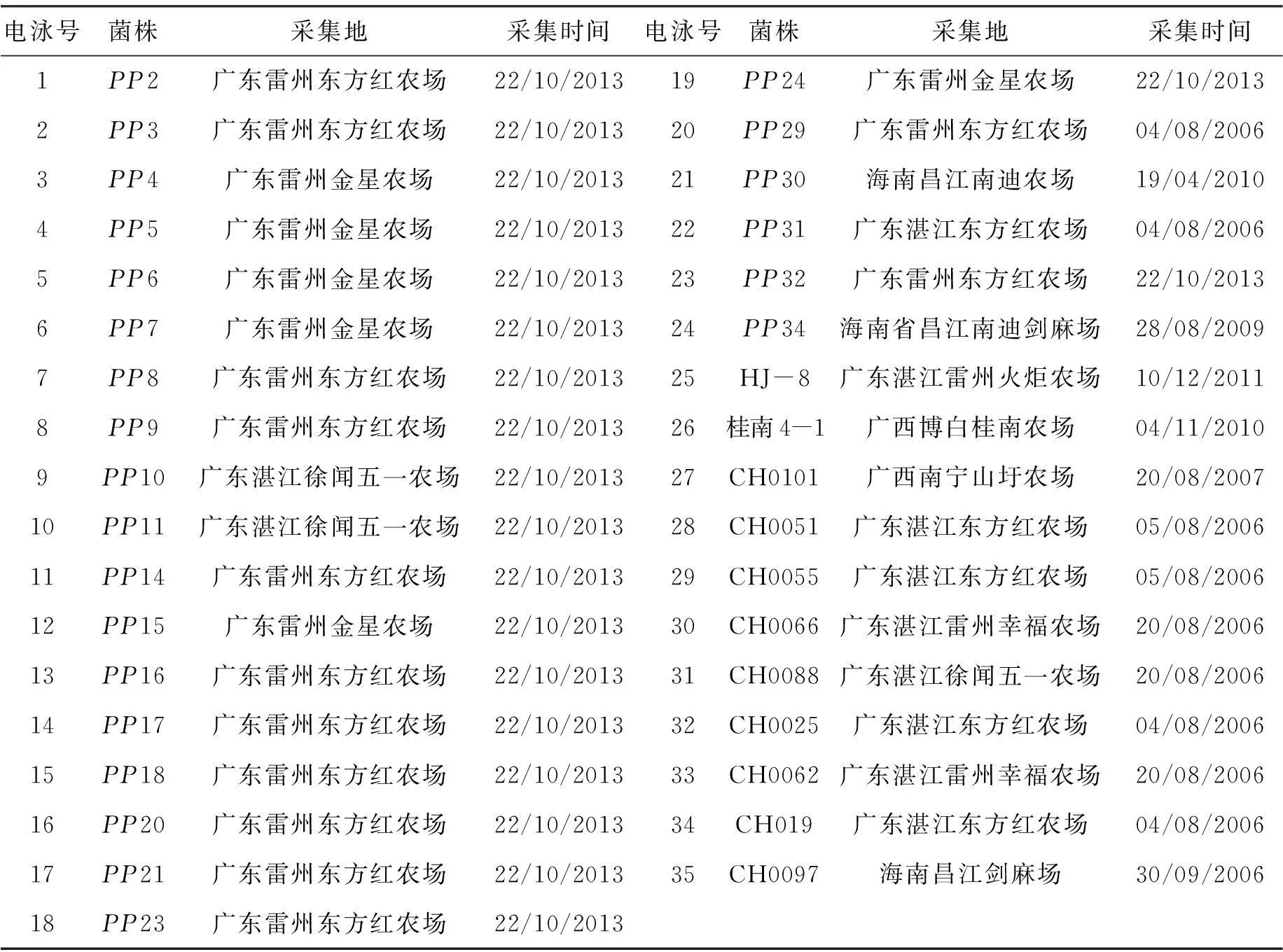
电泳号菌株采集地采集时间电泳号菌株采集地采集时间1PP2广东雷州东方红农场22/10/201319PP24广东雷州金星农场22/10/20132PP3广东雷州东方红农场22/10/201320PP29广东雷州东方红农场04/08/20063PP4广东雷州金星农场22/10/201321PP30海南昌江南迪农场19/04/20104PP5广东雷州金星农场22/10/201322PP31广东湛江东方红农场04/08/20065PP6广东雷州金星农场22/10/201323PP32广东雷州东方红农场22/10/20136PP7广东雷州金星农场22/10/201324PP34海南省昌江南迪剑麻场28/08/20097PP8广东雷州东方红农场22/10/201325HJ-8广东湛江雷州火炬农场10/12/20118PP9广东雷州东方红农场22/10/201326桂南4-1广西博白桂南农场04/11/20109PP10广东湛江徐闻五一农场22/10/201327CH0101广西南宁山圩农场20/08/200710PP11广东湛江徐闻五一农场22/10/201328CH0051广东湛江东方红农场05/08/200611PP14广东雷州东方红农场22/10/201329CH0055广东湛江东方红农场05/08/200612PP15广东雷州金星农场22/10/201330CH0066广东湛江雷州幸福农场20/08/200613PP16广东雷州东方红农场22/10/201331CH0088广东湛江徐闻五一农场20/08/200614PP17广东雷州东方红农场22/10/201332CH0025广东湛江东方红农场04/08/200615PP18广东雷州东方红农场22/10/201333CH0062广东湛江雷州幸福农场20/08/200616PP20广东雷州东方红农场22/10/201334CH019广东湛江东方红农场04/08/200617PP21广东雷州东方红农场22/10/201335CH0097海南昌江剑麻场30/09/200618PP23广东雷州东方红农场22/10/2013
表2pppg6 ~pppg10基因编码区特异引物序列及相关信息
Tab.2Specific primer sequences based onpppg6 ~pppg10 genes coding regions and related information

引物名称引物序列(5'-3')退火温度(℃)预期大小(bp)pppg6F/RF:ATGAAGCTTCTCACCGCAGR:TTAGCAGTTGACGCTGCTCGG601092pppg7F/RF:ATGAAAGTCCTCGCCCTCAC-TATCCR:TTAGCAGCTAATGCCACTAGGT-TCA631077pppg8F/RF:ATGAAGAACCTCTCCACCGCR:TTAGCACTTGGCGGTGCTGG621086pppg9F/RF:ATGAAGTTCGTCTACCCCGCCR:TTAGCAGCCTACTCCACTCGG601539pppg10F/RF:ATGAAGATCTTCGCA-CACTCTTTCR:TTAGCACTGTACGTTGCTCGGTC611176
1.2.4PCR扩增及程序
每个PCR反应体中,约含有20-30 ng DNA模板,10 μL 2×EcoTaq PCR SuperMix,正反向引物各0.5 μL(10.0 μM),最后用ddH2O补齐反应体系至20 μL。通过Mastercycler gradient Mastercycler PCR扩增仪进行扩增,其程序为:94℃预变性3 min;随后94℃变性30 s,60~65℃退火30 s(根据所用引物的Tm值确定退火温度),72℃延伸30 s,扩增35个循环;最后72℃延伸5 min,20℃保存。PCR扩增产物在1%的琼脂糖凝胶上进行电泳检测,凝胶成像系统照相记录。
1.2.5克隆与序列分析
取各基因PCR产物4 μL与pEASYTM Cloning Vector分别连接,转化大肠杆菌感受态细胞。用含氨苄青霉素的X-gal/IPTG/LB平板进行蓝白斑筛选,并随即各挑取5个白斑,利用通用引物M13F/R进行菌落PCR鉴定。经蓝白斑筛选后以及分子鉴定后,各选取3个阳性克隆子送英潍捷基(上海)贸易有限公司Invitrogen公司测序。获得的序列经人工去除载体序列后,利用DNAStar进行序列拼接。利用DNAStar software (www.DNAStar.com) 进行序列拼接与相关分析。蛋白质序列相似性分析则利用http://www.uniprot.org/uniprot/?query网站完成;蛋白质的理论等电点(Theoretical isoelectric points, pI)和分子量(molecular weights, Mw)计算利用Compute pI/ Mw工具(www.expasy.ch/tools/pi_tool.html[14])进行。
2结果与分析
2.1Szpg6 ~Szpg10 基因分子检测
5对基因特异引物,分别对35个剑麻斑马纹病菌供试DNA进行检测。检测结果表明,5对特异引物在35个供试菌株DNA中均扩增出单一条带。换而言之,引物pppg6F/R、pppg7F/R、pppg8F/R等从35个目标菌中均检测出单一条带,其大小均略大于1 kb,与预期大小比较一致(图1A-C;仅列出部分数据,下同);而引物pppg9F/R则从供试的35个模板中检测出约1.5 kb的特异条带(图1D)。与前4对引物结果相似,引物pppg10F/R也从供试的35个菌株DNA中检测出与预期大小一致的特异条带(数据未列出)。由此推测,Szpg6 ~Szpg10基因在剑麻斑马纹病菌菌中是普遍存在的。

M: DNA 分子标记DL2000;1~24:为电泳号。A,Szpg6基因分子检测;B,Szpg7基因分子检测;C,Szpg8基因分子检测; D,Szpg9基因分子检测
图1Szpg6 ~Szpg9基因的分子检测
Fig.1Molecular detection ofSzpg6 ~Szpg9 genes
2.2Szpg6 ~Szpg10 编码区基因结构及其序列比较分析
通过对各基因的cDNA序列与gDNA序列分析表明,Szpg6基因完整ORF为1092 bp,在第266处核苷酸处存在一个67 bp的内含子。推断基因产物由363个氨基酸残基组成,估计等电点为5.44, 分子量3.75 kDa。与寄生疫霉PG基因pppg6的序列相比,Szpg6基因在编码区存在1个同义核苷酸突变,其氨基酸序列一致性水平为100%(图2A)。
Szpg7基因完整ORF为1077 bp,推断基因产物由358个氨基酸残基组成,估计等电点为4.04,分子量为3.71 kDa。与寄生疫霉PG基因pppg7的序列相比,Szpg7基因在编码区存在3个核苷酸差异,且均为非同义突变,最终导致S19P、S27P、G345D等3处氨基酸变化,其氨基酸序列一致性水平为99.16%(图2B)。
Szpg8基因完整ORF为1086 bp,推断基因产物由361个氨基酸残基组成,估计等电点为9.54,分子量为3.74 kDa。与寄生疫霉PG基因pppg8的序列相比,在Szpg8基因编码区存在1个核苷酸差异,且为同义突变,其氨基酸序列一致性水平为100% (数据未显示)。
Szpg9基因完整ORF为1539 bp, 推断基因产物由512个氨基酸组成,估计等电点为4.00,分子量5.20 kDa。与对应寄生疫霉PG基因pppg9的序列相比存在6个核苷酸差异,其中5处为非同义突变,其氨基酸序列一致性水平为99.02%。最终导致L246P、G367S、V406I、D454V以及M490T等5处氨基酸变异(图2C)。
Szpg10基因完整ORF为1176 bp,在第349 bp核苷酸处存在一个66 bp的内含子,推断基因产物由391个氨基酸组成,估计分子量4.13 kDa,等电点为5.23。与pppg10基因的序列相比,Szpg10基因在编码区存在4个核苷酸变异,其中3处为非同义突变,其氨基酸序列一致性水平为99.23%。最终导致V129D、I174V、D345G等3处氨基酸变异(图2D)。
总之,来自剑麻斑马纹病菌Szpg6 ~Szpg10基因编码区序列与寄生疫霉PG基因pppg6 ~pppg10对应基因之间同源性十分高,对应氨基酸序列一致性均在99%以上。

图2A Szpg6基因与pppg6基因之间推定氨基酸序列比较

图2B Szpg7基因与pppg7基因之间推定氨基酸序列比较

图2C Szpg9基因与pppg9基因之间推定氨基酸序列比较

图2D Szpg10基因与pppg10基因推定氨基酸序列比较
3讨论
近年来,已从不同植物病原菌中分离出多种PG, 并对其生化特性等进行了较为详尽地研究。综观现有研究结果,针对PG在致病过程中的作用主要存在如下几类观点,一是认为PG作为一种致病因子,在侵染寄主过程中起着非常重要的作用[15]。然而,通过生物技术与遗传操作技术使PG基因突变并非总是证明PG在真菌致病过程中的作用是必需的[16- 17]。除此之外,也有研究结果支持PG除了作为细胞壁降解酶与毒性因子之外,还可以通过释放寡聚半乳糖醛酸作为一种无毒因子,从而激发寄主的防御反应[18]。对于上述“矛盾”的结果而言,一个合理的解释即PG基因在真菌中存在多基因家系,即在侵染过程中,每个基因仅执行一个有限的生物学功能[13]。事实也已证明,目前已经鉴定的许多致病真菌的PG基因,其都不是单基因,而是以多基因的形式存在。最近的研究表明,引起灰霉病的灰葡萄病菌中,至少包含6个编码PG的基因,只是在与寄主互作过程中具有不同表达或是其生长需要不同的碳源[19-20]。而菌核病菌能分泌多种不同表达模式的endoPG。其中在健康植株组织中sspg1 (Sclerotiniasclerotiorumpolygalacturonase1),sspg2、sspg3被上调,sspg5则是在最后侵渍阶段被诱导;相比之下,sspg6与sspg7在整个侵染过程中稳定表达[21- 22]。总之,endoPG基因往往以簇形式存在,其成员也具有不同功能。
目前,研究结果表明,寄生疫霉endoPG基因事实上为一个多基因家系,除了pppg1之外,至少还包含pppg2 ~pppg10等9个基因[12-13]。本研究利用同源法对剑麻斑马纹病菌中细胞壁降解霉基因Szpg6 ~Szpg10的编码区进行了分子检测以及序列比较分析。实验结果表明,细胞壁降解霉基因Szpg6~Szpg10在剑麻斑马纹病菌中普遍存在,其基因序列与寄生疫霉pppg6 ~pppg10对应基因序列具有高度的相似性,其氨基酸序列一致性均在99%以上。结合先前已报道的剑麻斑马纹Szpg1~Szpg5的结果[23],由此可见,在剑麻斑马纹病菌中至少存在由10个基因组成的细胞壁降解霉基因家系。
根据已有的表达实验表明,寄生疫霉基pppg7于本生烟表达10天后显示轻微银叶症状,而pppg10则导致本生烟叶产生明显的黄化与矮小[13]。在本研究中,除pppg6与pppg8之外,在Szpg7、Szpg9及Szpg10基因与对应基因之间均存在核苷酸差异。分别到达了3、6及3个,其中3、5及3个为非同义突变。这些推定氨基酸的变异,是否导致功能上的变化还有待进一步地实验。
参考文献:
[1]陈锦平,刘清芬. 龙舌兰麻杂种11648 斑马纹病的分布及其病原的研究[J]. 热带作物研究,1980 (2): 122-129.
[2]陈锦平,刘清芬. 龙舌兰麻杂种11648 斑马纹病病原烟草疫霉菌 (PhytophthoranizotianaeBreda)生物学及形态特征的初步研究[J]. 热带作物学报,1982,3(1):65-70.
[3]陶玉兰. 再论 H.11648 麻斑马纹病的发生及防治措施[J]. 广西热作科技,1996 (2):12-15.
[4]李莲英. 五星农场更新麻园斑马纹病调查分析[J]. 广西农业科学,2003 (5): 47-48.
[5]赵艳龙,何衍彪,詹儒林. 我国剑麻主要病虫害的发生与防治[J]. 中国麻业科学,2007,29(6):334-338.
[6]郑金龙,高建明,张世清,等. 剑麻斑马纹病病原鉴定[J]. 东北农业大学学报,2011,42(12): 59-64.
[7]郑金龙,刘巧莲,陈鸿,等. 剑麻斑马纹病病原菌生物学特性初步研究[J]. 热带农业科学,2008,28(6):15-18.
[8]赵艳龙,周文钊,张燕梅,等. 剑麻斑马纹病菌生长和产孢方法的研究[J]. 广东农业科学,2012 (5): 71-73.
[9]黄标,符清华. H.11648 麻茎腐病发生规律及防治研究[J]. 热带作物研究,1990 (3):38-45.
[10]张礼钢,王锦国. 剑麻的病虫害综合防治技术与方法的研究[J]. 中国农机化,2010 (3):40-42.
[11]Lionetti V, Francocci F, Ferrari S, et al. Engineering the cell wall by reducing de-methyl-esterified homogalacturonan improves sacchareification of plant tissues for bioconversion[J]. Proc Natl Acad SciUSA, 2010, 107:616-621.
[12]Yan HZ, and Liou RF. Cloning and analysis ofpppg1, an inducible endopolygalacturonase gene from the oomycete plant pathogenPhytophthoraparasitica[J]. Fungal Genet Biol, 2005, 42: 339-350.
[13]Wu CH, Yan HZ, Liu LF, et al. Functional characterization of a gene family encoding polygalacturonases inPhytophthoraparasitica[J]. Mol Plant- Microbe Interact, 2008, 21(4): 480-489.
[14]Gasteiger E, Hoogland C, Gattiker A, et al. (In) John M. Walker (ed) The proteomics protocols handbook[M]. Humana Press, 2005:571-607.
[15]Sanchez L. M., Doke N, Ban Y, et al. Involvement of suppressor-glucans and plant epidermal cells in host-selective pathogenesis ofPhytophthoracapsici[J]. Journal of Phytopathology, 1994, 140: 153-164.
[16]Bowen JK, Templeton MD, Sharrock KR, et al. Gene inactivation in the plant pathogen Glomerella cingulata: three strategies for the disruption of the pectin lyase genepnlA[J]. Mol Gen Genet, 1995, 246:196-205.
[17]Rogers LM, Kim YK, Guo WJ, et al. Requirement for either a host- or pectin-induced pectate lyase for infection ofPisumsativumbyNectriahematococca[J]. Proc Natl Acad Sci USA, 2000, 97: 9813-9818.
[18]Boudart G, Charpentier M, Lafitte C, et al. Elicitor activity of a fungal endopolygalacturonase in tobacco requires a functional catalytic site and cell wall localization[J]. Plant Physiol, 2003, 131:93-101.
[19]Wubben JP, ten Have A, van Kan JA, et al. Regulation of endopolygalacturonase gene expression inBotrytiscinereaby galacturonic acid, ambient pH and carbon catabolite repression[J]. Curr Genet, 2000, 37:152-157.
[20]ten Have A, Breuil WO, Wubben JP, et al.Botrytiscinereaendopolygalacturonase genes are differentially expressed in various plant tissues[J]. Fungal Genet Biol, 2001, 33: 97-105.
[21]Kasza Z, Vagvolgyi C, Fevre M, et al. Molecular characterization and in planta detection ofSclerotiniasclerotiorumendo- polygalacturonase genes [J]. Curr Microbiol, 2004, 48:208-213.
[22]Li R, Rimmer R, Buchwaldt L, et al. Interaction ofSclerotiniasclerotiorumwith Brassica napus: Cloning and characterization of endo- and exo-polygalacturonases expressed during saprophytic and parasitic modes[J]. Fungal Genet Biol, 2004, 41:754-765.
[23]吴伟怀,梁艳琼,郑金龙,等.剑麻斑马纹病菌5个多聚半乳糖醛酸酶基因的克隆与序列分析[J].热带作物学报,2015,36(12):2204-2209.
Molecular Detection and Sequence Analysis of PolygalacturonaseSzpg6 toSzpg10 Gene of Zebra Disease of Sisal
WU Weihuai1, HE Chunping1, ZHENG Jinlong1, XI Jingen1, ZHENG Xiaolan1,LIANG Yanqiong1, LIU Qiaolian2, LI Rui1, YI Kexian1*
(1.Environment and Plant Protection Institute, CATAS/Hainan Key Laboratory for Detection and Control of Tropical Agricultural Pests, Haikou 571101,China;2.Institute of Tropical Bioscience and Biotechnology, CATAS, Haikou 571101, China)
Abstract:Sisal zebra disease caused by Phytophora nicotianae var. parasitica is a kind of main diseases which can cause serious damage to the sisal. In the present study, five specific primer pairs were designed in coding region based on the reference sequence of pppg6 to pppg10 gene from Phytophora parasitic. Five specific primer pairs were used for the molecular detection and gene cloning from sisal zebra pathgoen DNA. The results showed that Szpg6 (sisal zebra polygalacturonase 6) to Szpg10 genes were conserved in all the tested sisal zebra isolates. Sequence alignment with the reference sequences of pppg6 to pppg10 gene from Phytophora parasitic revealed that 1, 3, 1, 6 and 4 SNPs were identified in the Szpg6 to Szpg10 genes coding regions, respectively. There, five and three of these mutations were nonsynonymous in Szpg7, Szpg9 and Szpg10, and the rest were synonymous. Thus we speculated that there were some differences in function when Szpg7, Szpg9 and Szpg10 genes were compared to pppg7, pppg9 and pppg10. The results have laid a solid foundation for the further study of the role of sisal zebra germs polygalaturonase in the pathogenic process.
Key words:zebra disease of sisal; polygalaturonase; molecular detection
中图分类号:S563.8
文献标识码:A
作者简介:吴伟怀(1977-), 男,博士,副研究员,研究方向:植物病理。E-mail: weihuaiwu2002@163.com。*通讯作者:易克贤(1964-),男,博士,研究员,研究方向:分子抗性育种。E-mail: yikexian@126.com。
基金项目:海南省自然科学基金项目(314105);现代农业产业技术体系(CARS-19);中央级公益性科研院所基本科研业务费专项 (NO.2014hzs1J012);中国热带农业科学院环植所自主选题项目(2013hzsJY04)
收稿日期:2015-12-10
文章编号:1671-3532(2016)02-0062-07
