脓毒症患者发生急性肝功能障碍诱因的多因素回归分析
2016-05-23姜丽静倪金迪孙英杰李响
姜丽静 倪金迪 孙英杰 李响
201199 上海 复旦大学附属闵行医院重症监护室
脓毒症患者发生急性肝功能障碍诱因的多因素回归分析
姜丽静倪金迪孙英杰李响
201199上海复旦大学附属闵行医院重症监护室
【摘要】目的运用多因素回归分析,明确脓毒症患者发生急性肝功能障碍(AHD)的诱因,为脓毒症患者AHD的防治提供参考依据。方法回顾性分析我院2008年9月—2015年9月收治的395例脓毒症患者临床资料,按照其AHD发生情况分为AHD组与非AHD组,分析脓毒症患者AHD发生率,运用多因素Logistic回归分析,了解脓毒症患者发生AHD的危险因素,分析诱因,提出防治策略。结果395例患者中,共确诊AHD患者85例,AHD发生率21.5%,患者AHD发病时间为入院后1.9~127.5 h,平均(62.9±14.1)h,其病死率为38.8%(33/85),显著高于非AHD患者的6.1%(19/310),差异有统计学意义(P<0.05)。多因素回归分析结果显示,年龄≥75岁、酒精成瘾史、合并糖尿病、合并慢性心功能不全、APACHE Ⅱ评分≥20分是影响脓毒症患者发生AHD的独立危险因素,差异有统计学意义(P<0.05)。结论脓毒症患者发生AHD的诱因包括高龄、酗酒、合并糖尿病、合并慢性心功能不全及APACHE Ⅱ评分≥20分等,针对存在上述诱因的脓毒症患者实施全面监测及干预是降低病死率、改善预后的关键。
【关键词】脓毒症;急性肝功能障碍;诱因;多因素回归分析
脓毒症是由感染、休克、严重创伤、手术等因素引发的一类合并感染的全身炎性反应综合征(SIRS),随着病程的蔓延,脓毒症可发展至严重脓毒症,并出现脓毒症休克、多器官功能障碍综合征(MODS)等严重后果[1]。肝脏是人体最大的解毒器官,也是脓毒症最常累及的器官之一。一般而言,脓毒症患者均伴随着不同程度的肝脏损伤,但患者一旦出现急性肝功能障碍(AHD),其脓毒症进展速度往往大大增加,进而导致患者病死率上升、住院时间增加、经济负担增长[2]。因此,早期明确患者肝功能障碍程度,是预防AHD发生、改善患者预后的关键,但目前临床常用的血清胆红素、转氨酶水平或碱性磷酸酶活性等指标均无法精确评价患者肝功能障碍程度及演变过程[3]。为此,本研究对脓毒症患者发生AHD的诱因进行了多因素回归分析,旨在为高危AHD患者的筛选提供参考。
资料和方法
一、病例资料
选取复旦大学附属闵行医院2008年9月—2015年9月收治的395例脓毒症患者,进行回顾性分析。选取标准:(1)参照国际脓毒症会议制定的诊断标准确诊[4]:在SIRS基础上,临床及微生物检查明确感染证据。(2)于我院重症监护室(ICU)接受相关治疗,住院时间≥7 d。(3)临床资料完整。排除标准:(1)合并上消化道出血、慢性肝脏疾病、梗阻性黄疸。(2)有急性肝功能衰竭或慢性肝功能障碍史。(3)有免疫抑制剂使用史。(4)住院资料完整性不满足研究要求。395例患者中,男241例,女154例,年龄27~81岁,平均(72.40±18.37)岁。
二、研究方法
(一)患者分组参照Marshall中关于AHD的诊断标准[5],将总胆红素(TBil)>34 μmol/L、转氨酶>2倍正常值上限或出现肝性脑病的患者纳入AHD组,将不符合AHD诊断标准的患者纳入非AHD组,计算395例脓毒症患者AHD发生率。
(二)诱因分析采用回顾性分析方法,设计统一调查表格,比较两组患者病历资料中年龄、性别、体质量指数(BMI)、吸烟史、酒精成瘾史、疾病史、合并症、感染部位、临床表现、治疗情况、急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)差异,并将存在统计学差异的因素纳入Logistic多因素回归分析,总结影响脓毒症患者发生AHD的危险因素。
三、统计学分析
结果
一、AHD发病率
395例患者中,共确诊AHD患者85例,AHD发生率21.5%,患者AHD发病时间为入院后1.9~127.5 h,平均(62.9±14.1)h,其病死率为38.8%(33/85),显著高于非AHD患者的6.1%(19/310),差异有统计学意义(P<0.05)。
二、临床资料比较
临床资料比较结果显示,两组患者年龄、酒精成瘾史、合并糖尿病、合并慢性心功能不全及APACHE Ⅱ评分比较,差异有统计学意义(P<0.05)。见表1。

表1 AHD患者与非AHD患者临床资料比较(例数,%)
续表1
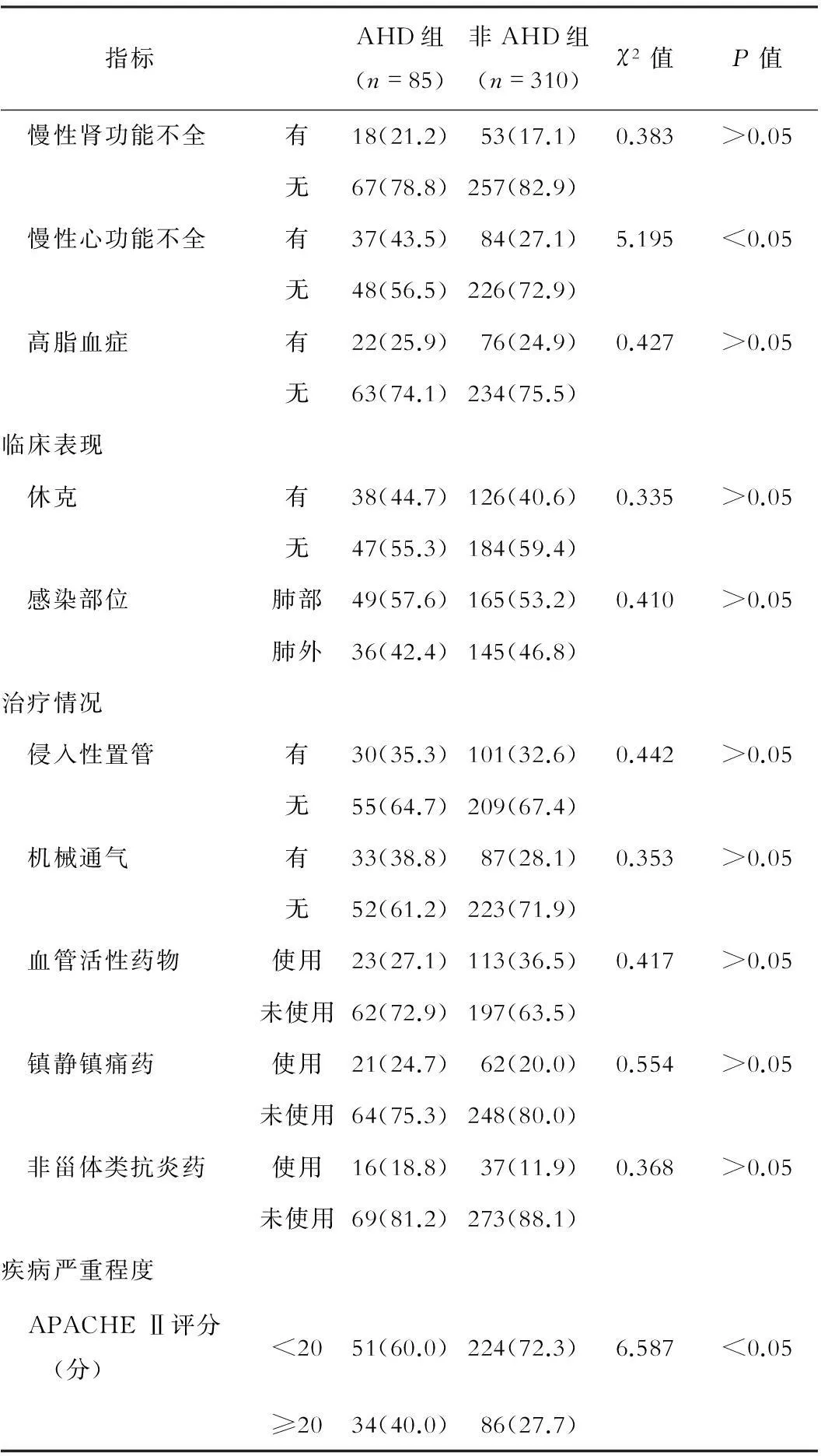
指标AHD组(n=85)非AHD组(n=310)χ2值P值 慢性肾功能不全有18(21.2)53(17.1)0.383>0.05无67(78.8)257(82.9) 慢性心功能不全有37(43.5)84(27.1)5.195<0.05无48(56.5)226(72.9) 高脂血症有22(25.9)76(24.9)0.427>0.05无63(74.1)234(75.5)临床表现 休克有38(44.7)126(40.6)0.335>0.05无47(55.3)184(59.4) 感染部位肺部49(57.6)165(53.2)0.410>0.05肺外36(42.4)145(46.8)治疗情况 侵入性置管有30(35.3)101(32.6)0.442>0.05无55(64.7)209(67.4) 机械通气有33(38.8)87(28.1)0.353>0.05无52(61.2)223(71.9) 血管活性药物使用23(27.1)113(36.5)0.417>0.05未使用62(72.9)197(63.5) 镇静镇痛药使用21(24.7)62(20.0)0.554>0.05未使用64(75.3)248(80.0) 非甾体类抗炎药使用16(18.8)37(11.9)0.368>0.05未使用69(81.2)273(88.1)疾病严重程度 APACHEⅡ评分(分)<2051(60.0)224(72.3)6.587<0.05≥2034(40.0)86(27.7)
三、脓毒症患者发生AHD的诱因分析
多因素回归分析结果显示,年龄≥75岁、酒精成瘾史、合并糖尿病、合并慢性心功能不全、APACHE Ⅱ评分≥20分是影响脓毒症患者发生AHD的独立危险因素,差异有统计学意义(P<0.05)。见表2。
讨论
脓毒症是危急重症患者常见的并发症之一,是引发MODS的主要病因,也是导致患者原发病加重、病死风险上升的始动因素[6]。最新研究表明,由于肝细胞和肝脏巨噬细胞具有较强的急性时相蛋白、细胞因子合成及释放作用,其结构、功能和代谢变化在脓毒症病情发展及向MODS转化的过程中扮演了重要角色[7]。因此,一旦脓毒症患者出现肝功能严重受损甚至AHD,其病死率大大增加。故早期识别脓毒症患者AHD的诱因,是指导预防干预策略、降低AHD发生率及患者病死率的关键[8]。
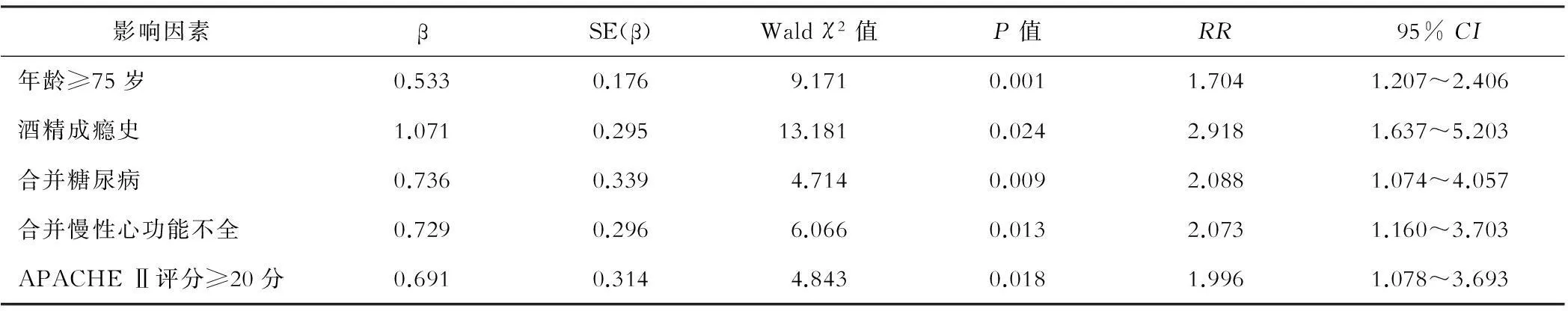
表2 影响脓毒症患者发生AHD的多因素回归分析结果
在本研究中,对395例脓毒症患者进行了回顾性分析,发现其AHD发生率为21.5%,病死率高达38.8%,与过往研究一致,进一步表明了AHD对脓毒症患者预后及病死率的预警作用[9]。传统观点认为,循环、肾脏、中枢神经系统变化是脓毒症患者病死的危险因素[10],但本研究并未得到这一结论,考虑与肝功能障碍并非晚发器官功能不全,多发生于脓毒症患者病程早期有关。因此,通过对AHD的预测不仅能够判断患者病死风险,亦可在循环、肾脏等组织器官发生病变前,指导早期防治策略的制定与实施。
通过多因素回归分析,研究者发现,年龄≥75岁、酒精成瘾史、合并糖尿病、合并慢性心功能不全、APACHE Ⅱ评分≥20分是影响脓毒症患者发生AHD的独立危险因素,其原因为:(1)年龄≥75岁的高龄脓毒症患者往往基础状态较差,免疫功能低下,致病病原微生物及其产物、腹腔内菌群易发生移位,对肝脏造成直接损害;(2)有酒精成瘾史的患者,其机体对炎性介质的敏感度上升、对氧化产物的清除能力下降,同时作为乙醇和药物代谢的主要场所,肝脏在受长期酒精刺激后,往往存在线粒体肿胀、溶酶体破坏及释放状态,对急性损伤的代偿能力较弱[11,12];(3)一般而言,合并糖尿病的患者机体胰岛功能低下或处于胰岛功能拮抗状态,血糖水平较高,而Fernández等[13]指出,一旦发生内毒素入侵,处于高血糖状态下的机体更易出现肝组织促炎细胞因子水平上升,并伴随内皮细胞一氧化氮(NO)合成功能减弱,往往导致炎性反应更难控制,肝组织损害明显加重;(4)合并慢性心功能不全患者肝组织已处于明显浸润、淤血状态,脓毒症的发生、发展可导致机体储备能力和代偿功能急剧下降,最终导致肝脏血流灌注显著降低,由于肝组织对缺血、缺氧状态敏感度较高,血流灌注的下降极易引发肝细胞功能障碍的发生[9];(5)APACHE Ⅱ评分≥20分者多处于严重感染、低灌注状态,大量细胞因子及炎性介质的释放可进一步引发肝微血管舒缩功能紊乱,导致血液淤滞、肝窦纤维蛋白沉积、微血管形成,对肝组织造成明显损伤。此外,Jalan等[14]研究发现,APACHE Ⅱ评分的升高往往伴随着肝库弗普细胞清除自由基能力下降,自由基的大量聚积可显著加剧肝细胞损伤过程。
因此,可以提示,高龄、既往史、合并症及疾病状态均在脓毒症患者发生AHD的过程中扮演了重要角色,针对存在上述诱因的患者,应予以早期全面监测,适时实施重症监护及器官功能支持,以降低AHD发生率,并对发生AHD的患者及时实施救治,最终达到改善患者预后及生存质量的目的。
参考文献
1 Roderburg C, Benz F, Vargas Cardenas D, et al. Elevated miR-122 serum levels are an independent marker of liver injury in inflammatory diseases. Liver Inl, 2015, 35: 1172-1184.
2 马晓春. 应提高对脓毒症肝损伤的认识. 中华危重病急救医学, 2013, 25:198-200.
3 Petrowsky H, Rana A, Kaldas F M, et al. Liver transplantation in highest acuity recipients: identifying factors to avoid futility. Ann Surg, 2014, 259: 1186-1194.
4 翁志雄, 余志金, 龙国清, 等. 脓毒症患者肝功能变化与病情严重度及预后的关系. 中国现代医生, 2013, 51: 31-33.
5 吴吟, 任建安. 氧化应激在脓毒症导致的肝损伤中的作用. 中国实用外科杂志, 2014, 34: 187-189.
6 Cordoba J, Ventura-Cots M, Simón-Talero M, et al. Characteristics, risk factors, and mortality of cirrhotic patients hospitalized for hepatic encephalopathy with and without acute-on-chronic liver failure (ACLF). J Hepatol, 2014, 60: 275-281.
7 Nath B, Szabo G. Hypoxia and hypoxia inducible factors: diverse roles in liver diseases. Hepatology, 2012, 55: 622-633.
8 赵伟, 何新飙. 脓毒症诱发急性肝功能障碍患者的危险因素和临床特征分析. 中华急诊医学杂志, 2012, 21: 61-64.
9 Calkins K, Lowe A, Shew SB, et al. Short-term intravenous fish oil and pediatric intestinal failure associated liver disease: 3-year follow-up on liver function and nutrition. J Pediatr Surg, 2013, 48: 228-232.
10Sadamori H, Yagi T, Shinoura S, et al. Risk factors for major morbidity after liver resection for hepatocellular carcinoma. Br J Surg, 2013, 100: 122-129.
11张剑, 楼天正, 张宁. 脓毒症的肝功能障碍发病机制及诊治研究. 中华急诊医学杂志, 2014, 23: 1183-1185.
12张海霞, 吴先正, 杨长青, 等. 脓毒症患者肝功能损伤与病情严重程度及预后的相关性研究. 检验医学与临床, 2015, 12: 204-206.
13Fernández J, Acevedo J, Castro M, et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology, 2012, 55: 1551-1561.
14Jalan R, Gines P, Olson JC, et al. Acute-on chronic liver failure. J Hepatol, 2012, 57: 1336-1348.
(本文编辑:易玲)
(收稿日期:2015-02-20)
通信作者:李响,Email:18917104725@189.cn
·临床与基础研究·
