治理环境、绿色发展
2016-05-14刘辉惠
刘辉惠
一、两会热点解读——治理环境、绿色发展
如今,一边是严峻突出的雾霾、污水等环境污染问题,一边是群众对“APEC蓝”“阅兵蓝”常态化的满怀期待。如何促进形成绿色生产方式和消费方式,如何“统筹生产、生活、生态三大布局”,进行一场彻底的能源革命(energy revolution),成了2016年全国两会重点讨论的议题。环境污染和环境保护问题必将成为重要的化学命题素材。能源的开发与利用情况关系到世界能否实现可持续发展,这一问题也必将成为各类化学命题的热点。
二、命题分类例析
1.饮水思危——水污染及其防治。
例1 2016年全国两会提出“要加强顶层设计,将法律、行政、经济等多种手段并举,才能有效治理环境污染”。某一池塘附近一些工厂和居民经常向池塘中排放工业废水和生活废水。经检测,池塘中汞、镉等重金属严重超标,氮、磷等大量富集,水体处于严重缺氧状态,致使鱼类等生物大量死亡,其尸体在微生物的作用下分解产生难闻的气味(硫化氢、氨气等)。化学需氧量(COD)是水体质量的控制项目之一,它是量度水中还原性污染物的重要指标。COD是指用强氧化剂(我国采用K2Cr2O7)处理一定量水样所消耗的氧化剂的量,并换算成以O2作为氧化剂时,1L水样所消耗O2的质量(mg·L-1。试回答下列问题:
(1)N、P是生物体内必需的元素,为什么池塘中N、P含量过高反而会污染水质?____。
(2)对人体有害的含氮污染物的主要形式是____。
A.NO-2B.NO-3C.NH+4D.有机氮
(3)现取该池塘中的水样20.00 mL,加入10.00mL 0.040 mol·L-的K2Cr2O7溶液,并加入适量催化剂,加热反应后,用12.00 mL 0.10 mol·L-1的Fe(NH4)2(SO4)2溶液滴定多余的K2Cr2O7溶液。若K2Cr2O7在酸性溶液中作氧化剂时被还原成CP3+,而Fe(NH4)2(SO4)2中的Fe2+被氧化成Fe3+。则该池塘水样的COD为____。
解析 (1)池塘中的N、P含量过高,浮游植物会因吸收大量N、P而过度繁殖,浮游动物也会因浮游植物的增多而迅速增加,它们因呼吸作用会消耗大量的氧气,使水体严重缺氧,致使鱼类等生物因氧不足而死亡、腐败,污染了水质。(2)对人体有害的含氮污染物的主要形式是NO-2。(3)①先算出剩余K2Cr2O7溶液的体积,由6Fe2++Cr2O2-7+14H+=6Fe3++2Cr3++7H2O,得(0.10 mol·L-1×12.00 mL):(0.040 mol·L-1×z)=6:1,解得x=5.00 mL。则用以氧化有机物的K2Cr2O7为10.00mL-5.00mL=5.00mL。②再算出用K2Cr2O7溶液处理该水样时的耗氧量相当于用多少物质的量的O2处理该水样的耗氧量。1 mol K2Cr2O7~2 mol Cr3+得到6 mol e-,而1 mol O2~2 mol O2-得到4 mol e-,则消耗1 mol K2Cr2O7相当于消耗1.5 mol O2。故20.00 mL水样中,还原性有机物的需氧量为5.00×10-3L×0.040 tool·L-1×1.5=3.00×10-4mol。1 L水样所消耗O2的质量(mg·L-1)为3.00×10-4×32×50×103(mg·L-1)=480 mg·L-1。
答案:(1)池塘中的N、P含量过高,浮游植物因吸收大量N、P而生长旺盛,浮游动物也因浮游植物的增多而迅速增加,它们因呼吸作用会消耗大量的氧气,使水体严重缺氧,导致鱼类等生物因氧不足而死亡、腐败,污染了水质 (2)A (3)480 mg·L-1
2.忍气吞声——大气污染及其防治。
例2 2016年全国两会报告中提出“深入实施大气、水、土壤污染防治行动计划,加强生态保护和修复”。就我国来说,随着人民生活水平的不断提高,机动车的使用量大幅增加,但其尾气污染却不能不引起人们的注意。新型环保出租车采用“LPG(液化石油气)+汽油”的双燃料系统,其尾气中的有毒气体成分较单独使用汽油作燃料的出租车下降80%左右,一定程度上减轻了汽车尾气造成的污染问题。下列物质中不属于上述有毒气体的是( )。
A.CO2和H2B.NO2和NO
C.CO和SO2D.碳粒和含铅化合物
解析 汽车尾气的主要成分是CO2、NOx、CO、SO2、碳粒、含铅化合物等,其中CO2目前还不算污染物。汽车尾气中不存在H2。本题选A。
3.寸土必复——土壤污染及其防治。
例3 2016年全国两会报告中提出“要深入实施土壤污染防治行动计划,加强生态保护和修复”。一节一号电池烂在地里,能够使1m2的土地失去利用价值。我们日常所用的普通干电池,主要有酸性锌锰电池和碱性锌锰电池两类,它们都含有汞、锰、镉、铅、锌等金属,废旧电池被遗弃后,电池的外壳会慢慢被腐蚀,电池中的重金属会逐渐渗入水体和土壤,造成污染。两种锌锰电池的构造如图1a所示。请回答下列问题:
(1)普通锌锰电池放电时发生的反应主要为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。
①该电池中,负极材料是___,电解质是____,正极发生的反应是____。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是____。
(2)图1b表示回收利用废旧普通锌锰电池的工艺(不考虑废旧电池中实际存在的少量其他金属)。
①A为____,B为____。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑色固体,该反应的离子方程式为____。
解析 (1)由两种锌锰电池的构造图,结合普通锌锰电池放电时发生的主要反应可知,该电池中,负极材料是Zn,电解质是NH4Cl,正极发生的反应是2MnO2+2NH+4+2e-=2MnOOH+2NH3。与普通锌锰电池相比,碱性锌锰电池的优点主要是不易发生电解质的泄露,使用寿命较长。(2)由图b可知黑色固体混合物为Zn(NH3)2Cl2和MnOOH,经水浸、过滤后,滤液为Zn(NH3)2Cl2溶液,滤渣为MnOOH,滤液经酸化、浓缩结晶、过滤得到ZnCl2、NH4Cl固体。加热NH4c1固体分解生成NH3和HCl,冷却,NH3和HCl又反应生成NH4Cl固体(化合物B),剩余的为ZnCl2(化合物A)。操作a中得到熔块的主要成分是K2MnO4。操作b中绿色的K2MnO4溶液反应后生成紫色溶液(KMnO4)和一种黑色固体(MnO2)。
答案:(1)①Zn NH4Cl 2MnO2+2NH+4+2e-=2MnOOH+2NH3②不易发生电解质的泄露,因为消耗的负极改装在电池的内部;使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高 (2)①ZnCl2NH4Cl ②3MnO2-4+2CO2=2MnO-4+MnO2↓+2CO2-3
4.绿色发展——新能源的开发和利用。
例4
2016年全国两会提出“推动形成绿色发展方式和生活方式(green develop-ment and living models),让人人在蓝天下呼吸”。实现这一目标的关键是要节能减排并发展清洁替代能源。请回答下列问题:
(1)氢气是一种清洁、高效、安全、可持续的新能源,以水为原料大量制取氢气的最理想的途径是( )。
A.利用太阳能直接使水分解产生氢气
B.以焦炭和水制取水煤气后分离出氢气
C.用铁跟盐酸反应生成氢气
D.由热电站提供电力电解水产生氢气
(2)氢能源既是绿色能源,又可循环使用。请在图2的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转换的角度看,过程Ⅱ主要是____能转化为____能。
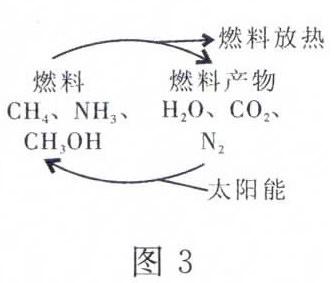
(3)有专家指出,如果对图3中的燃料产物(H2O、CO2、N2等)利用太阳能使它们重新组合,使之能够实现,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )。
A.化学能 B.热能
C.生物能 D.电能
解析 (1)大量制取氢气的最理想途径是消耗的能量最少,不生成对环境有害的物质,方法最简单。(2)燃料电池是化学能转化为电能的过程。(3)此循环中燃烧产物利用太阳能转化为燃料中的化学能,燃料中的化学能最终转化为热能。
答案:(1)A (2)见图4。 化学 电 (3)A
5.谈食色变——关注食品安全问题,守护“舌尖安全”。
例5 2016年全国两会报告中提出“守护‘舌尖安全,落实‘四严要求”。近几年在我国,一些人因食用含有“瘦肉精”(中文名称为盐酸克伦特罗)的猪肉,而发生急性中毒的恶性事件时有发生,这足以说明,“瘦肉精”已变成了“害人精”。“瘦肉精”的结构简式如图5所示。下列关于“瘦肉精”的说法正确的是( )。
A.摩尔质量为313.5g
B.属于芳香烃
C.分子式为C12H19Cl3N2O
D.不能发生加成反应
解析 由“瘦肉精”的结构简式可知:分子式为C12H19Cl3N2O,摩尔质量为313.5 g·mol-1。;除含有C、H元素外,还含有O、Cl元素,不属于芳香烃;含有苯环,能发生加成反应。本题选C。
感悟与提高
1.在近百年间,全球平均气温升高了0.75℃,预计到本世纪末,全球气温将升高1.5~4℃。下列做法可以减缓全球平均气温升高的是( )。
①大力进行植树造林;②以煤为主要生活燃料;③鼓励私人购买和使用小汽车以代替公交车;④利用太阳能、风能和氢能等新能源代替化石燃料;⑤禁止电动自行车上路。
A.①③④ B.②⑤ C.①④ D.②③⑤
2.铬是水体的主要污染物之一,可以导致水生生物死亡。化学实验中,若使某一步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境中排放该有害物质。如处理铬的实验循环示意图如图6所示,请回答下列问题
(1)反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式:____(可以不配平)。
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形式分别是____、____(写化学式)。
(3)铬的化合价除示意图中涉及的+3和+6外,还有0、+2、+4和+5等。现有24 mL0.05 mol·L-1的Na2S03溶液,恰好与20 mL0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO3被Na2Cr2O7氧化为Na2SO4,则铬元素在还原产物中的化合价为____。
参考答案:1.C 2.(1)Cr2O2-7+8H++3H2O2=2Cr3++3O2↑+7H2O (2)CrO-2Fe(OH)3(3)+3
作者单位:江西新干县新干中学
(责任编辑 王琼霞)