阴离子表面活性剂(LAS)加标回收率偏低的原因分析
2016-05-14王志杰陈俊威
王志杰 陈俊威
摘要:探讨了阴离子表面活性剂(LAS)在测量过程中加标回收率偏低的问题:不同基体的加标回收率在30.0%~90.0%之间,未达到环境监测质控要求,且各种水样的加标回收率均不一样。通过实验,初步判断出了偏低的原因与萃取效率和LAS的活度系数有关。
关键词:LAS;阴离子表面活性剂;加标回收率;流动注射
中图分类号:X13 文献标识码:A 文章编号:1674-9944(2016)06-0029-03
1 引言
我国合成洗涤剂的年产量在100万t以上,主要成分LAS,使用后绝大部分LAS随着生活污水进入天然水体。洗涤剂中作为助洗剂磷酸盐与水体中的氮素联合作用,是引起水质富营养化的一个重要原因,严重时会导致鱼类大批死亡。水体中的洗涤剂还能增强对硫磷等有机磷农药以及石油产品对鱼类的毒性。由于LAS含有苯核,在环境中不易被完全降解。LAS在河水中15d的消失百分率为100%,在海水中14d为97%。经研究,LAS生物降解的机理是烷基链的甲基的氧化、β-氧化、芳香环的氧化降解和脱磺化,摄入生物体内的LAS可以逐步蓄积,当蓄积量超过一定程度时,就会影响生物的健康,因此,它对水生生态系统的危害及人类健康影响已经成为人们普遍关注的问题,现阴离子表面活性剂是我国水体生活污染物污染的重要监测指标。
然而,国标GB/T7494-1987阴离子表面活性的测定亚甲蓝分光光度是采用手工分析方法,由于手工分析时萃取两次操作过于繁杂因而重现性较差,阴离子表面活性LAS的加标回收率问题一直未受到关注,特别是国标GB/T7494-1987在“干扰与消除”中提到“主要被测物以外的有机硫酸盐、磺酸盐、羧酸盐、酚类及无机的硫氰酸盐、氰酸盐、硝酸盐、氯化物等,它们或多或少的与亚甲蓝作用,生成可溶于氯仿的蓝色化物,使结果偏高;通过水洗可消除这些干扰,其中硝酸盐和氯离子干扰大部分消除”,起了误导作用,致使多数监测人员以为常见无机离子是对LAS的测量产生正干扰。LA-CHAT公司生产的流动注射仪QC 8500采用在线微膜双萃取法,实现了连续自动萃取,重现性和精度大为改进,从而使查找LAS的加标回收率偏低的原因有了可能。但是有些流动注射分析仪的使用者仍然未发现LAS加标回收率偏低的问题,如2011年由江苏省环境监测中心编制的《水质阴离子表面活性的测定流动注射一分光光度法》(征求意见稿)5.6“干扰和消除”仍然认为干扰因素仅限于GB/T7494-1987提到的且未提出新的消除方法,6.3“方法验证结论”中加标回收率为88.5%~112%,未提到系统性偏低。又例如,王丽平等在《岩矿测试》2009年6期《在线萃取流动注射法测定水体中阴离子表面活性剂》一文中提到,北京地下水实际水样LAS加标回收率97.8%~112.6%,马琳、王涛在工程科技2007年6期《流动注射法测定水中阴离子表面活性剂及条件改进》“各类水质进行实际样品的加标回收率为90.6%~108.1%”。
笔者根据系列实验,得出与之不同新的结论,证实LAS加标回收率系统性偏低且与样品中阴离子表面活性剂的离子活度有关。
2 实验部分
2.1 方法原理
本实验采用流动注射分析仪(FIA)测定水样中阴离子表面活性剂,该仪器将一定体积的样品注射到一个流动的、无空气间隔的试剂溶液连续载流(20%的甲醇)中,样品中阴离子表面活性剂与子染料亚甲蓝反应,生成蓝色的亚基蓝活性物质(MBAS)被氯仿萃取,通过微孔分离膜实现水相和有机相分离,在650nm处进行比色。
2.2 试剂与仪器
2.2.1 试剂
十二烷基苯磺酸钠500mg/L(国家标准物质研究中心);氯仿,G.R.;硫酸镁,G.R.;硫酸铜,A.R_;硫酸亚铁,A.R.;十二水硫酸铝钾,A.R.;铁锰铜锌混标(5%硝酸固定),美国02SI公司,1000mg/L。
2.2.2 仪器
流动注射分析仪(型号8500,LACHAT公司);纯水机(millipore公司)。
2.3 实验部分
2.3.1 高离子浓度状态下LAS的加标回收率实验
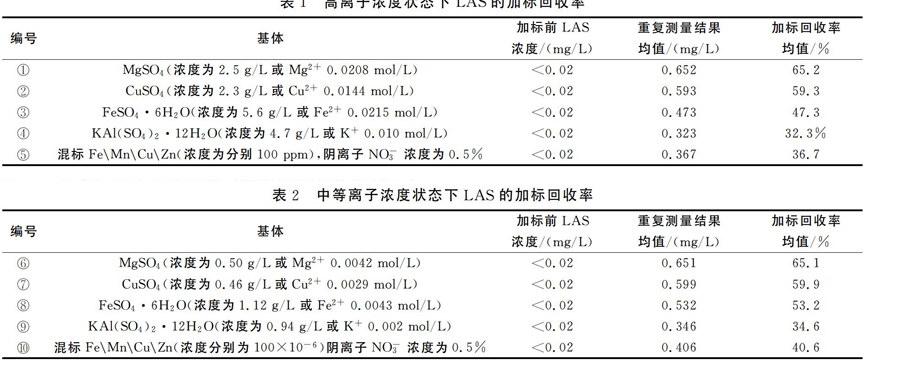
分别取MgSO4、CuSO4、FeSO4、KAl(SO4)、美国02SI公司的铁锰铜锌混标(编号为CFGG-161984-02-01)五种试剂,用纯水机制备的去离子水配制成表1中的浓度并分别编号为①、②、③、④、⑤。另取1.00mL 10mg/L LAS标准溶液,用上述溶液分别定容至10mL,使用流动注射分析仪(LACHAT QC8500)测量溶液的LAS浓度(理论浓度为1.00mg/L),同步把这5种溶液作为样品测量LAS的浓度,重复测量3次并计算加标回收率。
结果表明:地表水、地下水中常见的无机阴离子和阳离子均影响LAS的加标回收率。流动注射分析法因在萃取时使用强酸和强碱来保证萃取效率的统一,手工萃取时需调样品至中性,因此,本次实验首先可排除H和OH的干扰。通过比较阴离子的摩尔浓度,①、③、④溶液硫酸根浓度相接近,而加标回收率差异超过18%,说明SO2-4不是影响加标回收率的主要原因。①、③溶液中阳离子浓度相近,而加标回收率超过18%,①、②阳离子浓度差异较大,但加标回收率反而相接近,说明阳离子也不是影响加标回收率的主因。Cu、Fe、Mg、Al、K络合能力依次降低,①~⑤种溶液的LAS加标回收率未按照此规律排列;Cu2+有氧性,Mg、Al、K无氧化性,而Fe2+有较强还原性,①~⑤种溶液的LAS加标回收率也未按照氧化能力的规律排列,因此,可排除氧化反应和络合反应对最终结果的影响。在样品中加入EDTA,进行同样的加标回收率实验,亦可验证本点结论。⑤溶液中含有Fe、Mn、Cu、Zn共4种阳离子,但都低于①、②、③、④溶液,只有NO-3浓度高于其它溶液中SO2-4的浓度,说明NO-3浓度也影响加标回收率,结果见表2。
2.3.2 中等离子浓度状态下LAS的加标回收率实验
将编号①、②、③、④、⑤的溶液准确稀释5倍,再次分别编号为⑥、⑦、⑧、⑨、⑩,另取1.00mL 10mg/LLAS标准溶液,用上述溶液分别定容到10mL,使用流动注射分析仪测量溶液的LAS浓度(理论浓度为1.00mg/L),同步把这五种溶液作为样品测量LAS的浓度,重复测量3次并计算加标回收率。
表2的结果表明:将溶液中稀释后,相比2.3.1节的加标加收率均有所提高,但仍然偏低较多。⑥~⑩五种溶液的加标回收率大小规律与2.3.1相同,仍为以MgSO4溶液为基体的加标回收率最高,而KAl(SO4)2溶液最低。从表1和表2的测量结果可以推出结论,溶液中的总离子浓度和离子的种类数是影响LAS加标回收率的关键,说明这些离子并非与直链烷基苯磺酸钠(即LAS标准物质)发生化学反应,而是由于溶液中这些常见离子的存在,使直链烷基苯磺酸钠的活度系数变小,最终表现为加标后浓度偏低,造成加标回收率系统性偏低。假定电导率为1μS/cm氯化钾溶液(近似于纯水)中十二烷基苯磺酸钠的活度系数为1,按照活度系数的极限公式计算出在⑥~⑩溶液中直链烷基苯磺酸钠的活度系数均值应为0.642,说明实验结果与德拜一休克尔公式基本相符。
2.3.3 人工海水中LAS加标回收率实验
(1)准确称量30.000g纯度为GR的氯化钠,定容于1000mL超纯水中,配制成3%氯化钠溶液,另取1.00mL10mg/L LAS标准溶液,用上述溶液定容至10mL,使用流动注射分析仪(LACHAT QC 8500)测量溶液的LAS浓度(理论浓度为1mg/L),同步把3%氯化钠溶液作为样品测量LAS的浓度,重复测量5次的平均加标回收率55.2%。
(2)通过调查多个沿海实验室发现,过程按照GB/T17378.4-2007配制人工海水测得的标准曲线的b值在0.00154~0.00171(L/μg)区间,而按照GB/T7494-1987测得的标准曲线的b值在0.00320~0.00391(L/μg)区间。两者差别仅为人工海水与纯水的区别,其余操作步骤完全相同,而斜率测得值相差近一倍,说明人工海水即3%氯化钠溶液是导致斜率相差一倍的唯一原因。
结果表明:实验结果表明氯离子或钠离子达到一定浓度时会使阴离子表面活性剂的活度降低,无法与亚甲蓝发生反应,更加不能萃取至氯仿相,最终导致结果为LAS的加标回收率偏低。
2.4 实验结论
(1)阴离子表面活性剂的加标回收率因受到常见离子影响普遍偏低,偏低原因不是与某种离子的发生反应;而是由于这些常见离子的存在,使直链烷基苯磺酸钠的活度系数变小,最终表现为加标后浓度偏低,造成加标回收率系统性偏低。
(2)在实际水样监测中,一般性水体如河流、地下水、海水及处理过的废水因其总离子强度较高,测量过程中必须考虑待测物活度受总离子强度的影响而测量偏低。这些常见离子如钾、钠、镁、氯化物、硝酸根等无法通过正常化学段消除其干扰,最可行的消除干扰的方法就是测量加标回收率,用加标回收率计算其实际浓度。