999感冒灵颗粒及组分对小鼠急性毒性和饥饿状态下肝毒性影响的研究
2016-05-14郭秋平徐婷婷陈燕勤甄滢滢张跃飞叶祖光金若敏
郭秋平 徐婷婷 陈燕勤 甄滢滢 张跃飞 叶祖光 金若敏


[摘要]比较999感冒灵全方及不同组分对小鼠急性毒性的影响,比较在饥饿和正常饮食状态下,感冒灵对小鼠肝毒性的影响。为临床安全性再评价及合理的安全使用提供实验依据。小鼠分别单次给予全方,化学药组分及中药组分,连续观察14 d,测定全方组与化学药组的LD50和中药组最大耐受量;小鼠分为饥饿和饮食组,单次给予全方,观察14 d,计算LD50;小鼠分为饥饿和饮食组,单次给感冒灵后6 h检测血清生化指标和肝脏指数,计算TD50,观察肝脏组织形态。全方组LD50为442 g·kg-1 ,化学药组LD50为064 g·kg-1。中药组最大耐受量接近2424 g·kg-1。全方组与化学药组小鼠的毒性表现基本相似,体重、摄食量有一定程度的下降,部分存活动物有肝、心组织病变;全方组表现程度较轻,恢复较快;饥饿组小鼠LD50为256 g·kg-1,饮食组LD50为693 g·kg-1;饥饿组小鼠肝TD50为129 g·kg-1,饮食组小鼠肝TD50为630 g·kg-1。999感冒灵全方毒性较小,可能与中西药组分配伍后有一定的减毒作用有关。正常饮食状态和饥饿状态相比,小鼠LD50及肝TD50数值明显变大,毒性减小。从安全性角度提示在不饥饿状态或餐后服用感冒灵更为安全,上述试验为全方的临床安全使用提供了实验依据。
[关键词]感冒灵颗粒;组分;急性毒性;肝毒性;饥饿;饮食
[Abstract]This paper was aimed to compare the acute toxicity of 999 Ganmaoling grain and its different ingredients, and investigate the influence of routine diet on the hepatic toxicity induced by Ganmaoling in mice, so as to provide experimental basis for the clinical safety evaluation Mice were given a single dose of Ganmaoling grain or its different ingredients respectively by gavage, and then observed for 14 days LD50 values of Ganmaoling grain or its chemical ingredient and the maximal tolerated dose of its herb ingredient were determined Mice were divided into starvation and diet group, a single dose of Ganmaoling grain was administered by gavage LD50 values were estimated after 14 day observation Mice were divided into starvation and diet group At the same time,control group was set up for each A single dose of Ganmaoling grain was given Serum biochemical indexes were detected, liver weight index was calculated and liver tissue morphological change was observed after 6 h LD50 values were 442, 064 g·kg-1 for Ganmaoling grain group and chemical ingredient group, respectively The maximal tolerated dose of the herb ingredient group was close to 2424 g·kg-1. The toxic symptom was basically similar in the Ganmaoling grain and the chemical ingredient group The body weight and food intake were decreased to a certain extent in both groups There were pathological changes of liver and heart tissue in some of the surviving animals The animals in the Ganmaoling grain group exhibited a lighter toxicity and recovered faster than that in the chemical ingredient group LD50 values of Ganmaoling grain were 256, 693 g·kg-1 for starvation and diet group respectively TD50 values were 129, 631 g·kg-1 for starvation and diet group respectively The toxicity of 999 Ganmaoling was less, which may be related to the reduction of toxicity after the combination of herb and chemical ingredients Compared with starvation group, the values of LD50 and TD50 of diet group was significantly increased, and toxicity was decreased From the point of view of safety, it is safer to use Ganmaoling in the absence of hunger or after meal The above tests provide experimental basis for the clinical safety use of Ganmaoling
[Key words]Ganmaoling grain; ingredient; acute toxicity; liver toxicity; starvation; diet
doi:10.4268/cjcmm20160806
999感冒灵颗粒是用于感冒引起的头痛、发热、鼻塞、流涕、咽痛等症状的中西复方制剂,由化学药咖啡因、扑尔敏、对乙酰氨基酚(acetaminophen,APAP)及中药三丫苦、金盏银盘、岗梅等组成。本研究分别采用感冒灵全方、化学药组、中药组进行小鼠急性毒性比较试验,以期从毒理学角度来评价感冒灵全方中化学药和中药复方配伍的合理性。此外,该药的禁忌症为严重肝肾功能不全者禁用,本课题组前期实验显示感冒灵引起的毒性症状与APAP相似。已有文献报道[13]APAP在过量或饥饿状态等情况下,可引起严重的肝毒性,甚至死亡,应引起警惕。因此,本研究针对这一不良反应,考察在饥饿或正常饮食状态下,感冒灵对小鼠的急性毒性(LD50)、肝毒性TD50的比较,以期为含有对乙酰氨基酚的复方制剂临床安全性用药和风险控制措施提供实验依据。
1材料
感冒灵化学药组(以下简称化学药组,批号20121201),感冒灵中药组(浸膏粉,以下简称中药组,批号2012121901),感冒灵全方组(不含赋形剂,以下简称全方组,化学药组与中药组按处方比例混合),感冒灵(批号2013030601),上述药物均由华润三九医药股份有限公司提供。临用前用05%羧甲基纤维素钠(CMCNa)配制到所需浓度。
羧甲基纤维素钠(CMCNa,分析纯,批号20120817,天津市大茂化学试剂厂),以除菌水配制成05% CMCNa使用。ALT检测试剂盒(R1批号F449,R2批号F444),AST检测试剂盒(R1批号D449,R2批号L341)均购自上海日和贸易有限公司。
不同组分小鼠急性毒性比较试验:ICR小鼠,雌雄各半,实验时雄性体重(20±2) g,雌性(20±3) g,购自湖南省斯莱克景达实验动物有限公司,SPF级,合格证号43034701838。广州医药研究总院药物非临床评价研究中心SPF级动物房饲养。实验环境:光照12 h明/12 h暗,最小换气次数15次/h,室温20~24 ℃,湿度40%~70%;饲养条件:大小鼠的饲料购自上海斯莱克实验动物有限公司,卫生标准符合GB1492422001,营养标准符合GB1492432010。动物饮用水为过滤除菌水, 动物饮用水符合国家饮用水标准。
饥饿状态下的毒性试验:ICR小鼠,雌雄各半,购自中国科学院上海实验动物中心,合格证号SCXK(沪)20120002,上海中医药大学实验动物中心清洁级饲养。实验环境同上。
OLYMPUS BX 41生物荧光显微镜,OLYMPUS DP71图像采集头(日本 OLYMPUS公司);病理图像分析软件IPP 60(美国Mediacybernetics公司);7080型全自动生化分析仪(日本日立贸易有限公司);ME204E电子天平(METTLER TOLEDO公司)。
2方法
21不同组分小鼠急性毒性比较[45]
211全方、化学药组分组小鼠急性毒性(LD50)试验
首先进行预试摸索其致死和非致死剂量后,然后开始进行正式的急性毒性试验。全方、化学药组分组各取小鼠60只,按体重、性别均衡随机分成6个剂量组,组间距均为085,每组10只,雌雄各半。给药前1 d动物禁食14~16 h,以20 mL·kg-1单次灌胃给药,给药后观察6 h,以后每天观察1~2次,持续观察2周。
212中药组对小鼠最大耐受量(MTD)试验
经预试验发现中药组口服给予最大给药剂量和给药容积,小鼠仍没有死亡,故进行最大耐受量试验。取小鼠40只,按体重、性别均衡随机分成2组,分别为阴性对照组和中药给药组,每组20只,雌雄各半。给药前1 d动物禁食14~16 h,中药组单次灌胃中药2424 g·kg-1,阴性对照组(以下简称对照组)同法给予等容量(40 mL·kg-1)05% CMCNa。给药后观察6 h,以后每天观察1~2次,持续观察2周。
郭秋平等:999感冒灵颗粒及组分对小鼠急性毒性和饥饿状态下肝毒性影响的研究
213检测指标
一般观察:动物体重变化、饮食、外观、行为、分泌物、排泄物等。记录动物的死亡情况,于给药后第1,3,5,7,14天测定动物体重及摄食量。
病理学检查:中毒死亡或濒死动物及时进行大体解剖,其他动物在观察期结束后脱臼处死,进行大体解剖,大体检查脏器包括气管、食道、皮肤、胸腺、肾上腺、胰腺、胃、肠(十二指肠、空肠、回肠、结肠、直肠)、心、肺、肝、脾、肾、脑、淋巴结、膀胱、前列腺、睾丸(连附睾)、子宫、卵巢。当发现器官出现体积、颜色、质地等改变时,则对改变的器官用10%中性福尔马林固定,经脱水、常规石蜡包埋制片,HE染色,光镜下进行组织病理学检查。
病理诊断标准如下。肝脏:①正常肝细胞,为(-);②肝细胞轻度水肿,为(+);③肝细胞广泛性水肿,为();④肝细胞坏死,为()。心脏:①正常心肌组织,为(-);②心肌偶见点灶性坏死,为(+);③心肌多处点灶性坏死,为();④心肌断裂,排列紊乱,为()。胃肠:①正常胃肠组织,为(-);②胃肠黏膜层少量细胞脱落,为(+);③胃肠黏膜层大量细胞脱落,为();④胃肠黏膜坏死,为()。
22饥饿或饮食情况下感冒灵对小鼠LD50的比较[45]
取ICR小鼠,随机分为饥饿组、正常饮食组(以下简称饮食组),雌雄各半。饥饿组给药前夜禁食16 h,给药后禁食6 h,然后给予食物;饮食组给药前后均给予食物,2组分别设不同剂量的处理组,每小组10只动物。小鼠以20 mL·kg-1单次灌胃给药后连续观察14 d,并记录各剂量组死亡动物数及相关指标。中毒死亡或濒死动物及时进行解剖,存活动物在试验结束后脱臼处死,解剖取肝脏,于10%福尔马林溶液中固定,制备石蜡切片HE染色,光学显微镜下观察组织病理学变化。计算2组的LD50及95%可信限及对肝组织病理变化进行比较。
23饥饿或饮食情况下感冒灵对小鼠肝毒性TD50的比较研究[45]
取ICR小鼠,同上随机分为饥饿组、饮食组。各组再分设不同剂量处理组,每组10只,雌雄各半,小鼠以20 mL·kg-1单次灌胃6 h后摘眼球取血,检测指标:血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST);称肝脏质量并计算肝脏指数,肝脏经HE染色后观察其组织形态学变化,病理诊断标准同上。综合试验结果,以ALT,AST显著升高或病理损伤三者之一发生变化判定为肝脏损伤。根据小鼠肝脏损伤的动物数,计算2组肝毒性的TD50及95%可信限,并进行比较。
24统计学处理
实验结果中计量资料均以±s表示,多组间比较采用单因素方差分析(OneWay ANOVA)。组间两两比较方差齐性时用LSD方法分析,方差不齐时用Dunnett′s 3方法分析。采用SPSS 150统计学软件进行统计分析。
LD50,TD50计算采用Bliss法。等级资料采用Ridit分析处理。P<005或P<001认为有统计学意义。
3结果
31全方和不同组分小鼠急性毒性比较
311小鼠死亡情况
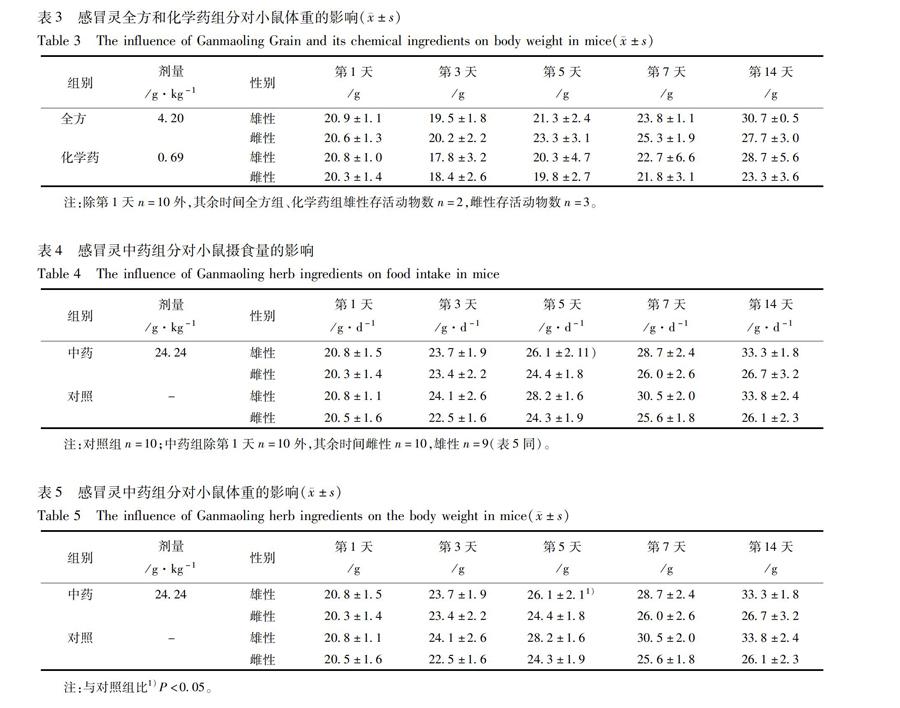
化学药组、全方组动物死亡数量随剂量升高而增多,与剂量呈正相关,经计算,化学药组对小鼠的半数致死剂量LD50为064 g·kg-1,95%可信限为053~078 g·kg-1。全方组对小鼠的半数致死剂量LD50为442 g·kg-1,95%可信限为386~505 g·kg-1。雄性小鼠对化学药组毒性的敏感性大于雌性小鼠。动物死亡分布见表1。在中药组的最大耐受量试验中,中药组1/20例动物死亡,该组对小鼠的最大耐受量略低于24240 g·kg-1。
312小鼠一般状态
化学药组、全方组动物表现基本一致,部分动物在给药后30~60 min开始陆续出现闭眼、呼吸加快、抽搐、竖毛、眼球发白、眼周有分泌物、步履不稳、活动减少、翻正反射消失等症状的一种症状或多种症状,6 h内动物多出现抽搐而死亡。当天给药后4~6 h,各组均有部分动物开始恢复或恢复正常。动物反应的严重程度及反应动物数量与药物的剂量呈正相关。但全方组较化学药组开始恢复或恢复到正常的时间提早1 d。
中药组动物在给药后60 min内陆续开始出现活动减少、稀便、闭眼、竖毛、俯卧不动、翻正反射消失等症状中的一种或多种症状;有1只动物呼吸
加快,4 h后恢复;有1只动物在4~6 h抽搐而死亡。存活动物于第2天已恢复正常。
313对小鼠摄食量、体重的影响
化学药组、全方组中除最低剂量组外,其他各剂量组动物在给药当天摄食量均明显减少。体重有所减轻,第5天开始回升,并保持增长至试验结束,有量效关系。
在上述全方组和化学药组的急性毒性(LD50)试验中,分别选择全方组的420 g·kg-1剂量(该剂量接近于全方组中化学药组的剂量073 g·kg-1)以及化学药组069 g·kg-1,比较这2个剂量组动物的摄食量、体重的变化情况。可见在相近剂量下全方组动物摄食量和体重恢复较快,见表2,3。
314对小鼠组织病理学的影响
3141化学药组动物主要病变在胃肠道、肝脏、心脏;肾组织结构未见明显异常。
死亡动物解剖大体观察可见个别动物胃肠黏膜潮红;组织学检查可见个别动物胃肠黏膜层少量细胞脱落、肝脏广泛性肝细胞水肿及肝瘀血。
末期存活动物解剖大体观察可见较多动物肝脏表面出现大小不等白色斑块或斑点;组织学检查可见部分动物肝脏局部组织坏死及嗜碱性物质沉积、肝瘀血。心肌多处点灶性坏死及嗜碱性物质沉积。
3142全方组动物主要病变在胃肠道、肝脏、心脏;肾组织结构未见明显异常。
死亡动物解剖大体观察可见少量动物胃胀气及胃肠黏膜层潮红,其他脏器未见明显异常;组织学检查可见个别动物胃肠黏膜层少量上皮细胞脱落;肝脏广泛性肝细胞水肿及肝瘀血。
末期存活动物解剖大体观察可见大量动物肝脏表面出现大小不等的白色斑点或斑块;组织学检查可见个别动物肝脏局灶性坏死、嗜碱性物质沉积、肝细胞广泛性轻度水肿变化及肝瘀血,心肌点灶性坏死伴嗜碱性物质沉积。
根据死亡动物的组织病理学的检查结果,全方组与化学药组相比,存活动物均未见胃肠道组织严重病变,但化学药组出现胃肠道病变的动物坏死病变范围稍广、程度较严重;化学药组肝脏组织出现广泛性肝细胞水肿性变化的动物数及病变程度均稍高于全方组。化学药组出现心肌病变范围较全方组广泛、程度较严重,见表6。
3143中药组有1例雄性动物在给药后6 h内死亡,解剖大体观察见结肠稍有胀气,其他主要脏器未见异常病变。末期存活动物解剖大体观察,各主要组织脏器未见异常。
3144全方与化学药组的比较全方LD50剂量为442 g·kg-1,其中含化学药量为073 g·kg-1,与单独化学药组LD50剂量064 g·kg-1比,全方中的化学药量升高了009 g·kg-1,约提高了14%,见表7。
在毒理学特征表现方面:全方组和化学药组基本一致,如对不同性别的毒性强度比较,雄性动物对毒性的敏感性均大于雌性;但若以化学药与全方中含化学药量相近的2个剂量组比较,单纯化学药组的毒性反应程度要比全方组为大,例如,化学药组动物的摄食量及体重下降的幅度均大于全方组,恢复也较慢;存活动物的组织病理学检查结果显示,化学药组动物出现肝脏、心肌病变的动物数较之全方组为多,且组织坏死病变范围较为广泛、程度也较严重。
32饥饿或饮食状态下感冒灵对小鼠LD50的比较研究
321饥饿组
3211一般观察各组有部分动物在给药后1 h内陆续出现竖毛、呼吸加快、步履不稳、活动减少、翻正反射消失等一种症状或多种症状,有一定的量效关系。LD50为2556 g·kg-1,95%可信限为2094~2947 g·kg-1。
3212对动物肝组织病理学的影响观察期间,动物死亡时经解剖发现肝脏肿胀变大,大部分或全部为黑红色斑块。部分存活动物经解剖发现肝脏肝包膜下肉芽肿,可见大量多核巨细胞。
322饮食组
3221一般观察除最低剂量组外,其他组部分动物在给药后2 h内陆续出现症状同饥饿组相似,有一定的量效关系。LD50为6933 g·kg-1,95%可信限为6325~7689 g·kg-1,LD50是饥饿状态下的27倍。
3222对动物肝组织病理学的影响观察期间,死亡动物解剖发现肝脏肿胀变大,大部分或全部为黑红色斑块。部分存活动物经解剖发现肝细胞出现水肿、小灶性坏死、肝包膜下出现肉芽肿、可见大量多核巨细胞等。
33饥饿或饮食状态下感冒灵对小鼠TD50的比较研究
331饥饿组
3311对血清生化及脏器指数的影响与对照组比,1416 g·kg-1组小鼠血清ALT,AST,肝脏指数显著升高(P<005),有1只动物死亡,见表8。
3312对肝组织病理学的影响对照组,0595 g·kg-1,0798 g·kg-1组各有1只动物肝组织偶见一处肝细胞点状坏死,1062 g·kg-1组有1只动物出现轻微肝损伤。1416 g·kg-1组有1只动物出现轻微肝损伤,5只动物出现严重肝损伤,肝组织多发或大片出血坏死;与对照组比,有显著差异(P<001)。1416 g·kg-1组动物有1只死亡,解剖发现肝脏大部分为黑红色斑块,脏器肿胀变大。
332饮食组
3321对血清生化及脏器指数的影响与对照组比,3540 g·kg-1组小鼠血清ALT及4720 g·kg-1组小鼠血清ALT,AST显著升高(P<001),但升高幅度不大;肝脏指数均无明显变化,见表9。
3322对肝组织病理学的影响对照组,2001 g·kg-1,2657 g·kg-1组有1只动物肝组织偶见一处肝细胞点状坏死,3540 g·kg-1组、4720 g·kg-1组分别有1只和2只动物出现轻微肝组织出血坏死。与对照组比,均无显著性差异。
3323肝脏毒性比较TD50值比较:饥饿组为1292 g·kg-1,95%可信限为1114~1802 g·kg-1,饮食组为6306 g·kg-1,95%可信限为4657~0428 g·kg-1,饮食组TD50是饥饿组的49倍,表明毒性小。
将饥饿组1416 g·kg-1与饮食组1492 g·kg-1 2个相近剂量组的结果比较,饥饿组血清ALT,AST及肝组织病变例数显著升高(P<005),见表10。
4讨论
国家食品药品监督管理总局自2007年来积极采取了多项措施,鼓励或要求对上市后药品开展再评价工作,特别是国务院颁发了《国家药品安全十二五规划》,着重强调了药物再评价[6]。王骏等分析认为,目前复方中药物配伍多以药效的协同增效作用为依托[7]。药物不良反应通常与药物的使用剂量相关,将具有协同作用的药物进行组合,进而达到减小药物使用剂量的目的,如市场常见的感冒灵颗粒、维C银翘片等,由于药效的协同作用从而减少对乙酰氨基酚的用量,减少了不良反应的发生,提高了用药安全性。荆恒攀等提出以克服药品不良反应为目的开发新复方制剂的思路[8],本文从减毒配伍角度评价感冒灵复方制剂中化学药和中药配伍的合理性。对乙酰氨基酚(APAP)是目前应用最广泛的非处方类解热镇痛药物之一,999感冒灵则是含有APAP的中西药复方制剂,其中APAP日服量为600 mg,远低于常用化学药感冒药中APAP用量。一般而言,治疗剂量的APAP是比较安全的,但超剂量使用时,会引起一些不良反应,特别是肝毒性,APAP在美国和欧洲等国家是引起急性肝功能衰竭的常见原因[9]。
在前期试验中,作者发现大鼠对对乙酰氨基酚的毒性不甚敏感,而小鼠却对对乙酰氨基酚的肝毒性较为敏感,故本实验选择小鼠进行试验,小鼠LD50实验结果提示999感冒灵颗粒中西药组分配伍后有一定的减毒趋势。分析全方和化学药组出现毒性的现象,可能与化学药对乙酰氨基酚及咖啡因的作用与不良反应有关。
文献报道[912]服用大剂量或长期使用APAP,在体内生成毒物较大的自由基代谢产物N乙酰对苯醌亚胺(NAPQI) ,而体内谷胱甘肽(GSH),尤其是肝细胞内的谷胱甘肽能参与其生物转化,从而把机体内有害的N乙酰对苯醌亚胺(NAPQI)转化为无害的物质,排出体外。一些因素可以通过影响体内GSH水平而影响APAP肝脏毒性,例如N乙酰半胱氨酸可通过提高胞内GSH水平,有效减轻过量APAP引起的肝脏损伤[13];饮食可明显使内源性GSH浓度增加[10]。本研究显示,在急性毒性试验中,饮食组小鼠LD50约为饥饿组的3倍;在肝毒性试验中,饮食组肝毒性TD50约为饥饿组的5倍,表明饥饿状态下会明显增加动物的死亡率和增加主要毒性靶器官的肝损伤;推测饮食可使内源性GSH浓度增加,从而减轻了高剂量感冒灵中APAP引起的肝脏损伤。该结果与文献报道[13]APAP在过量或饥饿状态等情况下,可引起严重的肝毒性,甚至死亡是一致的。
本文补充了从复方制剂的毒理学——减毒角度考虑药物配伍研究,表明999感冒灵全方毒性较小,可能与中西药组分配伍后有一定的减毒作用有关。饮食组与饥饿组的小鼠LD50与肝TD50结果提示从安全性角度出发,在不饥饿状态或餐后服用感冒灵更为安全。本研究为含有对乙酰氨基酚等化学药的中西药复方制剂安全性再评价提供了一种研究方法,也为含有对乙酰氨基酚的复方制剂临床安全性用药和为风险控制措施提供了实验依据。
[致谢]雷夏凌、杨威参加了此项工作。
[参考文献]
[1]James L P, Mayeux P R, Hinson J A. Acetaminophen induced hepatotoxicity[J]. Drug Metab Dispos, 2003, 31(12):1499.
[2]杨秀兰, 赵聪, 郑敏, 等. 对乙酰氨基酚对小鼠肝毒性的实验研究[J]. 四川医学,2006,27(9):888.
[3]李大伟, 陆天飞, 华相伟, 等. 对乙酰氨基酚诱导的小鼠药物性肝损伤的模型研究[J]. 中国细胞生物学学报, 2014, 36(6): 805.
[4]化学药物急性毒性试验技术指导原则课题研究组. 化学药物急性毒性试验技术指导原则[S]. 2005.
[5]中药、天然药物急性毒性试验技术指导原则课题研究组. 中药、天然药物急性毒性试验技术指导原则[S]. 2005.
[6]李鸿彬,李认书. 对上市中成药再评价制度的回顾与思考[J]. 中草药,2015,46(2):293.
[7]王骏,黄冉冉,王韵,等. 从抗感冒药常用成分谈合理用药[J]. 四川生理科学杂志,2011, 33(2): 77.
[8]荆恒攀,熊素彬,潘卫三. 以克服药品不良反应为目的开发新复方制剂的思路与策略[J]. 中南药学,2014, 12(6): 512.
[9]James L P, Gill P, Simpson P. Predicting risk in patients with acetaminophen overdoses[J]. Expert Rev Gastroenterol Hepatol, 2013, 7(6):509.
[10]Corcoran G B, Mitchell J R, Vaishnav Y N, et al. Evidence that acetaminophen and Nhydroxy acetaminophen form a common arylating intermediate, Nacetylpbenzoquinoneimine[J]. Mol Pharmacol, 1980, 18(3):536.
[11]Miners J O, Drew R, Birkett D J. Mechanism of action of paracetamol protective agents in mice in vivo[J]. Biochem Pharmacol, 1984, 33(19):2995.
[12]Mitchell J R, Jollow D J, Potter W Z, et al. Acetaminopheninduced hepatic necrosis. I. Role of drug metabolism[J]. J Pharmacol Exp Ther, 1973, 187(1):185.
[13]张全英,华雯妍,朱艺芳,等. 液质联用法初步研究健康人血浆内源性还原型谷胱甘肽的昼夜差异及饮食影响[J]. 中国医院药学杂志,2011,31(3):193.
[责任编辑马超一]
