HS-SPME/GC-MS结合化学计量学分析不同产地路路通中的挥发性成分
2016-05-13杨艳芹周国俊储国海袁凯龙段太成潘远江
杨艳芹,周国俊,储国海,袁凯龙,蒋 健,段太成,潘远江
(1.浙江中烟工业有限责任公司技术中心,浙江 杭州 310024;2.浙江大学 化学系,浙江 杭州 310027;
3.中国科学院长春应用化学研究所,吉林 长春 130022)
HS-SPME/GC-MS结合化学计量学分析不同产地路路通中的挥发性成分
杨艳芹1,2,周国俊1*,储国海1,袁凯龙1,蒋健1,段太成3*,潘远江2
(1.浙江中烟工业有限责任公司技术中心,浙江杭州310024;2.浙江大学化学系,浙江杭州310027;
3.中国科学院长春应用化学研究所,吉林长春130022)
摘要:采用顶空固相微萃取结合气相色谱-质谱技术(HS-SPME/GC-MS)分析了不同产地路路通中的挥发性成分,采用正交试验设计优化了影响顶空固相微萃取技术的各项因素,以主成分分析、聚类分析两种化学计量学方法分析评价了8个产地路路通的挥发性成分。优化实验结果为1 g样品量在80 ℃下提取40 min,解析1 min。8个产地的路路通共鉴定出48种挥发性组分,不同产地的化学成分大致相同,含量差异较大。两种统计分析方法均表明,湖南、江苏、四川、辽宁4个产地的路路通挥发性成分比较相似,贵州、广西、安徽、河北4个产地的路路通比较接近。主成分分析结果表明,氧化石竹烯、δ-杜松烯、橙花叔醇可作为区分两大类路路通的代表性化合物。HS-SPME/GC-MS结合化学计量学方法可以有效地对不同产地的路路通进行质量评价,从而为中药路路通的药物开发和科学栽培管理提供重要参考。
关键词:顶空固相微萃取/气相色谱-质谱联用技术;挥发性成分;路路通;不同产地;化学计量学
路路通(LiquidambarformosanaHance)属于金缕梅科,是一种落叶和观赏性树木,广泛分布在中国、老挝、朝鲜和越南[1]。在传统中药领域,路路通不仅可以加快血液循环,减轻淤血,加速伤口愈合,还具有止痛、利尿、抗痉挛、抗炎和治疗腹泻、消化不良等多种功效[2-3]。它含有多种化学成分,如羽扇烷萜、奥利烷萜、甾体、类黄酮和酚类化合物。路路通提取物中的类黄酮和酚类化合物具有抗氧化作用[3],奥利烷萜类是一种重要的核转录调控因子[4]。目前,只有对路路通叶子挥发性成分的研究报道,而对其干燥果实挥发性成分的研究尚无相关报道[5]。
传统的挥发性成分提取技术有水蒸气蒸馏、索氏提取、超声提取等,这些方法不仅费时费力,提取效率低,引入有机溶剂残留,而且高温加热会导致热不稳定化合物的裂解和水合反应。顶空固相微萃取技术(HS-SPME)集样品采集、萃取、浓缩、进样和分析于一体,不仅选择性好、提取效率高,而且无需溶剂,是一种环境友好的方法[6],目前已应用于中草药[7-8]、食品[9-11]、香精香料[12]和水果[13-14]中挥发性成分的分析。
本文采用顶空固相微萃取技术结合气相色谱-质谱对路路通干燥果实的挥发性成分进行研究,并采用化学计量学方法对不同产地的路路通挥发性成分进行评价,从而为路路通的药物开发和应用提供重要参考。
1实验部分
1.1仪器与试剂
岛津气相色谱-质谱仪(Shimadzu GCMS-QP2010);密封帽、顶空瓶(安捷伦公司);电子恒温水浴锅(上海亚荣生化仪器厂);中药材粉碎机(天津市泰斯特仪器有限公司);电子天平(赛多利斯科学仪器有限公司);正构烷烃C8~C30(Supelco,USA);顶空固相微萃取手柄、100 μm聚二甲基硅氧烷萃取头(PDMS)、65 μm 聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)、75 μm Carboxen/聚二甲基硅氧烷(CAR/PDMS)(Supelco,USA)。
湖南路路通果实(长春同仁堂大药房);江苏路路通果实(长春玺康大药房);四川路路通果实(长春义善堂大药房);辽宁路路通果实(长春百全中草药店);安徽路路通果实(长春市传承中药材);贵州路路通果实(长春济世参茸中草药店);广西路路通果实(长春人民药业集团中药科技有限公司);河北路路通果实(长春医药集团中草药房)。路路通经吉林大学植物科学学院李想教授鉴定为金缕梅科路路通的干燥果实。
1.2顶空固相微萃取
顶空固相微萃取头首次使用时按照用户手册插入气相色谱-质谱仪进样口进行预处理,PDMS和PDMS/DVB萃取头于250 ℃下解析0.5 h,CAR/PDMS萃取头于300 ℃下解析1 h。每次使用前,萃取头在气相色谱-质谱仪进样口于250 ℃下解析5 min以除去滞留残留物。
将称量的样品粉末快速放入20 mL顶空瓶中,用密封帽密封。将针头刺穿隔垫插入顶空瓶中,推出萃取头暴露于样品上空,然后放入水浴锅中在设定的温度和时间下进行提取。达到平衡后将萃取头拔掉,插入气相色谱-质谱仪进样口进行热解析。对不同类型的萃取头(PDMS,PDMS/DVB,CAR/PDMS)、样品量(0.5,1.0,1.5 g)、提取温度(40,60,80 ℃)、提取时间(20,40,60 min)、解析时间(1,3,5 min)等影响因素进行优化。
1.3色谱-质谱分析条件
色谱条件:DB-5石英毛细管柱(30 m×0.25 mm i.d.×0.25 μm)。程序升温:60 ℃以4 ℃/min升至250 ℃,然后保留12.5 min;高纯氦气作为载气,流速为0.9 mL/min,分流比为1∶20。
质谱条件:质量扫描范围40~500 amu,扫描速率0.2 s/scan,离子源和接口温度分别为230 ℃和280 ℃。
1.4GC-MS定性及定量分析

1.5数据处理及化学计量学程序
4因素3水平的正交试验L9(34)和方差分析采用正交试验助手Ⅱ软件计算完成。主成分分析、聚类分析采用SPSS 17.0统计软件完成。
2结果与讨论
2.1顶空固相微萃取条件优化
2.1.1萃取头的选择顶空固相微萃取技术的关键部位在于萃取头。萃取头是涂布了不同色谱固定相或吸附剂的熔融石英纤维或金属合金,有单层和多层的萃取头。不同类型的萃取头具有不同的吸附性能和保留能力。实验采用PDMS/DVB、CAR/PDMS和PDMS 3种不同类型的萃取头测定路路通的挥发性成分。结果显示,PDMS/DVB萃取头得到的总峰面积最大,PDMS和CAR/PDMS分别为PDMS/DVB萃取头总峰面积的53.5%和90.6%,说明PDMS/DVB萃取头对于路路通中的挥发性成分有很好的吸附性和保留性,因此实验选用PDMS/DVB萃取头。

表1 正交试验设计因子水平表
2.1.2正交试验设计顶空固相微萃取技术受多种因素影响,如样品量、提取时间、提取温度、解析时间等,因此采用L9(34)的正交试验设计(见表1)来优化各影响因素,实验具体安排及结果见表2。根据表2结果得到最优的实验条件,即1.0 g样品量,提取温度为80 ℃,提取时间为40 min,解析时间为1 min。

表2 正交试验设计与结果
通过表3的方差分析,判定顶空固相微萃取技术各因素对实验结果的影响程度顺序为提取温度>提取时间>解析时间>样品量。因此,为了避免实验结果的波动,实验时应严格控制提取温度和提取时间。

表3 方差分析结果
F0.01(2,2)=99.00,F0.05(2,2)=19.00
2.2不同产地的路路通挥发性成分对比分析
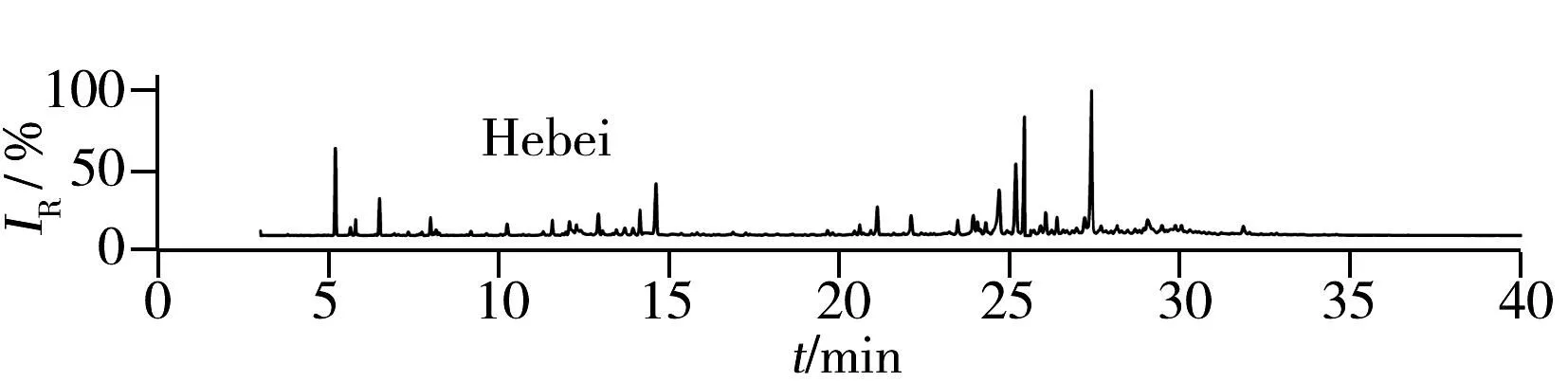
在最优萃取条件下(即1.0 g的样品量采用PDMS/DVB萃取头在80 ℃条件下提取40 min,解析1 min),测定了湖南、江苏、四川、辽宁、河北、安徽、广西和贵州8个产地的路路通挥发性组分,其总离子流图如图1所示,可以看出不同产地路路通的峰形和个数存在差异。
通过标准谱库检索(NIST05,相似度大于80%)及保留指数(正构烷烃C8~C30的混合物进行计算得到)和参考文献来辅助质谱检索定性,对总离子流图中各色谱峰进行了归属和指认,结果见表4。湖南、江苏、四川、辽宁、河北、安徽、广西和贵州产地的路路通分别鉴定出35,32,32,37,38,32,33和30种挥发性成分。总数为48种,其中19种挥发性成分为8个产地的共同组分,分别为α-蒎烯、莰烯、萜品油烯、对伞花烃、柠檬烯、6-崁烯醇、香芹蒎酮、α-松油醇、桃金娘醛、优葛缕酮、α-荜澄茄油烯、β-榄香烯、α-金合欢烯、α-芹子烯、γ-衣兰油烯、大根香叶烯、氧化石竹烯、δ-杜松烯和环氧化红没药烯。




No.Retentiontime/minCompoundKI*MolecularweightContent(%)HunanJiangsuSichuanLiaoningHebeiAnhuiGuangxiGuizhou15.25α-Pinene(α-蒎烯)9051363.14.257.198.357.07114.624.2625.68Camphene(莰烯)9221361.141.641.232.330.712.211.762.1935.784-Methylenebicyclo[3.2.1]oct-2-ene(萜品油烯)925120-----1.751.391.73
(续表4)
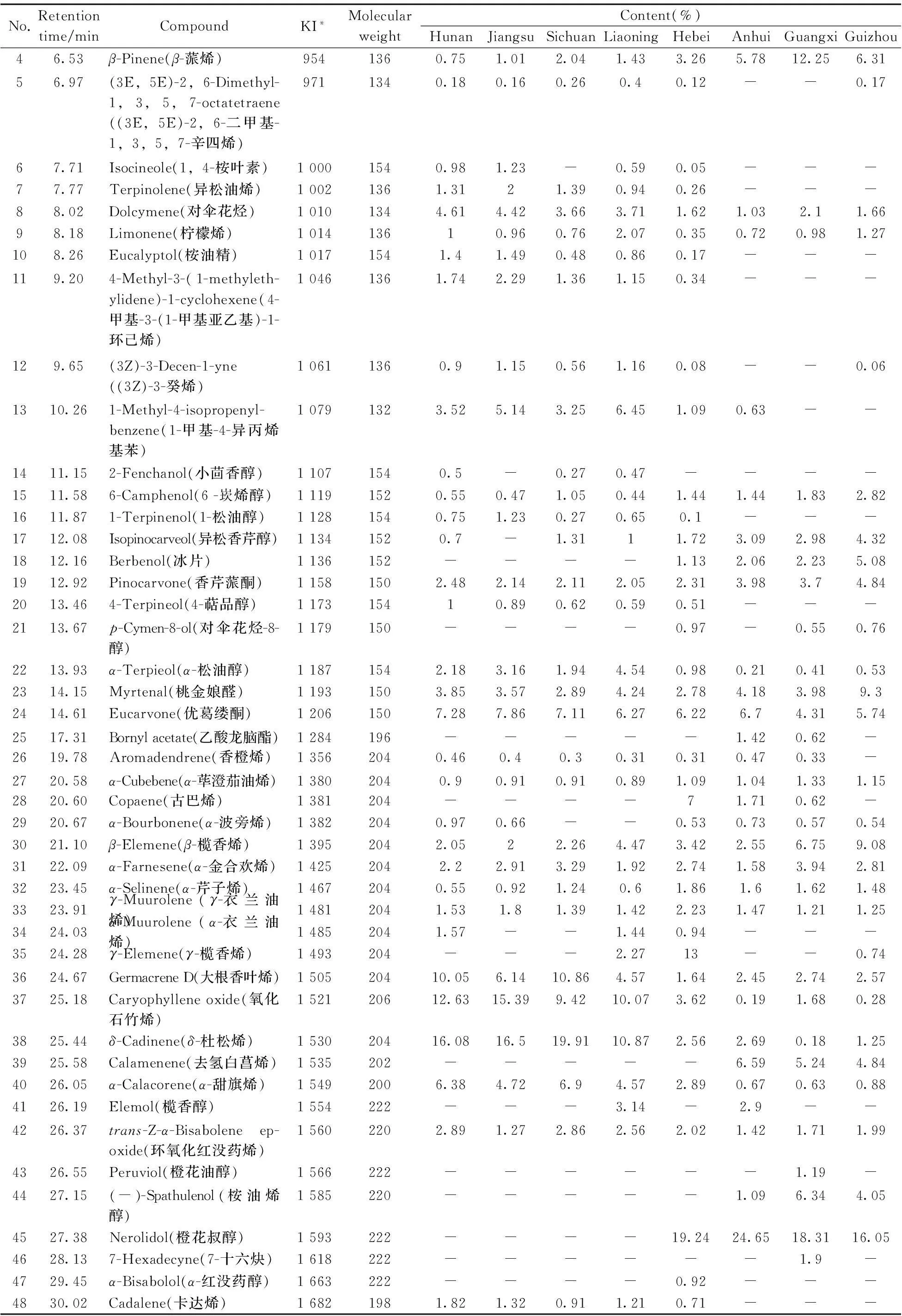
No.Retentiontime/minCompoundKI*MolecularweightContent(%)HunanJiangsuSichuanLiaoningHebeiAnhuiGuangxiGuizhou46.53β-Pinene(β-蒎烯)9541360.751.012.041.433.265.7812.256.3156.97(3E,5E)-2,6-Dimethyl-1,3,5,7-octatetraene((3E,5E)-2,6-二甲基-1,3,5,7-辛四烯)9711340.180.160.260.40.12--0.1767.71Isocineole(1,4-桉叶素)10001540.981.23-0.590.05---77.77Terpinolene(异松油烯)10021361.3121.390.940.26---88.02Dolcymene(对伞花烃)10101344.614.423.663.711.621.032.11.6698.18Limonene(柠檬烯)101413610.960.762.070.350.720.981.27108.26Eucalyptol(桉油精)10171541.41.490.480.860.17---119.204-Methyl-3-(1-methyleth-ylidene)-1-cyclohexene(4-甲基-3-(1-甲基亚乙基)-1-环己烯)10461361.742.291.361.150.34---129.65(3Z)-3-Decen-1-yne((3Z)-3-癸烯)10611360.91.150.561.160.08--0.061310.261-Methyl-4-isopropenyl-benzene(1-甲基-4-异丙烯基苯)10791323.525.143.256.451.090.63--1411.152-Fenchanol(小茴香醇)11071540.5-0.270.47----1511.586-Camphenol(6-崁烯醇)11191520.550.471.050.441.441.441.832.821611.871-Terpinenol(1-松油醇)11281540.751.230.270.650.1---1712.08Isopinocarveol(异松香芹醇)11341520.7-1.3111.723.092.984.321812.16Berbenol(冰片)1136152----1.132.062.235.081912.92Pinocarvone(香芹蒎酮)11581502.482.142.112.052.313.983.74.842013.464-Terpineol(4-萜品醇)117315410.890.620.590.51---2113.67p-Cymen-8-ol(对伞花烃-8-醇)1179150----0.97-0.550.762213.93α-Terpieol(α-松油醇)11871542.183.161.944.540.980.210.410.532314.15Myrtenal(桃金娘醛)11931503.853.572.894.242.784.183.989.32414.61Eucarvone(优葛缕酮)12061507.287.867.116.276.226.74.315.742517.31Bornylacetate(乙酸龙脑酯)1284196-----1.420.62-2619.78Aromadendrene(香橙烯)13562040.460.40.30.310.310.470.33-2720.58α-Cubebene(α-荜澄茄油烯)13802040.90.910.910.891.091.041.331.152820.60Copaene(古巴烯)1381204----71.710.62-2920.67α-Bourbonene(α-波旁烯)13822040.970.66--0.530.730.570.543021.10β-Elemene(β-榄香烯)13952042.0522.264.473.422.556.759.083122.09α-Farnesene(α-金合欢烯)14252042.22.913.291.922.741.583.942.813223.45α-Selinene(α-芹子烯)14672040.550.921.240.61.861.61.621.483323.91γ-Muurolene(γ-衣兰油烯)14812041.531.81.391.422.231.471.211.253424.03α-Muurolene(α-衣兰油烯)14852041.57--1.440.94---3524.28γ-Elemene(γ-榄香烯)1493204---2.2713--0.743624.67GermacreneD(大根香叶烯)150520410.056.1410.864.571.642.452.742.573725.18Caryophylleneoxide(氧化石竹烯)152120612.6315.399.4210.073.620.191.680.283825.44δ-Cadinene(δ-杜松烯)153020416.0816.519.9110.872.562.690.181.253925.58Calamenene(去氢白菖烯)1535202-----6.595.244.844026.05α-Calacorene(α-甜旗烯)15492006.384.726.94.572.890.670.630.884126.19Elemol(榄香醇)1554222---3.14-2.9--4226.37trans-Z-α-Bisaboleneep-oxide(环氧化红没药烯)15602202.891.272.862.562.021.421.711.994326.55Peruviol(橙花油醇)1566222------1.19-4427.15(-)-Spathulenol(桉油烯醇)1585220-----1.096.344.054527.38Nerolidol(橙花叔醇)1593222----19.2424.6518.3116.054628.137-Hexadecyne(7-十六炔)1618222------1.9-4729.45α-Bisabolol(α-红没药醇)1663222----0.92---4830.02Cadalene(卡达烯)16821981.821.320.911.210.71---
-:no detected;*:experimentally determined Kovàts indices on the DB-5 column,relative to C8-C30hydrocarbons
不同产地的路路通由于生长条件(如土壤、水分、气候等)的差异,挥发性成分在组分和含量上存在明显相似性和一定的差异性。例如,氧化石竹烯在8个产地路路通中的含量所占比例为0.19%~12.63%;δ-杜松烯在8个产地的含量占比为0.18%~16.08%;橙花叔醇在河北、安徽、广西、贵州4个产地的相对含量介于16.05%~24.65%之间,而在湖南、江苏、四川、辽宁4个产地均未检出。其他相对含量较高的化合物有α-蒎烯(3.1%~11%)、桃金娘醛(2.78%~9.3%)、β-榄香烯(2.0%~9.08%)和香芹蒎酮(2.05%~4.84%)。
此外,在路路通中检测出的一些挥发性成分具有特殊的生物活性和药理功能。如桉油精(Eucalyptol)可用于治疗急性胰腺炎[15];桃金娘醛可有效预防肝癌,是治疗肝癌的候选药物[16];氧化石竹烯对于中央及神经疼痛有明显作用,此外还具有抗炎活性[17];橙花叔醇具有保护神经的功效,是常用的镇定剂[18]。这些研究发现拓展了路路通潜在的药用范围,为路路通的药物开发和应用提供了理论参考。

表5 主成分分析特征值及累计方差

图2 主成分分析得分图Fig.2 Score plot of principal component analysis(PCA)
2.3主成分分析
主成分分析是化学计量学常用的数据分析手段,主要利用“降维”的方法将多个指标转换为几个互不相关的指标即主成分,从而使进一步研究变得简单。本研究以8个产地的路路通挥发性成分为研究对象(见表4),应用SPSS17.0统计软件进行主成分分析,得到特征值和累计贡献率(见表5)。实验提取了3个主成分,累计方差贡献率达76.73%(见表5),说明这3个主成分包含了原始变量的绝大部分信息,可以用这3个主成分代替原来的变量对不同产地的路路通进行比较分析。其中第一主成分(PC1)的特征值为25.16,方差贡献率高达52.42%,表明此主成分在数据分析中占主导作用;第二主成分(PC2)的特征值为6.89,方差贡献率为14.35%;第三主成分(PC3)的特征值为4.78,方差贡献率为9.96%。按照所得3个主成分对8个产地的路路通进行分析,结果如图2所示。根据主成分分析得分图可将8个产地的路路通分为两组,第一组包括湖南、江苏、四川、辽宁,第二组包括河北、安徽、广西、贵州。
将8个产地路路通的挥发性组分进行PCA分析,所得载荷图如图3所示,图3A是以PC1和PC2两个主成分进行分析所得的载荷图,图3B是以PC1和PC3两个主成分进行分析所得的载荷图。从载荷图可以看出,48个组分分布比较集中,表明 8个产地的路路通挥发性成分含有大量的共有成分,但在组分和含量上具有一定差异。另外,可从图中较分散的点得到路路通挥发性成分中具有区分意义的组分,如45号组分橙花叔醇(tR=27.38 min),在河北、安徽、广西、贵州4个产地的挥发性成分中的相对含量分别为19.24%,24.65%,18.31%和16.05%,含量很高;而在湖南、江苏、四川、辽宁4个产地未检出。37号组分氧化石竹烯(tR=25.18 min)在湖南、江苏、四川、辽宁4个产地的挥发性成分中的相对含量分别为12.63%,15.39%,9.42%和10.07%,而在河北、安徽、广西、贵州的相对含量分别为3.62%,0.19%,1.68%和0.28%,差异较为明显。38号组分δ-杜松烯(tR=25.44 min)在湖南、江苏、四川、辽宁4个产地的挥发性成分中的相对含量分别为16.08%,16.50%,19.91%和10.87%,而在河北、安徽、广西、贵州产地的相对含量分别为2.56%,2.69%,0.18%和1.25%,含量同样比较悬殊。这3个组分可作为区分不同产地路路通的标志性化合物,PCA 载荷分析与GC-MS分析结果基本一致。


图4 不同产地路路通的聚类分析系统树状图Fig.4 Cluster dendrogram of Liquidambar formosana Hance from different regions
2.4聚类分析
采用SPSS17.0中的聚类分析(Hierarchical cluster)对8个产地的路路通进行研究。在方法上选择类间平均链锁法(Between-groups linkage),在距离测量技术上选择欧式距离平方(Squared euclidean distance)。经过7步(8个样本)完成聚类,结果如图4所示。
图4直观地显示了聚类的整个过程。横坐标为路路通产地,纵坐标为类间的距离,距离值越小,表明组分越相似。由图可见,当类间的距离值小于10时,湖南、江苏、四川和辽宁产地的路路通聚为一类,广西、贵州、安徽和河北产地的路路通聚为一类,从而将8个产地的路路通分成两大类。聚类结果与主成分分析结果相一致,反映了不同产地路路通的亲疏远近关系,对中药路路通的质量评价具有一定的指导意义。
3结论
本研究采用顶空固相微萃取结合气相色谱-质谱技术分析了不同产地路路通的挥发性成分,以正交试验优化了影响顶空固相微萃取技术的各项因素。实验结果显示,湖南、江苏、四川、辽宁、河北、安徽、广西和贵州产地的路路通中分别鉴定出35,32,32,37,38,32,33和30种挥发性成分,总数为48种,其中19种挥发性成分为8个产地共有。主成分分析、聚类分析两种统计分析方法结果均表明,湖南、江苏、四川、辽宁4个产地的路路通挥发性成分比较相似,河北、安徽、广西、贵州的路路通挥发性成分比较接近。表明气相色谱-质谱联用技术结合化学计量学方法可以有效地对不同产地的路路通进行质量评价,从而为中药路路通的药物开发和科学栽培管理提供重要参考。
参考文献:
[1]Yu J,Liu S,Xuan L.Nat.Prod.Res.,2012,26(7):630-636.
[2]Chien S C,Xiao J H,Tseng Y H,Kuo Y H,Wang S Y.Holzforschung,2013,67(3):345-351.
[3]Wang K,Pan Y,Wang H,Zhang Y,Lei Q,Zhu Z,Li H,Liang M.Med.Chem.Res.,2010,19(2):166-176.
[4]Dat N T,Lee I S,Cai X F,Shen G,Kim Y H.Biol.Pharm.Bull.,2004,27(3):426-428.
[5]Liu Y M,Liu Y M,Li P X,Guo Y,Ma M.Chem.Ind.For.Prod.(刘亚敏,刘玉民,李鹏霞,郭莹,马明.林产化学与工业),2009,29(4):77-81.
[6]Montero-Prado P,Bentayeb K,Nerín C.FoodChem.,2013,138(1):724-731.
[7]Moradi M,Kaykhaii M,Ghiasvand A R,Shadabi S,Salehinia A.Phytochem.Anal.,2012,23(4):379-386.
[8]Liu Q,Zhang F,Wang Q R.J.Instrum.Anal.(刘倩,张凡,王庆荣.分析测试学报),2007,26(6):898-900.
[9]Zeng Q,Cao G Q,Li M,Yang C.J.Instrum.Anal.(曾茜,曹光群,李明,杨成.分析测试学报),2014,33(10):1136-1141.
[10]Zhang Y R,Gao Y N,Lin J Y,Zhou X Q.Chin.J.Anal.Chem.(张玉荣,高艳娜,林家勇,周显青.分析化学),2010,38(7):953-957.
[11]Prades A,Assa R R A,Dornier M,Pain J P,Boulanger R.J.Sci.FoodAgric.,2012,92(12):2471-2478.
[12]Wang H Y,Guo Y L,Zhang Z X,An D K.J.Instrum.Anal.(王昊阳,郭寅龙,张正行,安登魁.分析测试学报),2004,23(3):115-117.
[13]Qin G,Tao S,Cao Y,Wu J,Zhang H,Huang W,Zhang S.FoodChem.,2012,134(4):2367-2382.
[14]Sanchezpalomo E,Diazmaroto M,Perezcoello M.Talanta,2005,66(5):1152-1157.
[15]Lima P R,de Melo T S,Carvalho K M M B,de OliveiraB,Arruda B R,de Castro Brito G A,Rao V S,Santos F A.LifeSci.,2013,92(24/26):1195-1201.
[16]Lingaiah H B,Natarajan N,Thamaraiselvan R,Srinivasan P,Periyasamy B M.Fundam.Clin.Pharmacol.,2013,27(4):443-454.
[17]Chavan M J,Wakte P S,Shinde D B.Phytomedicine,2010,17(2):149-151.
[18]Nogueira Neto J D,Cardoso de Almeida A A C,Oliveira J S,dos Santos P S,de Sousa D P,de Freitas R M.Neurochem.Res.,2013,38(9):1861-1870.
欢迎订阅欢迎投稿欢迎刊登广告
Investigation of Volatile Components inLiquidambarformosanaHancefrom Different Geographical Origins by HS-SPME/GC-MS and Chemometrics Methods
YANG Yan-qin1,2,ZHOU Guo-jun1*,CHU Guo-hai1,YUAN Kai-long1,JIANG Jian1,DUAN Tai-cheng3*,PAN Yuan-jiang2
(1.Technology Center,China Tobacco Zhejiang Industrial Co.,Ltd,Hangzhou310024,China;2.Department of Chemistry,Zhejiang University,Hangzhou310027,China;3.Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun130022,China)
Abstract:The volatile compounds in the fruit of Liquidambar formosana Hance were investigated by headspace solid-phase microextraction with gas chromatography-mass spectrometry(HS-SPME/GC-MS).The conditions for HS-SPME were optimized by an orthogonal experimental design.Principal component analysis(PCA) and hierarchical clustering analysis were performed to distinguish the samples from different regions.The optimized extraction conditions were as follows:1.0 g of sample extraction using PDMS-DVB fiber for 40 min at 80 ℃,and a desorption time of 1 min.48 volatile compounds were identified in samples from eight geometrical origins.The compound types from different regions were roughly the same while the compound amounts varied with the origins.The two chemometrics methods suggested that the volatile components of L.formosana fruits originated from Hunan,Jiangsu,Sichuan and Liaoning were similar but differed greatly from that from Guizhou,Guangxi,Anhui and Hebei.The PCA results showed that caryophyllene oxide,δ-cadinene and nerolidol could be used as the representative volatile compounds for distinguishment of samples from different regions.The results demonstrated that the HS-SPME/GC-MS method was efficient in identifying volatile components in traditional Chinese medicine.In addition,by coupled with suitable pattern recognition techniques,the method was also powerful in distinguishing the geographical origins of the herbs,which was helpful for quality control of the medicines.
Key words:headspace solid-phase microextraction with gas chromatography-mass spectrometry(HS-SPME/GC-MS);volatile components;Liquidambar formosana Hance;different geographical regions;chemometrics methods
收稿日期:2015-08-13;修回日期:2015-09-30
基金项目:浙江中烟工业有限责任公司科技项目(ZJZY2014A003);国家自然科学基金资助项目(21275138);吉林省科技创新中心(大型科学仪器装备提升)项目(20150623001TC)
*通讯作者:周国俊,博士,研究员,研究方向:烟草化学,Tel:0571-81188389,E-mail:zhougj@zjtobacco.com
doi:10.3969/j.issn.1004-4957.2016.04.006
中图分类号:O657.63;TQ460.72
文献标识码:A
文章编号:1004-4957(2016)04-0406-08
段太成,博士,研究员,研究方向:光谱分析,Tel:0431-85262348,E-mail:tcduan@ciac.ac.cn
