小分子辐射防护药物的研究进展
2016-05-13张倩如李海涛田红旗
张倩如 李海涛 田红旗
300192天津,中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室(张倩如,田红旗);300192,天津滨江药物研发有限公司(李海涛)
小分子辐射防护药物的研究进展
张倩如 李海涛 田红旗
300192天津,中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室(张倩如,田红旗);300192,天津滨江药物研发有限公司(李海涛)
辐射防护药物能减少辐射损伤,促进损伤恢复,与细胞因子等大分子药物相比,小分子辐射防护药使用方便,没有潜在的免疫原风险。笔者汇总了硫醇类化合物、天然抗氧化剂、氮氧自由基、血管紧张素转化酶抑制剂等几类不同的辐射防护药物,对其辐射防护效果以及作用机制进行了总结、归纳,并对此类药物的研发前景进行了展望,旨在为辐射防护药物的进一步研发提供思路。
辐射,电离;辐射损伤;辐射防护剂;抗氧化剂;自由基清除剂
Fund programs:The IRM-CAMS Research Fund(1531);The IRM-CAMS Research and Innovation Team(1649)
辐射损伤是由电离辐射引起的机体组织损伤,大剂量射线瞬间照射或低剂量射线长时间照射都可引起组织损伤。辐射损伤通常发生在核泄漏事故、放射源丢失事故及肿瘤患者放疗过程中[1]。辐射防护药物一般指能抑制辐射损伤的初期阶段,保护生物敏感分子,或在照射后早期使用能减轻辐射损伤的发展,促进损伤恢复的物质。辐射防护药物根据分子量可以分为大分子辐射防护药和小分子辐射防护药,前者主要为细胞因子,如IL、粒细胞集落刺激因子、角质细胞生长因子等。相比此类辐射防护药,小分子辐射防护药的优势更明显:生产方便,价格低廉;没有潜在的免疫原风险;无需冷藏,使用方便,现正在研究中的一些化合物在动物模型中经口服给药亦有效[2]。目前被美国食品药品监督管理局(FDA)批准上市的小分子辐射损伤防护药只有氨磷汀,被用于减轻头颈部肿瘤患者在放疗过程中易出现的口腔干燥症。虽然该药活性较好,但有作用时间短,用量较大,容易发生恶心、呕吐和低血压等不良反应的缺点。此外,大部分药物还处于动物有效性的实验阶段,从实验动物转化到临床应用还需要进一步研究[3-4]。理想的辐射防护药物应具有结构稳定、辐射防护活性高、不良反应小、给药途径方便,对正常组织有保护作用,但对肿瘤组织无保护作用,药物本身被自由基修饰后不会引起进一步的靶分子损伤等特点。而现有的药物均存在一定缺陷,新型辐射防护药物亟待开发。
1 辐射防护药的作用机制
电离辐射对生物体的影响主要是使机体分子产生电离和激发。射线直接作用于生物大分子如核酸、蛋白质等,使它们发生电离和激发,导致化学键的断裂,从而导致机体正常功能和代谢作用的障碍。此外,射线也可与水反应产生大量活性氧(reactive oxygen species,ROS),如羟基自由基和超氧自由基等,此类物质的化学性质很活泼,能与其周围的蛋白质、脂质和核酸等生物大分子反应,造成氧化损伤[1]。
近年来研究发现,辐射防护药物的作用机制可分为以下几个方面:①清除氧化应激反应产生的大量ROS自由基,防止其破坏周围的生物大分子;②氧的存在可以使电离辐射损伤效应增强2~3倍,一些药物能在辐射敏感组织形成低氧环境,减少氧张力而起到保护作用,如作用于血管的组胺和血清素,即通过诱导局部缺氧发挥辐射防护作用;③电离辐射可使酶中的金属离子释放,故能螯合金属离子的化合物可能对辐射损伤有防护作用;④含-SH或-S-S-基团的药物进入体内后可以混合二硫化合物的形式固定到蛋白质或核酸分子上,保护蛋白和核酸分子中不稳定的-SH和-S-S,减少辐射引起的分子重排;⑤某些辐射防护药作用于机体,使机体内具有辐射防护作用的物质释放,从而保护敏感组织,如超氧化物歧化酶(super oxide dismutase,SOD)通过转换氧自由基生成过氧化氢,进而形成氧气和水,发挥辐射防护作用。谷胱甘肽还原酶通过生成还原型谷胱甘肽,维护体内氧化还原平衡并发挥作用;⑥机体受辐照后,产生以碳原子为中心的自由基,药物与生物靶分子自由基结合,提供氢原子,并将电子转移到非关键的分子上,从而避免由于靶分子的损伤而引起的一系列继发性辐射损伤反应;⑦药物与蛋白结合引起心血管休克、神经内分泌应激反应等一系列复杂的生化休克现象,最终产生防护效果;⑧DNA是辐射诱导损伤的主要靶点,电离辐射诱导p53信号通路,增加p21基因表达,使细胞周期停滞,最终导致细胞凋亡。因此,p53抑制剂通过阻断凋亡通路,防止细胞死亡,有较强的辐射防护作用。研究表明,很多药物通过多种作用机制协同发挥作用[1-3]。
2 辐射防护药的种类
2.1 硫醇类化合物
氨基硫醇类化合物作为辐射防护药已经进行了广泛研究,如半胱胺、胱胺、半胱氨酸、2-氨基乙基异硫脲、半胱胺硫代硫酸酯(WR-2721,WR-3689,WR-151327)及其噻唑烷衍生物(2,2-二甲基噻唑烷)等(图1)。它们具有基本的结构特征,即:包含自由巯基(或能水解出自由巯基),容易给出氢原子从而还原自由基;与氮官能团之间一般间隔2~3个碳原子。这种结构使其氨基在相邻巯基参与下,带部分正电荷,易与带负电荷的DNA分子相互作用,进而与DNA分子通过-S-S形成二硫化物发生辐射保护作用。此外,该类化合物亦能与核转录因子κB(nuclear factor κB,NF-κB)、激活蛋白1和p53等相互作用[5]。
氯基硫醇类化合物中活性最强的是氨磷汀(WR-2721,Amifostine)及其类似物(WR-3689和WR-151327)。氨磷汀已被美国食品药品监督管理局批准上市,能减轻放疗引发的口腔干燥症,但不影响头颈癌患者放疗后的存活时间。氨磷汀的肠溶微囊能显著提高小鼠的生存率,与口服氨磷汀组相比,给药3 h后,口服肠溶微囊组小鼠的组织中氨磷汀活性代谢产物WR-1065的浓度更高[4]。氨磷汀的体内代谢物WR-1065及其二硫化物WR-33278(图1)能激活转录因子NF-κB,增强MnSOD的表达[6]。Ormsby等[7]研究发现,在低辐射剂量(0.25 Gy)时,氨磷汀会加剧小鼠脾脏细胞的凋亡,而在高辐射剂量(6 Gy)时,则减少小鼠骨髓和脾脏细胞凋亡,提示氨磷汀的辐射损伤防护作用机制随辐射剂量的不同而有差异。目前,氨磷汀作为防护药用于肺癌、肝癌和乳腺癌放化疗的临床研究正在进行[8-9]。氨基硫醇的噻唑烷-2-酮衍生物是半胱氨酸、半胱胺和WR-1065的前药,具有更低的毒性。PrC-210(图1)是氨基硫醇衍生物,对全身致死剂量辐射小鼠有保护作用[10],可有效预防小鼠2~3级的放射性皮炎[11],经口服给药亦有效[12]。其剂量减低系数为1.6,与氨磷汀近似,但未见恶心、呕吐和低血压等不良反应[13]。体外研究显示,PrC-210抑制人成纤维细胞的生长(IC70为4.1 mmol/L),诱导p21蛋白表达,进而调节细胞周期进程[12]。Giese等[14]研究发现,PrC-210能显著减少辐射对豚鼠耳蜗螺旋神经节的损伤,可防止头、颈、脑部肿瘤在放疗过程中产生的听力丧失的不良反应。
与其他硫代磷酸酯相比,除氨磷汀以外的其他的氨基硫醇类辐射防护药如半胱胺、胱胺和2-氨基乙基异硫脲,二乙基二硫代氨基甲酸酯(diethyldithiocarbamate,DDC)、N-2-巯基丙酰基甘氨酸(N-2-mercaptopropionylglycine,MPG)和 N-乙酰基半胱氨酸(N-acetyl-L-cysteine,NAC)等(图1)具有较低的剂量减低系数,但不良反应也较少。比较4种含硫化合物的行为毒性发现,NAC是其中毒性最低的化合物,其次是氨磷汀、半胱胺和DDC[15]。MPG能减少淋巴细胞辐射诱导的染色体损伤,低剂量的MPG与氨磷汀联合使用,可以提高氨磷汀对辐射诱导小鼠的辐射防护作用,包括减少辐射诱导的染色体损伤、胃肠损伤和降低致死率[16]。有关DDC的研究发现,作为抗氧化酶活性的调节剂,其既对肿瘤有辐射增敏作用又对骨髓有辐射保护作用[17]。
目前,因种间差异,具有辐射防护作用的化合物怎样从临床前转化到临床应用;如何降低硫代磷酸酯类辐射防护药的使用剂量,优化其用药方式,增强其对正常辐射敏感组织的选择性等问题均需要进一步研究,氨基硫醇类化合物仍然具有很大的研究潜力。
2.2 天然抗氧化剂
天然抗氧化剂的辐射防护作用一般弱于合成的辐射防护药如氨磷汀等,但它们具有不良反应较低的特点,且使用方便,一直吸引人们广泛关注。机体内存在最多的抗氧化剂是谷胱甘肽和谷氨酰胺。谷胱甘肽在体内主要以还原形式存在,通过调节氧化还原平衡,影响DNA损伤和修复,影响多重细胞信号通路发挥辐射防护作用,但研究发现其辐射防护作用小于外源性氨基硫醇,如半胱胺[18]。谷氨酰胺是体内含量较多的氨基酸,是谷胱甘肽的前体化合物,参与调节氧化还原平衡,调节细胞凋亡和肿瘤细胞增殖,具有辐射防护活性[19]。
天然维生素(A、C、E)、β-胡萝卜素、硒、α-硫辛酸(图2)等均是天然抗氧化剂,具有辐射防护活性,其作用机制为减少氧自由基损伤[20]。维生素C通过清除自由基减少辐照小鼠的染色体畸变发生的频率[21]。维生素E能部分保护大鼠急性辐射诱导产生的肠炎。维生素E单独使用或与WR-3689联合使用可以提高辐照小鼠的存活率[21]。
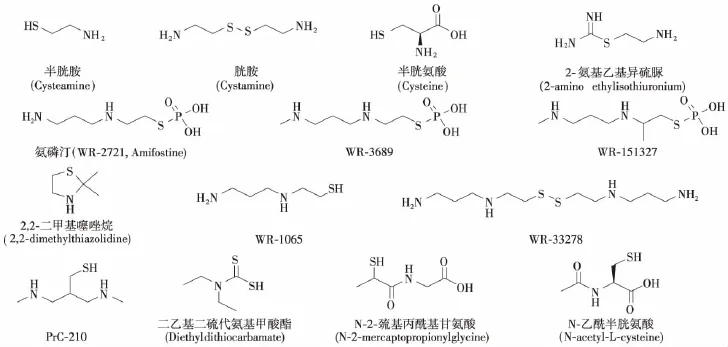
图1 氨基硫醇类辐射防护药的分子结构Figure 1 The molecular structure of aminothiolradioprotectors
黄酮类化合物是天然多酚化合物,具有很强的抗氧化活性。该类化合物能提供氢原子并捕获自由基(如羟基自由基等),故具有较强的防辐射活性[22]。染料木黄酮(图2)是一种天然大豆异黄酮,可以捕获活性氧自由基,具有较好的辐射防护活性。它耐受性好,使用方便,对正常组织具有辐射防护作用,对肿瘤组织具有辐射增敏作用[23]。它能降低转录因子NF-κB活性,进而调节许多细胞因子、趋化因子、免疫受体和细胞黏附分子的作用,减少细胞毒性。辐照前24 h给药,能明显增强照射小鼠的存活率,可能与激活干细胞,促进造血组织再生有关。主要缺陷是该化合物在循环系统中可被迅速清除,作用时间短[24]。白藜芦醇(图2)也是天然多酚化合物,能够减少辐射诱导的染色体畸变,同时对癌细胞有辐射增敏活性。贝加因(Baicalein,5,6,7-三羟黄酮)(图2)通过激活DNA修复系统,同时清除ROS提供机体的辐射保护作用[25]。
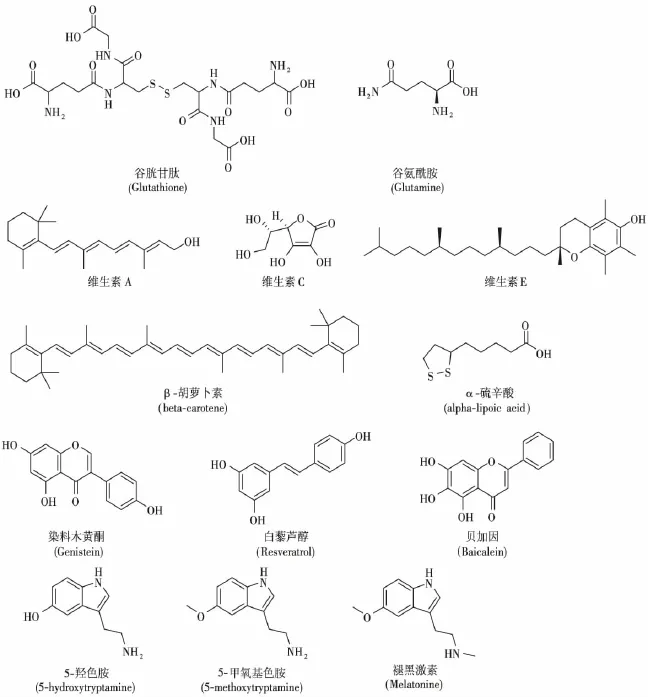
图2 天然抗氧化剂类辐射防护药的分子结构Fig.2 The molecular structure of natural antioxidant radioprotectors
5-羟色胺(5-hydroxytryptamine,5-HT)也称血清素(图2),是人体内的神经递质,是一种重要的生物活性胺。5-HT通过降低组织的氧化应激反应以发挥作用,其辐射防护活性与半胱胺近似。5-HT与氨磷汀合并使用具有协同效应[26]。5-甲氧基色胺(5-methoxytryptamine,5-MT)(图2)是5-HT甲基化产物,也是褪黑激素的代谢产物,其辐射防护作用与5-HT近似。褪黑激素(图2)为松果腺分泌物,也被发现存在于一些食用植物中,可有效捕获羟基和过氧自由基,具有抗氧化活性。它对正常组织具有很好的辐射防护作用,同时具有抗肿瘤活性,而且能穿透血脑屏障[27]。
2.3 甲基黄嘌呤
己酮可可碱(图3)属于甲基黄嘌呤家族,临床前研究显示,其具有良好的耐受性和水溶性及很强的抗肿瘤活性。己酮可可碱单独使用或与维生素E合用,可以减少辐射诱导的纤维化[28]。咖啡因(图3)是甲基黄嘌呤家族另一成员,可以减少辐射诱导小鼠的皮肤损伤,但不影响肿瘤生长[29]。
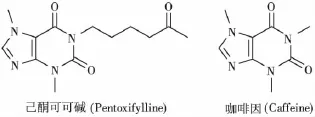
图3 甲基黄嘌呤类辐射防护药的分子结构Fig.3 The molecular structure of methylxanthines radioprotectors
2.4 氮氧自由基
氮氧自由基是一种具有自旋单电子的稳定自由基,已经广泛应用于防辐射研究。其抗氧化作用机制是清除组织中的ROS自由基,与SOD类似。这类防辐射化合物中研究最多的是4-羟基-2,2,6,6-四甲基哌啶氮氧自由基(Tempol)(图4),它能减轻脂质过氧化,减少或预防基因突变。临床前研究表明,小鼠辐射前给予Tempol能够减少严重的口干症,且其只对正常的组织有辐射防护作用,在肿瘤组织中则被快速代谢,基本没有防护作用[30]。然而在达到有效防护所需的剂量时,其亦有明显的不良反应,如低血压、增加心率和引发癫痫等。故而近年来,很多研究聚焦在它的还原形式——Tempol-H(图4),期望其较Tempol的耐受性更好。但结果显示,Tempol-H的毒性与Tempol近似[31]。NIT2011(图4)是一种稳定氮氧自由基,可以口服给药,能明显提高辐照小鼠的存活率[32]。JP4-039(图4)是一种线粒体靶向的氮氧自由基,它的特殊结构使其能在线粒体中富集,有效清除ROS。该药能有效改善荷瘤小鼠的骨髓抑制和口腔黏膜溃疡,并且对肿瘤组织无辐射防护作用[33]。化合物23C(图4)是另一种四甲基吡咯啉氮氧化合物,体外研究显示其亦具有较好的辐射防护活性[34]。
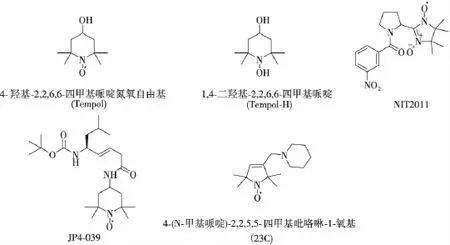
图4 氮氧自由基类辐射防护药的分子结构Fig.4 The molecular structure of nitroxidesradioprotectors
2.5 SOD及其类似物
SOD是一种天然的过氧化酶,主要通过与铜、锌和锰原子络合以配合物的形式存在(如CuZnSOD和MnSOD)。这些酶能捕获过氧自由基并加速它们转化为氧气和过氧化氢,具有很强的辐射防护作用。但由于它的半衰期短、分子质量大,不能自由地穿透细胞膜,从而限制了其临床应用[35]。为解决这些问题,研究者合成了一系列包含活性金属离子(如铁、铜、锌和锰)具有较强的辐射防护活性的小分子SOD模拟物。M40403(图5)是含双环己基吡啶的锰配合物,其催化活性等于或优于SOD。动物研究显示,它对急性辐射诱导的口腔黏膜炎有效,同时具有更好的稳定性和细胞渗透性,并可能减少SOD本身具有的免疫原性。对临床Ⅰ期和Ⅱ期约700例患者的研究显示,该化合物安全有效,并有很好的耐受性[36]。
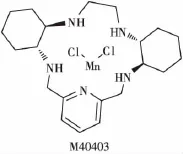
图5 M40403的分子结构Fig.5 The molecular structure of M40403
2.6 激素类辐射防护药
激素作为一类重要的辐射防护药,在动物实验中显示出一定的辐射防护作用。研究表明,甾体激素为体内重要的化学信号分子,与受体作用,调节基因表达,促进受损细胞修复。尼尔雌醇为我国研制的长效雌激素,且雌激素效应较低,能减少辐射后的骨髓细胞染色体损伤,目前已经应用于临床中[37]。E838为一种新的炔雌醇衍生物,王月英等[38]探讨了E838对辐射导致小鼠淋巴细胞DNA双链断裂的防护作用,结果:E838组受照小鼠淋巴细胞DNA双链断裂的彗星各项指标,如彗星尾部DNA百分比、彗星尾长等均低于阳性对照炔雌醇组和尼尔雌醇组,差异具有统计学意义(P<0.05)。张俊伶等[39]观察了17aα-D-高炔雌二醇-3-乙酯(17aα-D-homo-ethyhylestradiol-3-acetate,DHEA)、炔雌醇、炔雌三醇和雌三醇4种雌激素对辐射引起的造血系统损伤的防护作用,其中DHEA的防护效果最好,与其他各组相比,能显著提高照射后小鼠的骨髓有核细胞数、脾脏集落形成数目和脾脏指数。
此外,褪黑激素(N-乙酰-5-甲氧基色胺)为松果腺分泌物,具有抗氧化性质,并且可以增加抗氧化酶SOD、谷胱甘肽过氧化物酶等的表达,有很好的辐射防护活性。目前,放射治疗肿瘤协作组(Radiation Therapy Oncology Group)已将其作为肿瘤细胞的放射治疗增敏剂和正常细胞的辐射防护药应用于一项Ⅱ期临床试验[31]。邹磊等[40]考察了甾体类固醇衍生物AGE对急性辐射损伤小鼠的防护作用,发现AGE混悬液在一定剂量范围内经皮下注射或腹腔注射均可显著提高受照小鼠30 d存活率,促进小鼠外周血象恢复。
2.7 血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制剂
ACE抑制剂通过抑制血管紧张素Ⅱ信号通路,可以缓解辐射诱导损伤的晚期症状,包括肾损伤和肺损伤,以及促进急性辐照损伤的恢复[41]。卡托普利(图6)是广泛使用的降压药,可以在很大程度上缓解辐射诱导的肺损伤。动物实验结果显示,大多数ACE抑制剂均对辐射诱导的肾损伤有保护作用,其中卡托普利效果最好[41]。青霉胺(图6)是弱的ACE抑制剂,但具有很强的抗纤维化特性,并能抑制炎症。这类药物有组织特异性,但对胃肠道没有作用,限制了它们的使用[42]。
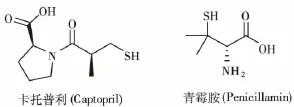
图6 卡托普利和青霉胺的分子结构Fig.6 The molecular structure of Captopril and Penicillamin
2.8 其他
有些水溶性富勒烯能够捕获ROS,具有很强的抗氧化性[43]。DF-1属于C60富勒烯家族,其在哺乳动物体内具有比氨磷汀更强的辐射防护作用,而且没有任何毒性[44]。体内各种酶、转录因子及结构蛋白等都含微量元素锌、铜、锰等,它们在DNA损伤修复过程中起重要作用。研究发现,铜、锌盐可以提高辐照小鼠的存活率。铜、锌盐与硫代磷酸酯类辐射防护剂合用,可以明显增加其防辐射活性,同时降低毒性。锌可以用于肿瘤放疗患者的辅助治疗,可以减少辐照所致的并发症。锌的天冬氨酸盐与氨磷汀合用具有协同作用[45]。食物中添加高剂量的硒可以减少大鼠辐射诱导的肾损伤[46]。Ex-Rad是昂克诺瓦公司(Onconova Therapeutics)开发的新型辐射防护剂,化学名为(E)-4-羧基苯乙烯基-4-氯苯甲基砜钠盐。Ex-Rad可预防和减轻辐射损伤作用,提高暴露于致死辐射剂量下的小鼠存活率。目前已进行Ⅰ期临床试验,可皮下注射或口服给药。与抗氧化剂或自由基清除剂不同,Ex-Rad可通过抑制p53磷酸化预防电离辐射诱导的凋亡,并可改善辐射诱导的外周血细胞减少,促进骨髓恢复[47]。
3 总结与展望
寻找理想的辐射防护药物以用于各种辐射环境的研究已经持续了60余年。早期的研究主要集中在硫醇类化合物和其他的抗氧化剂,目的是获得最高的剂量减低系数以减少辐照引发的病死率。然而,在提高辐射防护效果的同时,不良反应也在增多。其中防辐射活性最强的化合物氨磷汀已经被美国食品药品监督管理局批准上市,用于预防辐射导致的口腔干燥症,但由于其存在的不良反应,限制了它的广泛应用。继续研究氨基硫醇类化合物以开发高效低毒、作用时间长以及使用方便的化合物仍然很有前景。此外,通过调整使用剂量和方式,氨磷汀等硫代磷酸酯类化合物与其他辐射防护剂联合使用,有望维持其防辐射活性,同时减少不良反应。
尽管天然抗氧化剂及其类似物的防辐射活性较低,但其毒性也较低,而且许多化合物具有抗突变活性,故此类防护剂的研究应该被进一步扩展。有些化合物对正常细胞有防护作用,且对肿瘤组织具有辐射增敏作用,是放疗的理想化合物,应该进一步探讨这些化合物在辐射诱导产生的细胞凋亡过程中所起的作用,明确其是否对正常细胞有益而对肿瘤组织有害或无作用[48]。
其他药物的研发虽然取得一定进展,但同时也伴随着较多的缺点。除了不良反应,许多药物的特异性不强,对肿瘤组织亦具有辐射防护作用。这些药物还需要进一步深入研究,明确作用机制,开发出更好的药物并用于急慢性辐射的防护。研发急性辐射防护药物的同时,也需要研发可以长期使用的慢性辐射防护药物,用于长期工作在辐射环境中人员的预防性使用。
近年来,自由基已经成为化学辐射防护考虑的重要方面。此外,氧化应激反应的防御、细胞凋亡、细胞周期及原癌和抑癌基因等的调控,以及受体信号转导也被日益关注。鉴于电离辐射损伤的特点,对化学类辐射防护药的要求首先是结构稳定、高效和低毒;其次,防护剂本身不应在电离辐射后成为对细胞有毒性的化合物,但可以是供氢体或供电子体,从而提供损伤分子的化学修复;最后,从清除自由基的角度,化学防护剂应既可清除原发水的辐解产物,也可清除继发生物分子自由基,其本身被自由基修饰后不会介导进一步的靶分子损伤。综上所述,现有辐射防护剂还有很大的提升空间,虽然作用机制不同的辐射防护剂可显著提高小啮齿动物的辐射防护程度,并把毒性控制在较低水平内,但对大的哺乳动物的防护能力较差或毒性较高,应用不是很成功。研发用于处理急性辐射综合症的辐射防护药物,除了提高存活率外,还应该提高药物疗效窗口,允许足够的时间完成药物分散和药物相互作用。今后除继续探索新型、理想的抗放疗药物之外,还应有选择地将其中较有希望的药物予以完善,如辐射防护活性略低,但不良反应较小的药物。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张倩如负责论文撰写;李海涛、田红旗负责论文指导和审校。
[1]Vasin MV.Comments on the mechanisms of action of radiation protective agents:basis components and their polyvalence[J].Springerplus,2014,3:414.DOI:10.1186/2193-1801-3-414.
[2]Singh VK,Newman VL,Seed TM.Colony-stimulating factors for the treatment of the hematopoietic component of the acute radiation syndrome(H-ARS):A review[J].Cytokine,2014,71(1):22-37. DOI:10.1016/j.cyto.2014.08.003.
[3]Maier P,Wenz F,Herskind C.Radioprotection of normal tissue cells[J].StrahlentherOnkol,2014,190(8):745-752.DOI:10.1007/ s00066-014-0637-x.
[4]A G,Ren L,Zhou Z,et al.Design and evaluation of biodegradable enteric microcapsules of amifostine for oral delivery[J].Int J Pharm, 2013,453(2):441-447.DOI:10.1016/j.ijpharm.2013.06.019.
[5]Shen H,Chen ZJ,Zilfou JT,et al.Binding of the aminothiol WR-1065 to transcription factors influences cellular response to anticancer drugs[J].J Pharmacol Exp Ther,2001,297(3):1067-1073.
[6]Murley JS,Kataoka Y,Baker KL,et al.Manganese superoxide dismutase(SOD2)-mediated delayed radioprotection induced by the free thiol form of amifostine and tumor necrosis factor alpha[J].Radiat Res,2007,167(4):465-474.DOI:10.1667/RR0758.1.
[7]Ormsby RJ,Lawrence MD,Blyth BJ,et al.Protection from radiation-induced apoptosis by the radioprotector amifostine(WR-2721)is radiation dose dependent[J].Cell Biol Toxicol,2014,30(1):55-66.DOI:10.1007/s10565-014-9268-3.
[8]Feng M,Smith DE,Normolle DP,et al.A phase I clinical and pharmacology study using amifostine as a radioprotector in dose-escalated whole liver radiation therapy[J].Int J Radiat Oncol Biol Phys, 2012,83(5):1441-1447.DOI:10.1016/j.ijrobp.2011.10.020.
[9]Koukourakis MI,Panteliadou M,Abatzoglou IM,et al.Postmastectomy hypofractionated and accelerated radiation therapy with(and without)subcutaneous amifostine cytoprotection[J/OL].Int J Radiat Oncol Biol Phys,2013,85(1):e7-13[2016-08-20].http://www. sciencedirect.com/science/article/pii/S0360301612034037.DOI:10.1016/j.ijrobp.2012.08.017.
[10]Copp RR,Peebles DD,Fahl WE.Synthesis and growth regulatory activity of a prototype member of a new family of aminothiol radioprotectors[J].Bioorg Med Chem Lett,2011,21(24):7426-7430. DOI:10.1016/j.bmcl.2011.10.011.
[11]Copp RR,Peebles DD,Soref CM,et al.Radioprotective efficacy and toxicity of a new family of aminothiol analogs[J].Int J Radiat Biol,2013,89(7):485-492.DOI:10.3109/09553002.2013. 770579.
[12]Peebles DD,Soref CM,Copp RR,et al.ROS-scavenger and radioprotective efficacy of the new PrC-210 aminothiol[J].Radiat Res, 2012,178(1):57-68.
[13]Soref CM,Hacker TA,Fahl WE.A new orally active,aminothiol radioprotector-free of nausea and hypotension side effects at its highest radioprotective doses[J/OL].Int J Radiat Oncol Biol Phys,2012, 82(5):e701-707[2016-08-20].http://www.sciencedirect.com/ science/article/pii/S0360301611035954.DOI:10.1016/j.ijrobp. 2011.11.038.
[14]Giese AP,Guarnaschelli JG,Ward JA,et al.Radioprotective Effect of Aminothiol PrC-210 on Irradiated Inner Ear of Guinea Pig[J/OL]. PLoS One,2015,10(11):e0143606[2016-08-20].http://journals. plos.org/plosone/article?id=10.1371/journal.pone.0143606.DOI:10.1371/journal.pone.0143606.
[15]Citrin D,Cotrim AP,Hyodo F,et al.Radioprotectors and mitigators of radiation-induced normal tissue injury[J].Oncologist,2010,15(4):360-371.DOI:10.1634/theoncologist.2009-S104.
[17]Bogojevic′D,PoznanoviG,GrdoviN,et al.Administration of rat acute-phase protein α(2)-macroglobulin before total-body irradiation initiates cytoprotective mechanisms in the liver[J].Radiat Environ Biophys,2011,50(1):167-179.DOI:10.1007/s00411-010-0331-z.
[18]Chatterjee A.Reduced glutathione:a radioprotector or a modulator of DNA-repair activity?[J].Nutrients,2013,5(2):525-542.DOI:10.3390/nu5020525.
[19]Matés JM,Pérez-Gómez C,de Castro IN,et al.Glutamine and its relationship with intracellular redox status,oxidative stress and cell proliferation/death[J].Int J Biochem Cell Biol,2002,34(5):439-458.DOI:10.1016/S1357-2725(01)00143-1.
[20]Weiss JF,Landauer MR.Protection against ionizing radiation by antioxidant nutrients and phytochemicals[J].Toxicology,2003,189(1/2):1-20.DOI:10.1016/S0300-483X(03)00149-5.
[21]Mozdarani H,Nazari E.Frequency of micronuclei in 4-8 cell mouse embryos generated after maternal gamma-irradiation in the presence and in the absence of vitamin C[J].Radiat Environ Biophys,2007,46(4):417-422.DOI:10.1007/s00411-007-0118-z.
[22]Szejk M,Kołodziejczyk-Czepas J,·Zbikowska HM.Radioprotectors in radiotherapy-advances in the potential application of phytochemicals[J/OL].Postepy Hig Med Dosw(Online),2016,70:722-734. [2016-08-24].https://www.ncbi.nlm.nih.gov/pubmed?term=radioprotector%20in%20radiotherapy%20advances%20in%20the% 20potential%20application%20of%20phytochemicals&cmd=correctspelling.DOI:10.5604/17322693.1208039.
[23]Xu P,Zhang WB,Cai XH,et al.Flavonoids of Rosa roxburghii Trattact as radioprotectors[J].Asian Pac J Cancer Prev,2014,15(19):8171-8175.DOI:10.7314/APJCP.2014.15.19.8171.
[24]Aprotosoaie AC,Trifan A,Gille E,et al.Can phytochemicals be a bridge to develop new radioprotective agents?[J].Phytochemistry Reviews,2014,14(4):1-12.DOI:10.1007/s11101-014-9379-8.
[25]Kamran MZ,Ranjan A,Kaur N,et al.Radioprotective Agents:StrategiesandTranslationalAdvances[J].MedResRev,2016,36(3):461-493.DOI:10.1002/med.21386.
[26]Madhu LN,Kumari NS.Radioprotective effect of sulphydryl group containing triazole derivative to modulate the radiation-induced clastogenic effects[J].Res Pharm Sci,2014,9(1):23-29.
[27]Mihandoost E,Shirazi A,Mahdavi SR,et al.Can melatonin help us in radiation oncology treatments?[J/OL].Biomed Res Int,2014, 2014:578137[2016-06-20].https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC4037598.DOI:10.1155/2014/578137.
[28]Kamran MZ,Gude RP.Pentoxifylline inhibits melanoma tumor growth and angiogenesis by targeting STAT3 signaling pathway[J]. Biomed Pharmacother,2013,67(5):399-405.DOI:10.1016/j. biopha.2013.03.020.
[29]Hebbar SA,Mitra AK,George KC,et al.Caffeine ameliorates radiation-induced skin reactions in mice but does not influence tumour radiation response[J].J Radiol Prot,2002,22(1):63-69.DOI:10. 1088/0952-4746/22/1/306.
[30]Cotrim AP,Hyodo F,Matsumoto K,et al.Differential radiation protection of salivary glands versus tumor by Tempol with accompanying tissue assessment of Tempol by magnetic resonance imaging[J]. Clin Cancer Res,2007,13(16):4928-4933.DOI:10.1158/1078-0432.CCR-07-0662.
[31]Johnke RM,Sattler JA,Allison RR.Radioprotective agents for radiation therapy:future trends[J].Future Oncol,2014,10(15):2345-2357.DOI:10.2217/fon.14.175.
[32]Wang H,Jia Y,Gao P,et al.Synthesis,radioprotective activity and pharmacokinetics characteristic of a new stable nitronylnitroxyl radical-NIT2011[J].Biochimie,2013,95(8):1574-1581.DOI:10.1016/j.biochi.2013.04.011.
[33]Shinde A,Berhane H,Rhieu BH,et al.Intraoral mitochondrial-targeted GS-nitroxide,JP4-039,radioprotects normal tissue in tumorbearing radiosensitive fancd2(-/-)(C57BL/6)mice[J].Radiat Res, 2016,185(2):134-150.DOI:10.1667/RR14035.1.
[34]Davis RM,Sowers AL,DeGraff W,et al.A novel nitroxide is an effective brain redox imaging contrast agent and in vivo radioprotector[J].Free Radic Biol Med,2011,51(3):780-790.DOI:10.1016/ j.freeradbiomed.2011.05.019.
[35]Huang XJ,Song CX,Zhong CQ,et al.Research progress in the radioprotective effect of superoxide dismutase[J].Drug Discov Ther,2012,6(4):169-177.DOI:10.5582/ddt.2012.v6.4.169.
[36]Murphy CK,Fey EG,Watkins BA,et al.Efficacy of superoxide dismutase mimetic M40403 in attenuating radiation-induced oral mucositis in hamsters[J].Clin Cancer Res,2008,14(13):4292-4297.DOI:10.1158/1078-0432.CCR-07-4669.
[37]刘琳,黄荣清,肖炳坤,等.激素类抗辐射药物的研究进展[J].医药导报,2010,29(6):744-746.DOI:10.3870/yydb.2010.06. 021. Liu L,Huang RQ,Xiao BK,et al.Progress in hormone anti-radiation drugs[J].Her Med,2010,29(6):744-746.
[38]王月英,刘强,吴红英,等.E838对辐射所致小鼠淋巴细胞DNA双链断裂的防护作用[J].肿瘤防治研究,2010,37(7):748-750,762.DOI:10.3971/j.issn.1000-8578.2010.07.004. Wang YY,Liu Q,WU HY,et al.Protectiveeffects of E838 on mouse lymphocyte double-strand DNA broken induced by radiation[J]. Cancer Res Prev Treat,2010,37(7):748-750,762.
[39]张俊伶,路璐,李德冠,等.四种雌激素对放射性造血损伤防护效应的比较[J].中国医药导报,2015,12(10):4-6,17. Zhang JL,Lu L,Li DG,et al.Comparison of four kinds of estrogen′s effect on irradiation induced hematopoietic system injury[J].Chin Med Rep,2015,12(10):4-6,17.
[40]邹磊,李一鸣,杨建云,等.甾体类固醇衍生物AGE对60Co γ射线辐射C57小鼠治疗作用[J].科学技术与工程,2015,15(17):29-33.DOI:10.3969/j.issn.1671-1815.2015.17.006. Zou L,Li YM,Yang JY,et al.Therapeutic effects of steroid steroidal derivatives AGE on60Co γ-ray irradiation-injured C57 mice[J].Sci Tech Engrg,2015,15(17):29-33.
[41]Srinivasan V,Weiss JF.Radioprotection by vitamin E:injectable vitamin E administered alone or with WR-3689 enhances survival of irradiated mice[J].Int J Radiat Oncol Biol Phys,1992,23(4):841-845.DOI:10.1016/0360-3016(92)90657-4.
[42]Gudkov SV,Popova NR,Bruskov VI.Radioprotective substances:History,trends and prospects[J].Biophysics,2015,60(4):659-667.DOI:10.1134/S000635091504012.
[43]Xiao L,Takada H,Maeda K,et al.Antioxidant effects of water-soluble fullerene derivatives against ultraviolet ray or peroxylipid through their action of scavenging the reactive oxygen species in human skin keratinocytes[J].Biomed Pharmacother,2005,59(7):351-358.DOI:10.1016/j.biopha.2005.02.004.
[44]Theriot CA,Casey RC,Moore VC,et al.Dendro[60C]fullerene DF-1 provides radioprotection to radiosensitive mammalian cells[J].Radiat Environ Biophys,2010,49(3):437-445.DOI:10.1007/ s00411-010-0310-4.
[45]Weiss JF,Landauer MR.History and development of radiation-protective agents[J].Int J Radiat Biol,2009,85(7):539-573.DOI:10.1080/09553000902985144.
[46]Roman M,Jitaru P,Barbante C.Selenium biochemistry and its role for human health[J].Metallomics,2014,6(1):25-54.DOI:10. 1039/c3mt00185g.
[47]Chun AW,Freshwater RE,Taft DR,et al.Effects of formulation and route of administration on the systemic availability of Ex-RADR,a new radioprotectant,in preclinical species[J].Biopharm Drug Dispos,2011,32(2):99-111.DOI:10.1002/bdd.741.
[48]Bonner MY,Arbiser JL.The antioxidant paradox:what are antioxidants and how should they be used in a therapeutic context for cancer[J].Future Med Chem,2014,6(12):1413-1422.DOI:10. 4155/fmc.14.86.
Small molecule compounds against radiation:research advances
Zhang Qianru,Li Haitao,Tian Hongqi
Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine,Institute of Radiation Medicine,Chinese Academy of Medical Sciences,Peking Union Medical College,Tianjin 300192,China(Zhang QR,Tian HQ);Tianjin Binjiang Pharma,Inc,Tianjin 300192,China(Li HT)
Tian Hongqi,Email:tianhongqi@irm-cams.ac.cn
Radioprotectors are designed to disrupt the progress of damage caused by radiation in normal tissues and to promote the recovery of the damaged tissues.This article review the function of the following agents as radioprotectors and their mechanism of action:sulfhydryl compounds,natural antioxidants,nitroxides,and angiotensin-converting enzyme inhibitors.Prospective functions of these agents were also discussed.This article hope to provide researchers with insights into radioprotectorresearch.
Radiation,ionizing; Radiation injuries;Radiation-protective agents;Antioxidants; Free radical scavengers
田红旗,Email:tianhongqi@irm-cams.ac.cn
10.3760/cma.j.issn.1673-4114.2016.05.012
中国医学科学院放射医学研究所发展基金(1531);中国医学科学院放射医学研究所科研创新团队项目(创新1649)
2016-08-25)
