豚鼠模型卡介苗接种所引发的淋巴结炎致病菌的分离和鉴定
2016-05-12王丁丁付丽丽寇丽杰张婷董巧香赵爱华
王丁丁 付丽丽 寇丽杰 张婷 董巧香 赵爱华
豚鼠模型卡介苗接种所引发的淋巴结炎致病菌的分离和鉴定
王丁丁 付丽丽 寇丽杰 张婷 董巧香 赵爱华
目的 建立由卡介苗接种所引发的淋巴结炎致病菌分离与菌型鉴定的豚鼠模型,研究卡介苗临床不良反应病原学的鉴定方法。 方法 按照随机数字表法将39只豚鼠分为生理盐水组(3只),高剂量和低剂量卡介苗接种组(各18只)。分别于注射生理盐水和卡介苗后4、5、8周对豚鼠进行解剖,手术摘取卡介苗接种后豚鼠的淋巴结与局部脓肿,研磨处理为组织悬液。将组织悬液接种于改良罗氏培养基、7H11培养基、7H9液体培养基进行培养,同时对组织悬液进行抗酸染色与卡介菌特异性缺失区1(BCG RD1)的检测。培养结束后对3种培养物均进行抗酸染色与BCG RD1的检测。结果 组织悬液在改良罗氏培养基上培养阳性结果为淋巴结33/33,脓肿6/6;在7H11培养基上培养阳性结果为淋巴结33/33,脓肿6/6;在7H9液体培养基阳性结果为淋巴结22/33,脓肿6/6。培养物抗酸染色结果呈阳性,细菌形态与特性与卡介菌一致;培养物BCG RD1的检测结果与卡介苗DNA国家参考品及皮内注射用卡介苗特异性鉴别试验用国家参考品的扩增结果一致(196 bp)。结论 卡介苗接种导致的淋巴结炎的相关标本可以通过固体培养法培养出致病菌,对培养物进行BCG RD1的检测可以鉴定菌型。卡介苗高剂量免疫、选取肿大淋巴结作为检查样本和固体培养基培养法更有利于模型的建立。
卡介苗; 免疫; 淋巴结炎; 基因缺失; 诊断,鉴别
按国家《预防接种工作规范》[1]中疫苗接种程序规定,卡介苗(BCG)在婴儿出生时即接种,通常在出生24 h内完成。根据近年疫苗疑似预防接种异常反应(adverse events following immunization,AEFI)监测数据分析,BCG接种后会出现一定程度的不良反应。主要不良反应为淋巴结炎,发生率为17.7/100万剂~54.4/100万剂,其中,严重不良反应包括全身播散性卡介菌感染,其病死率高,预后差[2-5]。能够准确无误地鉴定 BCG在临床上具有重要意义,比如医生如果可以准确判断得淋巴结炎的患者是因为BCG接种所导致的并发症,就可以确保由BCG接种引发异常反应的患者及时得到国家医疗赔偿[6]。
目前,临床上对BCG接种后淋巴结炎及其他不良反应的诊断主要是根据BCG接种史、X线胸部摄影、B超检查辅助诊断,以及查看淋巴结及其脓液所含的菌株类型。其中对菌株的鉴定主要通过对针吸脓液和手术切除物等方法所得标本进行涂片观察是否呈抗酸杆菌阳性,以及细菌培养并根据培养物对噻吩-2-羧酸肼(TCH)的敏感情况来判断菌种是否为牛结核分枝杆菌[7]。如果菌种鉴定为牛结核分枝杆菌,则临床上可以将其等同为BCG。虽然这一方法目前被有些学者认为是临床诊断由BCG接种所引发淋巴结炎的金标准[8-11],但是,通过培养物对TCH的敏感性来辨别菌种是否为牛结核分枝杆菌存在敏感度低和假阳性率高的问题,因此这一方法在实质上难以作为鉴定牛结核分枝杆菌的可靠依据[12-13]。此外,国际上对类似病例的病原菌鉴别多鉴定到BCG甚至BCG亚株[14-15]。分枝杆菌全基因组测序研究发现了不同分枝杆菌遗传学上的差异,卡介菌与其他有毒分枝杆菌遗传学上的差异研究,采用分子生物学方法来鉴别卡介菌与牛结核分枝杆菌及结核分枝杆菌[16-17],但不能作为BCG接种后淋巴结炎及其他不良反应的诊断依据。因此,这些问题是国内目前在临床上对于BCG接种所引发的不良反应致病菌鉴定的主要局限。致病菌鉴定面临以下3个问题:(1)培养方法标准化与检出率问题;(2)牛结核分枝杆菌与结核分枝杆菌菌种鉴定的方法学问题;(3)牛结核分枝杆菌与BCG菌种鉴定的方法学问题。
为了克服现有的这些局限,从而提高临床上对BCG病菌鉴定的敏感度和准确性,本研究旨在:(1)建立豚鼠模型来模拟人BCG接种导致的淋巴结炎;(2)利用该豚鼠模型来探索不同的体外培养方法对BCG病菌检出率的影响;(3)验证利用现有分子生物学方法鉴定BCG特异性的可行性。
材料和方法
一、材料
1. 材料:BCG (D2PB302)、皮内注射用卡介苗特异性鉴别试验用国家参考品(2014国生参字0055)、BCG DNA国家参考品(2014国生参字0053)[18]、改良罗氏培养基(L-J)、稀释苏通培养基由中国食品药品检定院提供。7H9液体培养基为美国BD公司产品。引物:ET1:5′-AAGCGGTTGCCGCCGACCGACC-3′;ET2: 5′-CTGGCTATA-TTCCTGGGCCCGG-3′;ET3:5′-GAGGCGATCTGGCGGTTTGGGG-3′由上海生工生物工程技术服务有限公司合成,Taq酶购自Takara公司(日本),抗酸染色试剂由中国食品药品检定院提供。7H11培养基购自Sigma公司(美国)。
2.实验动物:无特定病原体(specific pathogen free, SPF)级Hartley豚鼠,250~350 g/只,雌性,39只,由中国食品药品检定研究院实验动物中心提供。
二、 淋巴结炎动物模型的建立
根据随机数字表法随机选取Hartley豚鼠用于3个处理组:生理盐水对照组(用作病理切片对照)3只,再分为3个时间点组(4周组、5周组、8周组),每组1只;低剂量BCG接种组18只,再分为3个时间点组(4周组、5周组、8周组),每组 6只;高剂量BCG接种组18只,再分为3个时间点组(4周组、5周组、8周组),每组6只。分别于左后大腿内侧皮内注射0.2 ml生理盐水(对照)、0.2 ml 1人剂量(0.05 mg)BCG、0.2 ml 10人剂量(0.5 mg)BCG,然后于免疫后4、5、8周观察和解剖注射部位侧的腹股沟淋巴结及局部脓肿来查看淋巴结炎的状况。
三、方法
1. 淋巴结和脓肿标本的获取和预处理:从注射侧腹股沟解剖获取淋巴结和从注射部位解剖获取脓肿组织,将这些组织置于5%硫酸中浸泡约30 s,然后用生理盐水洗涤3次,最后用稀释苏通培养基洗涤1次放入无菌培养皿内备用。
2. 淋巴结和脓肿标本的研磨:将上述预处理过的标本移入无菌玻璃研磨器内,加入3 ml稀释苏通培养基进行研磨获取均匀组织悬液。
3. 细菌培养:将上述所得组织悬液用稀释苏通培养基进行10倍系列稀释,分别吸取原液及10倍系列稀释液接种到3种不同的培养基上,其中改良罗氏培养基(8 ml中管规格)接种0.1~0.3 ml/支,7H11培养基(30 ml平皿规格)接种0.3~0.5 ml/个,7H9液体培养基(7.8 ml小管规格)接种0.5 ml/支。改良罗氏(L-J)培养基与7H11培养基置(37.5±0.5)℃培养4~5 周,观察记录长出菌落的数量和所需时间。7H9液体培养基置BACTEC MGIT 960中培养,观察48 d,观察记录报告阳性(简称“报阳”)的数量和所需时间。随机选取9例淋巴结样本同时进行L-J培养基和7H11培养基培养,观察记录两种固体培养基培养出的菌落数。用Statistics 17.0软件对实验数据进行分析。
4.抗酸染色:将组织悬液和培养物研磨液加入生理盐水稀释,取50 μl涂片,自然干燥火焰固定后进行抗酸染色,显微镜下观察细菌形态与特征。
5. PCR反应模板制备:取培养物菌落,悬浮于无菌生理盐水中,80 ℃ 30 min灭活后,6010×g离心10 min,弃上清,留下约20~40 μl液体重悬样品,沸水浴10 min,6010×g离心10 min,取上清作为PCR反应模板。
6.多重PCR扩增(菌型鉴定)[19-20]:采用多重PCR法检测卡介菌特异性缺失区1(RD1), 用国家参考品及BCG DNA国家参考品作为对照对皮内注射用BCG进行特异性鉴定,根据试验样品扩增片段大小与BCG及BCG DNA国家参考品是否一致作出判断。
结 果
一、 淋巴结炎动物模型建立结果
生理盐水组3只豚鼠在注射后4周解剖1只分离出1枚淋巴结;注射后5周解剖1只分离出1枚淋巴结;注射后8周解剖1只分离出淋巴结。3只豚鼠均未见局部脓肿(图1)。
高剂量组18只豚鼠在注射后4周解剖6只每只各分离出1枚淋巴结,均未见局部脓肿;在注射后5周解剖6只每只各分离出1枚淋巴结,其中有3只各分离出1个脓肿;在注射后8周解剖6只每只各分离出1枚淋巴结,其中有3只各分离出1个脓肿。分离出的淋巴结肉眼可见肿大、变硬,肿大的淋巴结包膜完整、质地较柔软(图2);变硬的淋巴结则表面充血(图3);脓肿尚未破溃,包膜完整(图4)。
低剂量组18只豚鼠在注射后4周解剖6只每只各分离出1枚淋巴结;在注射后5周解剖6只其中有3只各分离出1枚淋巴结,另外3只未分离出淋巴结;在注射后8周解剖6只每只各分离出1枚淋巴结;18只豚鼠均未见局部脓肿。

图1 生理盐水组分离的淋巴结。依次为注射后4、5、8周时分离的淋巴结
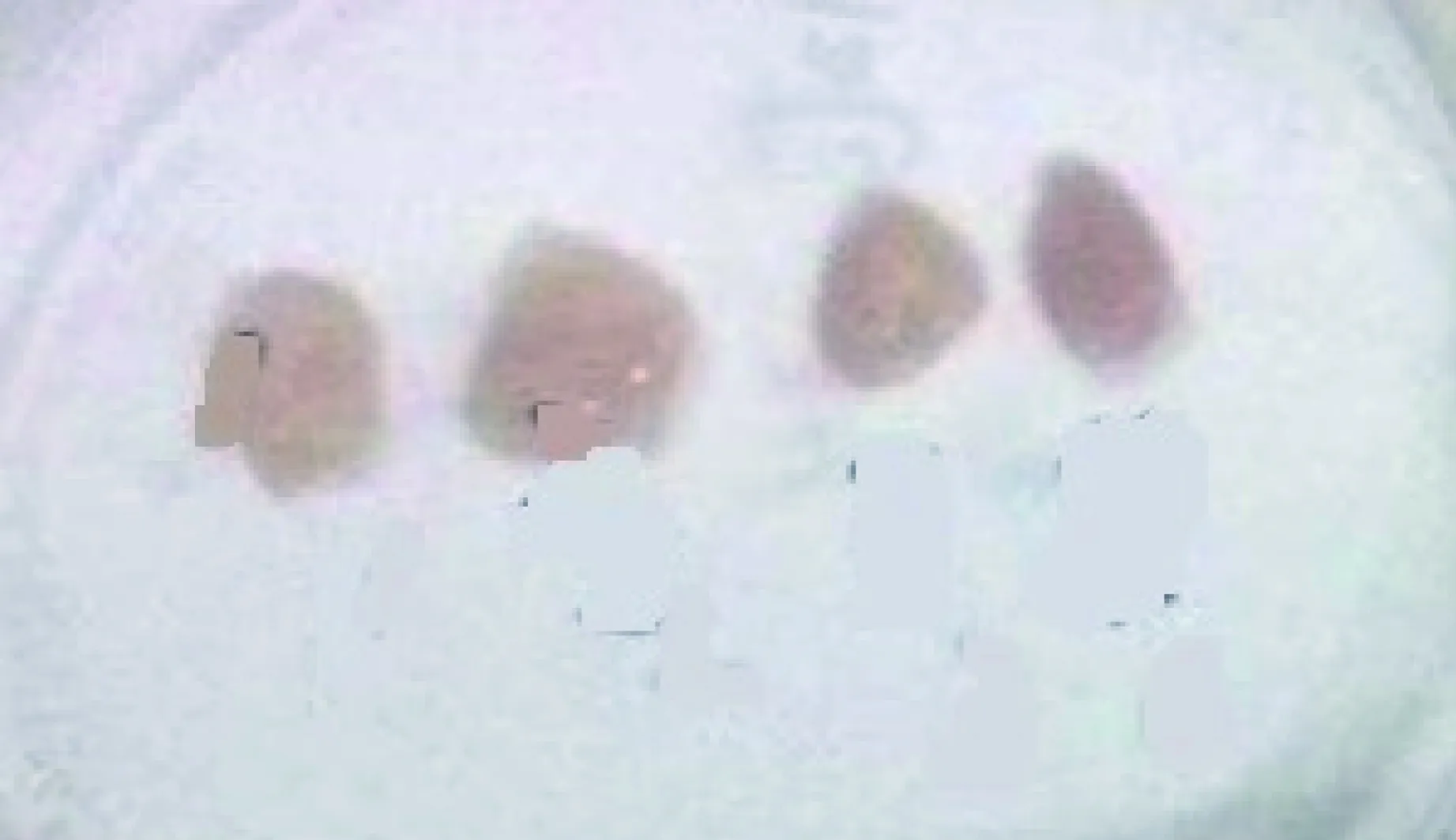
图2 BCG免疫高剂量组分离的肿大淋巴结。肉眼可见肿大、变硬,肿大的淋巴结包膜完整、但质地较柔软
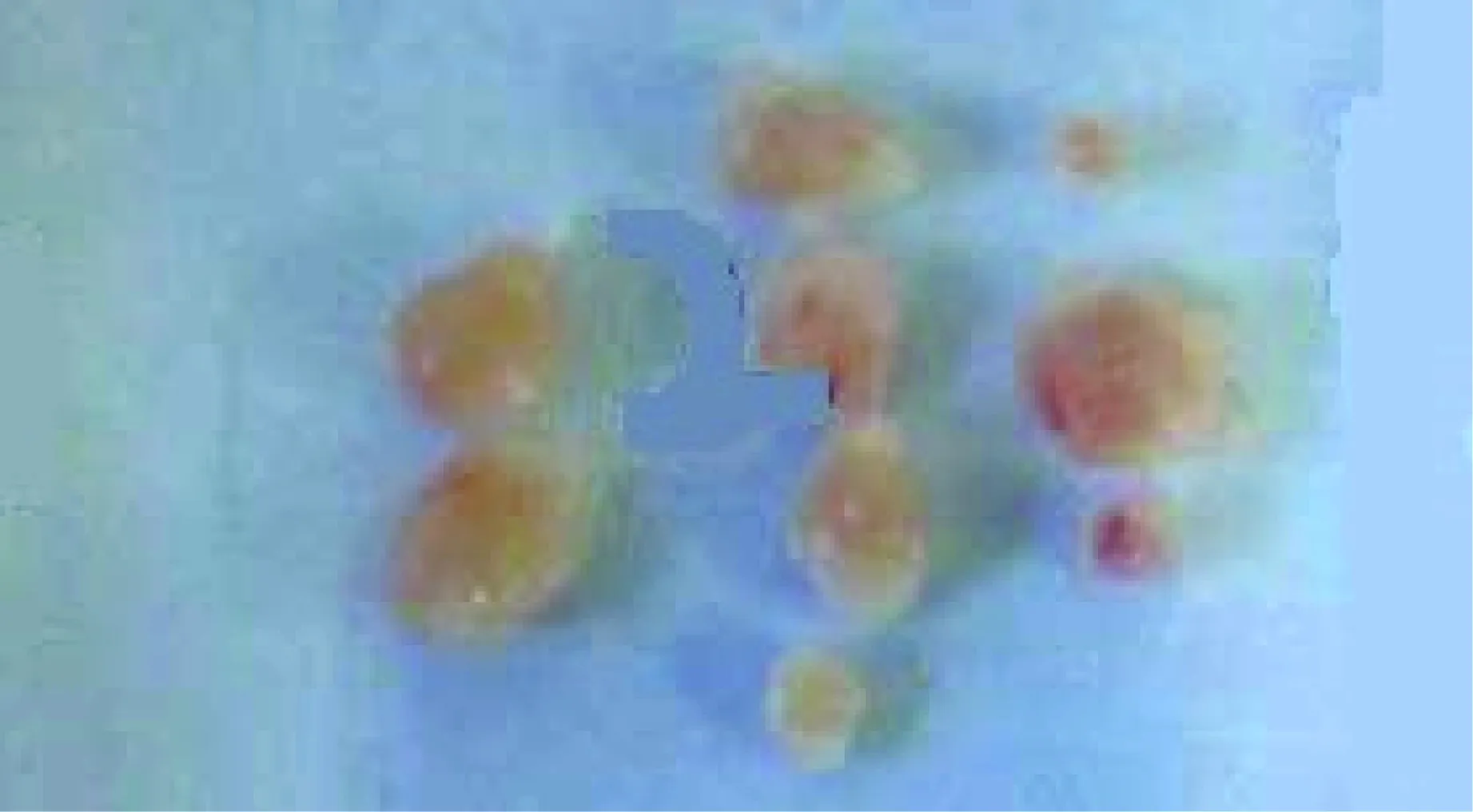
图3 BCG免疫高剂量组分离的淋巴结。其质地变硬,表面充血淋巴结(肉眼可见表面充血)
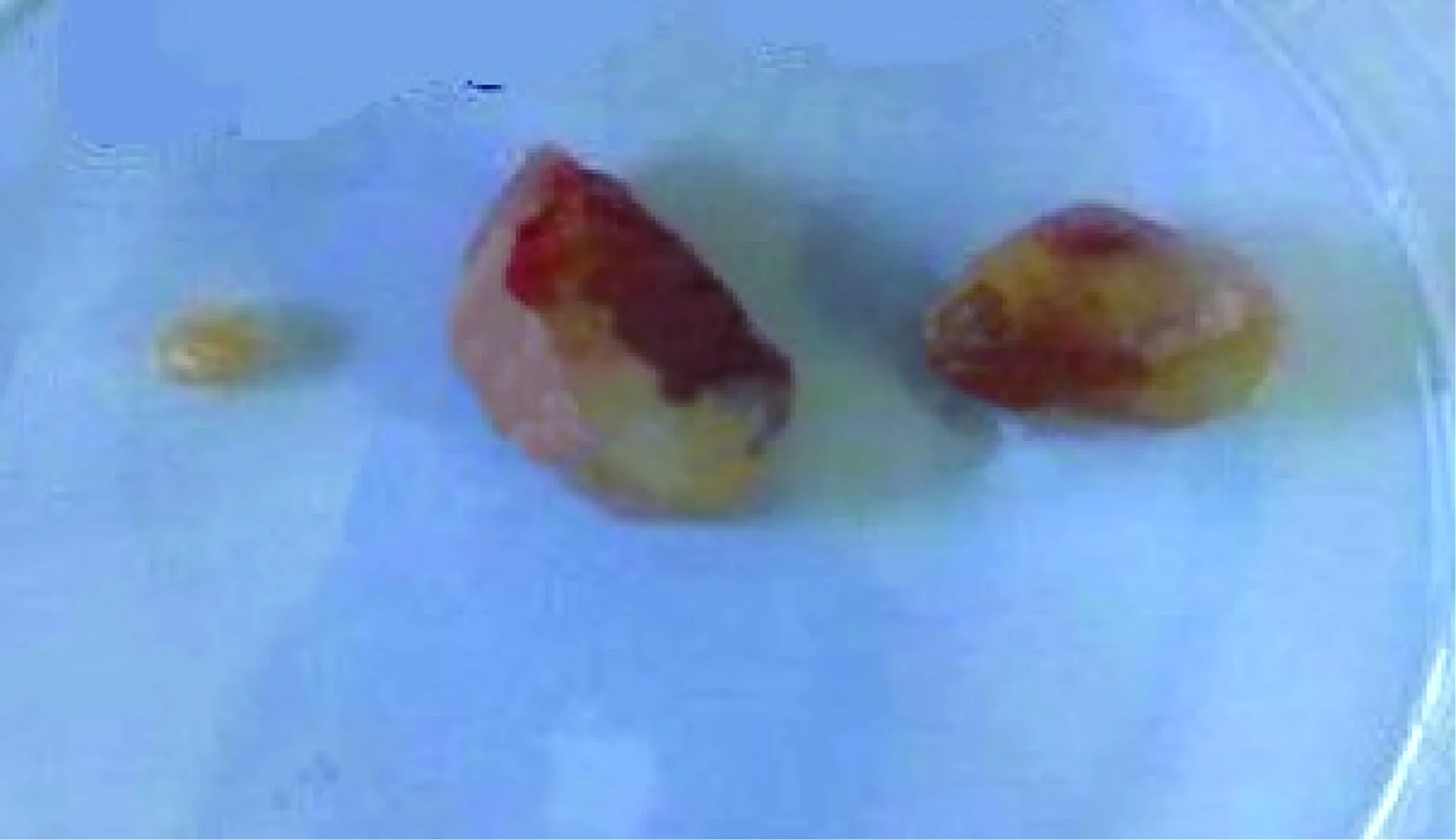
图4 BCG免疫高剂量组分离的局部脓肿
淋巴结病理切片结果: BCG高剂量注射组淋巴结表现为淋巴结皮质内大量上皮样细胞灶状聚集,可见多核巨细胞,肉芽肿中心可见干酪样坏死区(图5)。
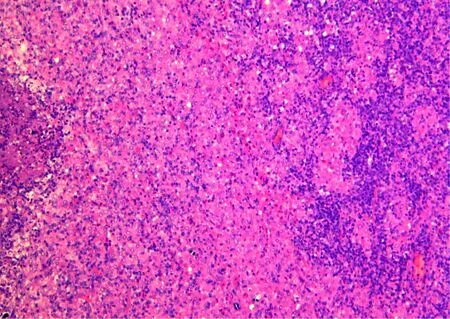
淋巴结皮质内大量上皮样细胞灶状聚集,可见多核巨细胞,肉芽肿中心可见干酪样坏死区图5 BCG高剂量组淋巴结病理切片(HE ×100)
BCG低剂量注射组淋巴结表现为淋巴结皮质内大量上皮样细胞灶状聚集,可见多核巨细胞、上皮样细胞弥漫性分布(图6)。
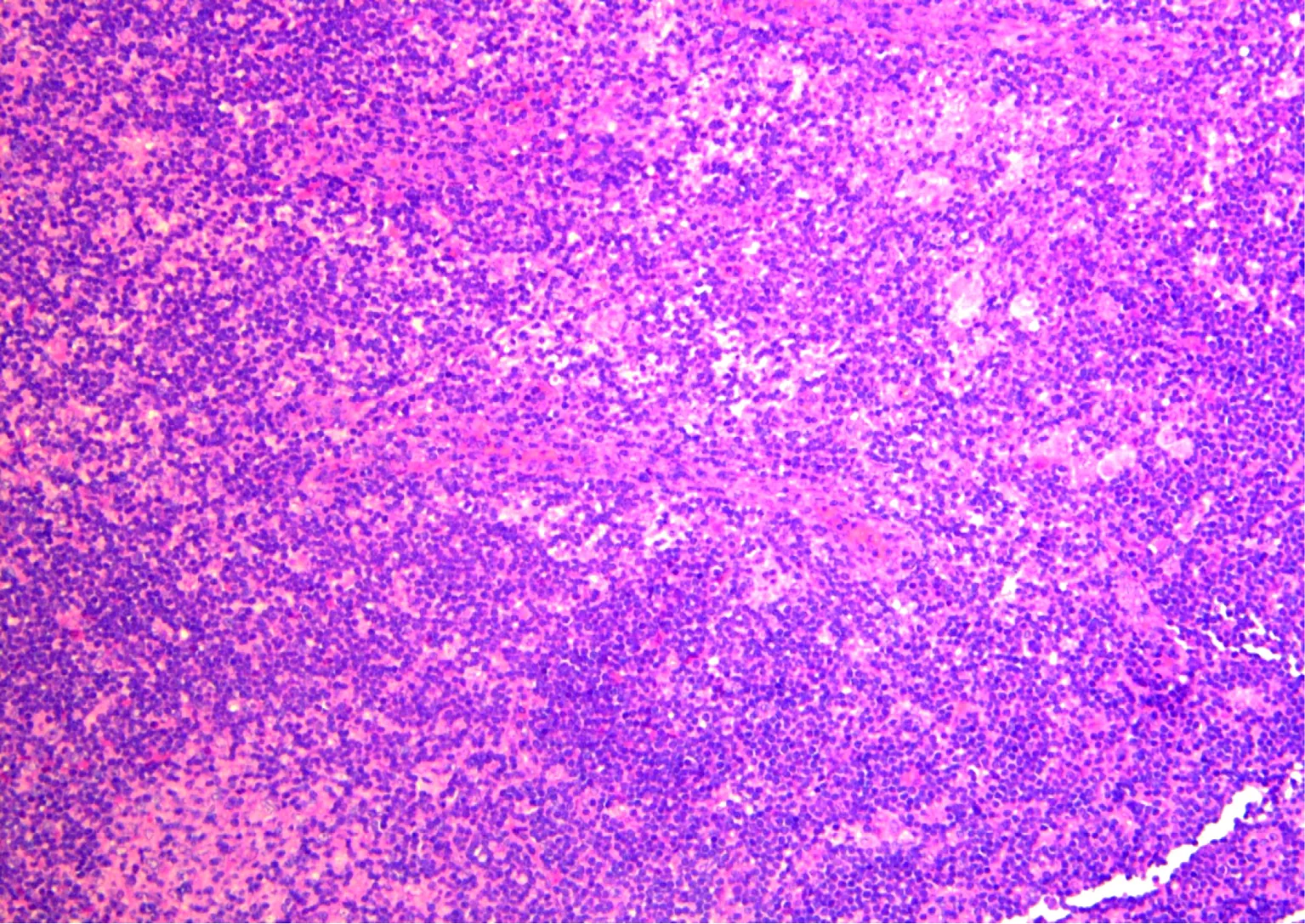
淋巴结皮质内大量上皮样细胞灶状聚集,可见多核巨细胞、上皮样细胞弥漫性分布图6 BCG低剂量注射组淋巴结病理切片(HE ×100)
生理盐水对照组淋巴结切片表现为淋巴结的皮质、髓质结构清晰,淋巴结内淋巴小结可见,髓质内淋巴窦及髓索结构完整,淋巴滤泡未见明显增生,未表现出病变(图7)。
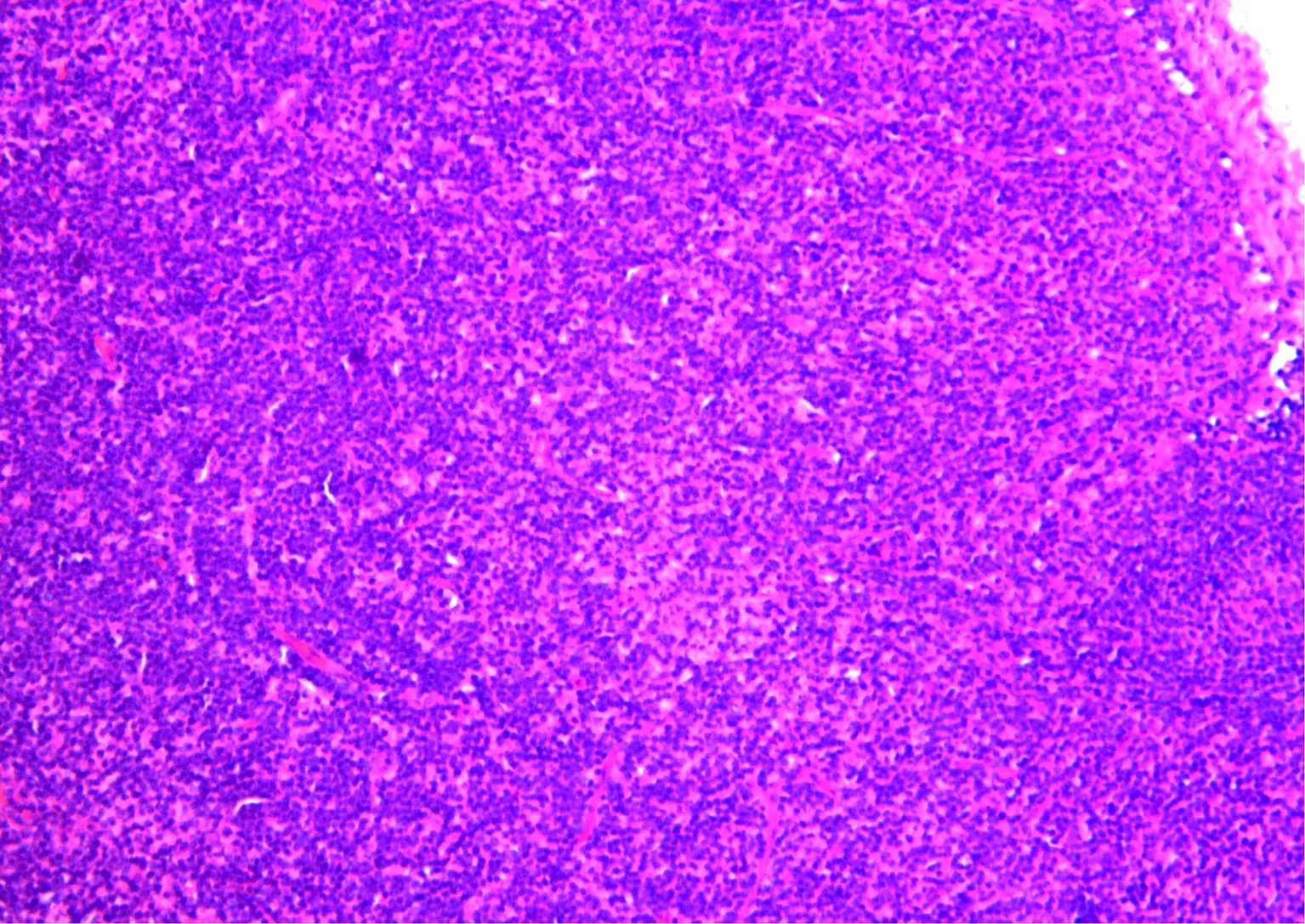
淋巴结的皮质、髓质结构清晰,淋巴结内淋巴小结可见,髓质内淋巴窦及髓索结构完整,淋巴滤泡未见明显增生,未表现出病变图7 生理盐水对照组淋巴结切片(HE ×100)
二、细菌分离培养结果
在L-J培养基上表现为有突起的皱型和扩散型两类菌落,呈浅黄色;在7H11培养基上表现为扩散型扁平浅黄色菌落,细菌形态与卡介菌相似。接种于3种培养基的报阳结果见表1。
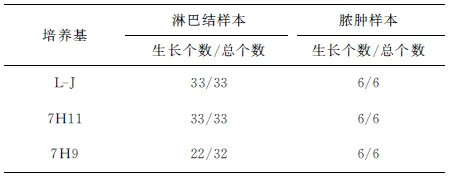
表1 样本在3种培养基上培养的报阳结果
9枚淋巴结样本在L-J培养基和7H11培养基上培养, L-J培养基阳性结果为淋巴结9/9、脓肿3/3,7H11培养基阳性结果为淋巴结9/9、脓肿3/3,见表2。对两种固体培养基形成的菌落数进行统计分析,用Shapiro-Wilk检验两组数据正态性,两组数据均服从正态分布(L-J培养基菌落数P=0.172>0.05;7H11培养基菌落数P=0.089>0.05);对两组数据进行独立样本t检验,t=0.804,P=0.440>0.05, L-J培养基和7H11培养基上培养生长的菌落数没有差异。
将组织悬液接种于L-J培养基、7H11培养基和7H9液体培养基培养。L-J培养基和7H11培养基第4周开始有菌落长出,第5周全部长出菌落;7H9液体培养基第10天开始报阳,25 d后不再报阳。淋巴样本平均报阳时间为13 d,脓肿样本平均报阳时间为12 d。
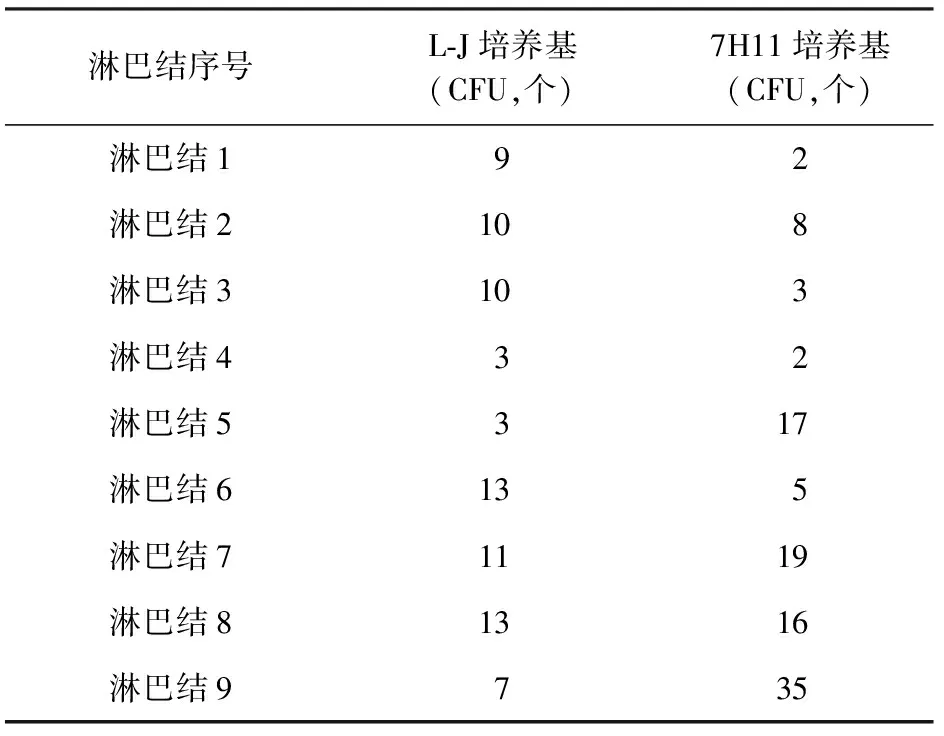
表2 9枚淋巴结样本在固体培养基和液体培养基上的细菌培养结果
注 CFU:菌落形成单位(colony-forming units)
取组织研磨液直接进行涂片,做抗酸染色实验,显微镜下未观察到抗酸阳性分枝杆菌。将固体培养物与液体培养物涂片后进行抗酸染色,显微镜下观察可见聚集成团与分散的抗酸阳性杆菌,细菌形态及特征与分枝杆菌一致。
三、培养菌菌型鉴定结果
将不同标本来源培养的细菌进行卡介菌特异性RD1检测试验,可见:淋巴结培养物与脓肿培养物经 PCR反应后,均扩增出一条约200 bp的核酸片段,大小与皮内注射用卡介苗特异性鉴别用国家参考品及BCG DNA 国家参考品结果一致,说明培养物为卡介菌(图8)。
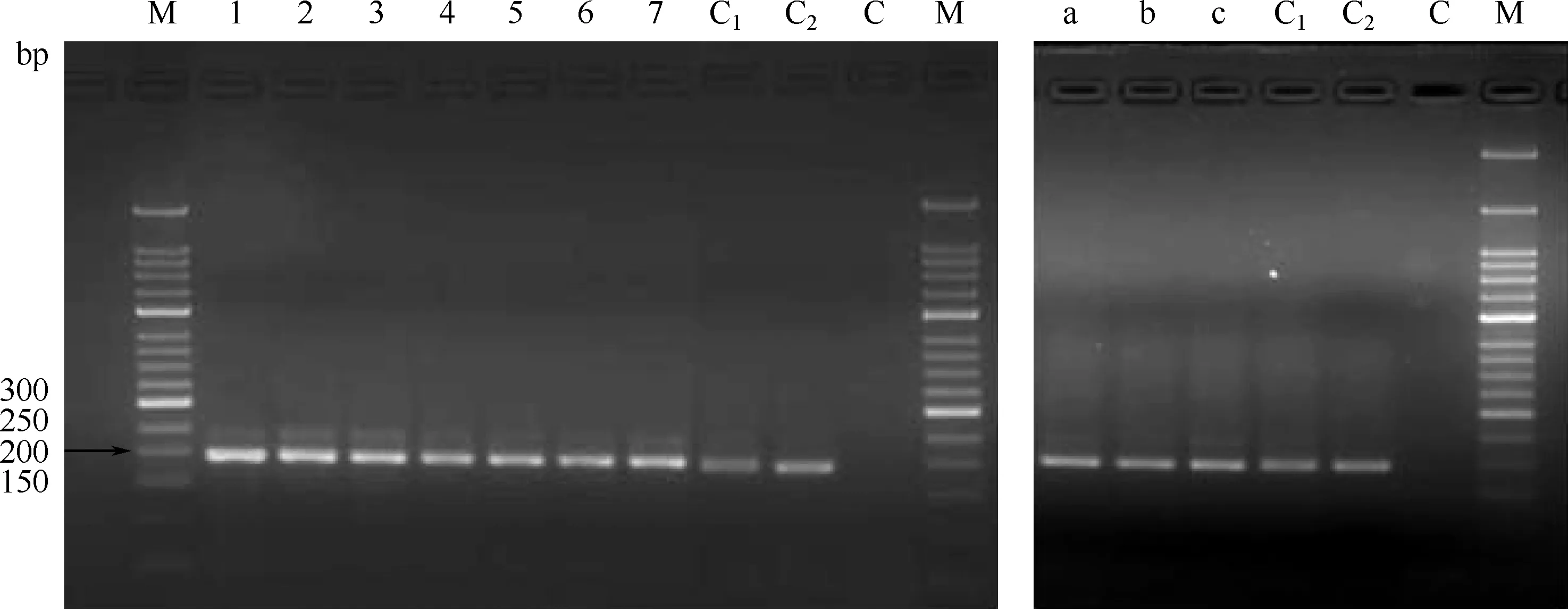
1~7为淋巴结样品;a、b、c为脓肿样本。M:50 bp DNA梯状图谱; C1: 卡介苗对照品; C2:BCG DNA 国家参考品; C: 试剂对照图8 培养物卡介苗菌型鉴定结果
讨 论
BCG接种后不良反应较多,轻者表现为淋巴结炎、局部脓肿;重者形成脓肿破溃、播散性骨髓炎、全身播散性卡介菌病等。目前,临床上对BCG不良反应诊断主要根据BCG的接种史判断,对于病原学鉴定通常以发现抗酸杆菌、培养阳性后以其对对硝基苯甲酸(PNB)与TCH的敏感情况进行菌种鉴定[7],通常鉴定到牛结核分枝杆菌。
BCG 是由牛结核分枝杆菌经过 230 代传种后获得的减毒菌株,具体表现为失去了致病性,保留了免疫原性,究其本质是在传代过程中丢失了毒力编码基因,与结核分枝杆菌的基因组比较,BCG 菌株的基因组可找到 16 个长度 1903~12 733 bp 不等的缺失区域(regions of difference,RD),这些区域被依次命名为RD1~RD16[21],其中 RD1 是一个很特殊的片段,这个片段只存在于有毒分枝杆菌中(包括结核分枝杆菌与牛结核分枝杆菌),但在所有 BCG 亚株共同缺失。RD1 片段全长为 9458 bp,基于 RD1 区所设计的 3 条引物,其中 ET1 和 ET3跨越 RD1 区,位于 RD1 区两侧,而引物 ET2 则位于 RD1 区内。当菌株缺失RD1 区时,两侧引物结合,扩增将得到一条约 200 bp 长度的片段;若菌株存在RD1 区时,两侧引物虽然结合但是由于产物过长不能有效扩增,而 ET3 和 ET2结合扩增生成1条 150 bp 长度的片段。扩增产物为 200 bp 左右为 BCG,为 150 bp 左右为有毒的分枝杆菌复合群,其他分枝杆菌无扩增产物出现。这个基因水平上的特点将卡介菌与牛型分枝杆菌及其他分枝杆菌复合群区分开来。通过检测 RD1 区的存在与否,可以特异性的鉴别 BCG[22-23]。根据BCG基因组的特点,世界卫生组织已经推荐采用分子生物学的方法(如 PCR 方法)来特异性鉴别BCG;同时 2015 版中国药典,对BCG的质量控制也增加了分子生物学特异性鉴别方法,相比于早期采用的抗酸染色鉴别方法,克服了仅从形态上来鉴别BCG无专属性的缺陷,该方法已用卡介菌多糖核酸注射液的鉴别[18-19,24-25]。
临床上 BCG 不良反应病原菌的特异性鉴定,对于病因诊断、医患纠纷的解决,以及后续治疗都有积极的意义,国际上对类似病例的病原菌鉴别多鉴别到BCG 甚至 BCG 亚株[14-15],国内则鉴别不多,或仅鉴定到牛结核分枝杆菌。
本研究建立动物 BCG 接种后不良反应模型,对 BCG 高剂量组 18 只豚鼠解剖均获取肿大淋巴结,且有 6 只出现局部脓肿,BCG 低剂量组 18 只豚鼠解剖有 15 只获取肿大淋巴结,但均未出现局部脓肿。对接种后淋巴结及局部脓肿进行细菌分离培养,固体培养基培养法培养结果全为阳性,且长出的菌落数量无差异,但需要 4~5 周 时间;液体培养法阳性结果为淋巴结 22/33、脓肿 6/6,平均耗时淋巴结培养物13 d、脓肿培养物12 d,最长为25 d。培养物采用中国药典规定的BCG 特异性鉴别方法均鉴定为 BCG,与皮内注射用 BCG 特异性鉴别试验用国家参考品及 BCG DNA 国家参考品的结果一致。通过本研究可发现,BCG高剂量免疫、选取肿大淋巴结作为检查样本和固体培养基培养更有利于模型的建立。
BCG 低剂量组有 3 只豚鼠解剖未获取淋巴结,可能由于人为原因未能找到淋巴结或解剖过程中淋巴结破损。组织研磨液直接进行涂片未有阳性结果,可能原因是标本处理方法不当,直接用组织研磨的标本涂片,标本涂片厚,染色时容易引起标本脱落,或者蛋白太多,镜下不容易看到。
本研究所采用的方法对于临床实践可能不是最简单、最方便、最好的鉴定方法,但希望为 BCG 临床不良反应病原菌分离、鉴别的标准化提供研究基础。
[1] 中华人民共和国卫生部. 预防接种工作规范. 卫政法发[2005]187号.2005-09-20.
[2] 武文娣,刘大卫,李黎,等. 2000—2007年卡介苗疑似预防接种异常反应文献分析. 中国疫苗和免疫,2009,15(6): 491-495.
[3] 李克莉,刘大卫,武文娣. 2009—2010年全国卡介苗疑似预防接种异常反应监测分析. 中国疫苗和免疫, 2012,18(3): 252-260.
[4] 武文娣,李克莉,郑景山. 中国2011年疑似预防接种异常反应监测数据分析. 中国疫苗和免疫, 2013,19(19): 97-109.
[5] 彭晓雯,刘大卫. 卡介苗预防接种安全性综述. 中国疫苗和免疫,2010,16(6):558-563.
[6] 彭艳红,房先杰. 卡介苗异常反应的启示. 中国地方病防治杂志,2014,29(1):41.
[7] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006.
[8] 武文清,李波,倪新兰,等. 112例新生儿接种卡介苗引发淋巴结强反应的临床表现及疗效分析. 中国防痨杂志,2012,34(4):241-244.
[9] 瞿中威,陈丹. 卡介苗相关播散性骨髓炎一例. 中国CT与MRI杂志,2014,12(9):119-120.
[10] 陈才,雷庭,张鑫. 播散性卡介苗感染一例. 中国防痨杂志, 2015,37(4): 413-414.
[11] 张兰,张文同,刘希杰,等. 婴儿卡介苗接种后腋窝淋巴结炎的外科治疗. 中国现代普通外科进展,2014,17(9):732-734.
[12] 阿米娜古丽·塔西铁木尔,胡昕,王晶,等. 传统方法和PCR法在结核分枝杆菌复合群菌种鉴定中的对比研究. 中国防痨杂志,2013,35(2):103-107.
[13] 姜广路,梁倩,付育红,等. 以噻吩二羧酸肼实验结果作为鉴定牛分枝杆菌依据可靠性研究. 中华结核和呼吸杂志,2013,36(5):360-362.
[14] Harada H, Seki M, Shinojima H, et al. Epididymo-orchitis caused by intravesically instillated bacillus Calmette-Guérin: genetically proven using a multiplex polymerase chain reaction method. Int J Urol,2006, 13(2):183-185.
[15] Seki M, Sato A, Honda I, et al. Modified multiplex PCR for identification of Bacillus Calmette-Guérin substrain Tokyo among clinical isolates. Vaccine, 2005, 23(24):3099-3102.
[16] 张媛媛,黄明翔,赵秀芹. Spoligotyping结合多位点PCR用于牛分枝杆菌卡介苗的快速鉴定. 中国人兽共患病学报,2011,27(8):712-714.
[17] 李晓迎,黄延风,潘云. 两种多位点聚合酶链反应技术在结核分枝杆菌复合群鉴定中的价值. 临床儿科杂志,2014,32(7):672-676.
[18] 赵爱华,寇丽杰,乔来艳,等. 卡介菌及其衍生制品鉴别实验用BCG DNA国家参考品的研制. 中国药事,2010, 24 (3):244-247.
[19] 国家药典委员会. 中华人民共和国药典三部(2015 年版). 北京:中国医药科技出版社,2015:496.
[20] 国家药典委员会. 中华人民共和国药典第二增补本(2010 年版).北京:中国医药科技出版社,2013:402.
[21] Behr MA, Wilson MA, Gill WP, et al. Comparative genomics of BCG vaccines by whole-genome DNA microarray. Science,1999, 284(5419): 1520-1523.
[22] Talbot EA, Willams DL, Frothingham R. PCR identification of Mycobacterium bovis BCG. J Clin Microbiol, 1997, 35(3): 566-569.
[23] Bedwell J, Kairo SK, Behr MA, et al. Identification of substrains of BCG vaccine using multiplex PCR. Vaccine,2001, 19(15/16): 2146-2151.
[24] World Health Organization. Recommendations to assure the quality, safety and efficacy of BCG vaccines.Geneva: World Health Organization,2013.
[25] 邱阿明,赵爱华,李建蓉,等. 多重PCR方法特异性鉴定卡介菌多糖核酸的初探. 微生物学免疫学进展,2008,36(2): 13-15.
(本文编辑:范永德)
Isolation and identification of pathogens in lymphadenitis of Guinea pigs caused by BCG vaccination
WANGDing-ding*,FULi-li,KOULi-jie,ZHANGTing,DONGQiao-xiang,ZHAOAi-hua.
*InstituteofEnvironmentalSafetyandHumanHealth,WenzhouMedicalUniversity,Wenzhou325000,China
s:ZHAOAi-hua,Email:tbtestlab@nifdc.org.cn;DONGQiao-xiang,Email:dqxdong@163.com
Objective To establish a model of isolation and identification pathogens of lymphadenitis caused by BCG vaccination of Guinea pigs and provide a method for etiological identification in clinical diagnosis with adverse reactions caused by BCG vaccination. Methods Thirty-nine Guinea pigs were divided into 3 groups according to random number table method: normal saline group (3 Guinea pigs), high dose of BCG vaccine and low dose of BCG vaccine groups (each 18 Guinea pigs). Lymph glands and local abscess were obtained from Guinea pigs 4, 5 and 8 weeks after injected by normal saline and BCG and were homogenized. The homogenates was cultured in L-J culture medium, 7H11 medium plate and 7H9 liquid medium. Meanwhile, the homogenates were detected by acid-fast staining and specific detecting of BCG RD1. After culturing, the 3 kinds of cultured pathogens were also detected by acid-fast staining and specific detecting of BCG RD1. Results The positive results of the cultured homogenates were lymph gland 33/33 and local abscess 6/6 in L-J culture medium, lymph gland 33/33 and local abscess 6/6 in 7H11 medium plate, lymph gland 22/33 and local abscess 6/6 in 7H9 liquid medium. All cultured pathogens showed positive results by acid-fast staining and the bacterial morphs of the detected pathogens were same to BCG. The specific detecting of BCG RD1 of the cultured pathogens was consistent with national references of BCG DNA and BCG controls (196 bp). Conclusion Pathogens can be detected from BCG immunized lymphadenitis samples by pathogenic bacterium using solid culture method. Subtype of bacteria can be identified by specific detecting of RD1 of BCG. High dose of BCG,selection of lymph glands as the tested sample and cultured in solid culture medium were more beneficial to establish the model.
BCG; Vaccination, Lymphadenitis; Gene deletion; Diagnosis,differential
10.3969/j.issn.1000-6621.2016.03.011
“十二五”国家科技重大专项(2012ZX10004701)
325000 温州医科大学环境安全与健康风险评估研究院(王丁丁、董巧香);中国食品药品检定研究院结核病疫苗室(付丽丽、寇丽杰、张婷、赵爱华)
赵爱华,Email: tbtestlab@nifdc.org.cn;董巧香,Email: dqxdong@163.com
2015-08-13)
注:王丁丁和付丽丽对本研究有同等贡献,为并列第一作者
