苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响
2016-05-10占今舜魏明吉苏效双詹康刘明美张春刚赵国琦
占今舜,魏明吉,2,苏效双,詹康,刘明美,3,张春刚,4,赵国琦*
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.临沂大学生命科学学院,山东 临沂 276000;3.江苏联合职业技术学院
淮安生物工程分院,江苏 淮安 223200;4.上海光明荷斯坦牧业有限公司,上海 200443)
苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响
占今舜1,魏明吉1,2,苏效双1,詹康1,刘明美1,3,张春刚1,4,赵国琦1*
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.临沂大学生命科学学院,山东 临沂 276000;3.江苏联合职业技术学院
淮安生物工程分院,江苏 淮安 223200;4.上海光明荷斯坦牧业有限公司,上海 200443)
摘要:本实验旨在研究苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞的影响。将乳腺上皮细胞分成5组,每组培养基中分别含有0,25,50,75和100 μg/mL苜蓿黄酮,同时置于细胞培养箱37℃,5%CO2培养72 h,再在 42℃恒温水浴锅中热应激1 h后返回细胞培养箱培养12 h,检测细胞活性、抗氧化指标和相关基因的表达。结果显示:1)添加25 μg/mL组的细胞活性显著高于0和50 μg/mL组(P<0.05),其他各组之间差异不显著。2)相对于0 μg/mL组,50~100 μg/mL组细胞的GSH-Px活性升高(P<0.01),LDH和MDA含量降低(P<0.01或P<0.05),而CAT活性无显著性差异。3)相对于0 μg/mL组,50和75 μg/mL组Caspase3和Socs3基因表达降低(P<0.01),25 μg/mL组P53、Stat1和Socs1基因表达升高(P<0.01或P<0.05),而Bcl-2和Fas基因表达无显著差异。综上所述,在热应激下,苜蓿黄酮能够提高体外培养奶牛乳腺上皮细胞的活性,改善抗氧化能力和抑制细胞凋亡,其中添加75 μg/mL效果较好。
关键词:黄酮;奶牛;乳腺上皮细胞;热应激
紫花苜蓿(Medicagosativa)由于营养价值高,含有丰富的蛋白质、粗纤维、维生素以及微量元素,被称为“牧草之王”,是我国最重要的栽培牧草之一[1-2]。苜蓿中的黄酮类化合物是一类含有2-苯基色原酮结构的化合物,包括黄酮醇、花色素、异黄酮等物质[3]。苜蓿中黄酮含量较高,据报道,45个紫花苜蓿品种中有70%以上品种的总黄酮含量为0.6%~0.9%[4]。黄酮类化合物具有抗氧化、改善血液循环、抑制炎症等作用,添加在饲料中可促进动物生长和改善繁殖性能等。欧阳克蕙等[5]研究发现,饲粮中添加苜蓿黄酮不会影响生长后期的崇仁麻鸡母雏生产性能,但降低平均日采食量,减少脂肪沉积。朱宇旌等[6]研究发现,苜蓿黄酮对小鼠生长性能的影响与性别和剂量有关,低剂量处理可显著地提高雄性小鼠的生长性能,高剂量能改善小鼠的特异性和非特异性免疫功能。王伟等[7]发现,苜蓿总黄酮能够显著降低下丘脑中GnRH和垂体FSH的表达量,高剂量组FSH的表达量显著降低和LHR表达量显著升高,说明苜蓿总黄酮通过影响下丘脑-垂体-卵巢性腺轴来改善妊娠期间雌鼠的繁殖性能。细胞培养技术是在活体内取出与试验相关组织或细胞,在体外模拟体内生理环境,且建立无菌、适温和一定的营养条件,使细胞生长和生存并维持其结构与功能的一种方法。该方法具有易于提供性状相似的试验对象,耗资少,对于大型经济动物来讲比较经济等特点,被广泛用于医药、农业等领域[8-9]。目前,利用细胞培养技术来研究苜蓿黄酮对热应激下奶牛乳腺上皮细胞的影响鲜见报道。因此,本试验研究热应激下,苜蓿黄酮对奶牛乳腺上皮细胞的影响,目的是从细胞水平研究苜蓿黄酮对奶牛的影响,丰富相关理论的研究,为推广苜蓿黄酮在奶牛生产上的应用提供科学依据。
1材料与方法
1.1材料
苜蓿黄酮购于陕西绿清生物工程有限公司,奶牛乳腺上皮细胞由本试验室通过组织块培养法获得。
1.2试验方法
1.2.1细胞培养试验于2014年10月开始进行,将细胞置于DMEM/F12 (Gibco,美国)培养基在37℃, 5% CO2的培养箱中培养,培养基中含有10%的胎牛血清(Gibco,美国)、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 μg/mL链霉素(Sigma,美国)。
1.2.2噻唑蓝(MTT)法检测细胞活性以密度为3×104个/mL细胞接种到96孔板,分为5组,即基础培养基中分别加0,25,50,75和100 μg/mL苜蓿黄酮,每组5个重复,其中苜蓿黄酮用DMSO(索莱宝,北京)完全溶解,各处理组中的二甲基亚砜(DMSO)含量为2‰。细胞于37℃,5% CO2培养箱中培养72 h后,将其置于42℃恒温水浴锅中热应激1 h后回细胞培养箱培养12 h,然后分别在每孔中加入20 μL 0.5% MTT,放回培养箱中继续培养4 h,然后去除培养液,用磷酸盐缓冲液(PBS)冲洗2遍,每孔加入DMSO 150 μL于摇床混匀10 min,最后在490 nm下测定OD值。
1.2.3抗氧化指标的测定取密度为2.5×105个/mL细胞接种到12孔板,方法同上。然后根据购买于南京建成生物工程研究所试剂盒中的说明书测定一氧化氮(nitric oxide,NO)含量、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量。
1.2.4细胞总RNA的提取和cDNA的合成取密度为5×105个/mL细胞接种到6孔板,方法同上。然后根据购买于天根生化科技有限公司RNA提取试剂盒中的说明书进行组织总RNA的提取,采用One Drop仪器进行总RNA的浓度和纯度的测定。采用Takara反转录试剂盒进行cDNA的合成,cDNA合成试验在冰上进行,10 μL体系,反应条件为37℃ 15 min、85℃ 5 s、4℃保存。所得cDNA保存于-20℃待测。
1.2.5引物设计根据GeneBank中的基因序列,采用Primer 5.0软件设计引物,引物由Invitrogen公司合成(表1)。
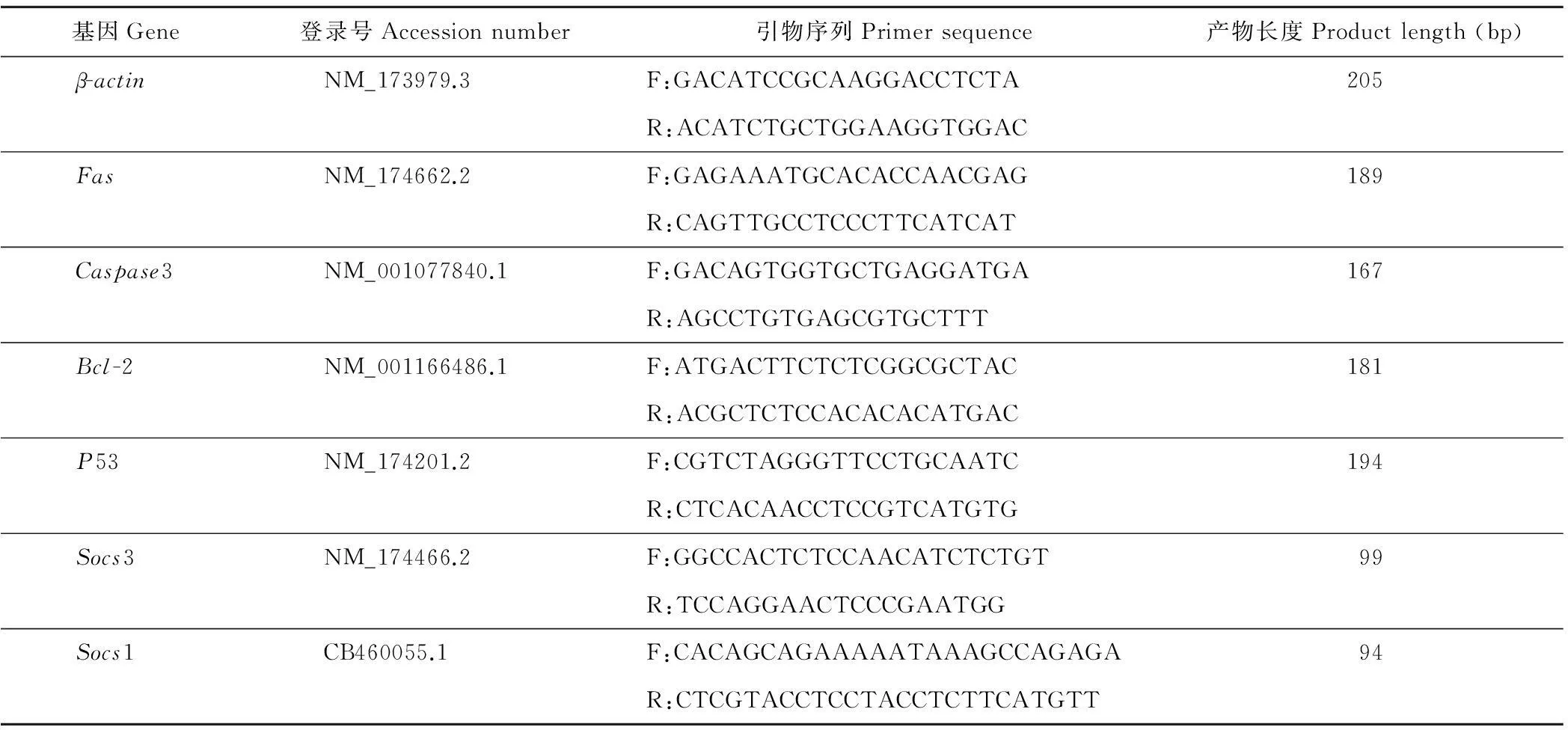
表1 引物设计
1.2.6Real Time-PCR条件根据TaKaRa试剂盒说明书进行冰上配制反应液(表2),后在罗氏Light Cycler®96 PCR仪上进行检测。
1.3数据处理
采用2-ΔΔCt方法进行基因相对表达量计算,用Excel 2007进行试验数据预处理,结果以平均值±标准差表示,采用SPSS 17.0单因素方差分析(ANOVA),LSD法多重比较,P<0.01表示差异极显著,P<0.05表示差异显著。
2结果与分析
2.1苜蓿黄酮对乳腺上皮细胞活性的影响
由表3可知,添加25 μg/mL苜蓿黄酮组的奶牛乳腺上皮细胞活性显著高于0 和50 μg/mL组(P<0.05),其他各组之间差异不显著。说明添加低剂量的苜蓿黄酮具有提高乳腺上皮细胞抗热应激的作用。
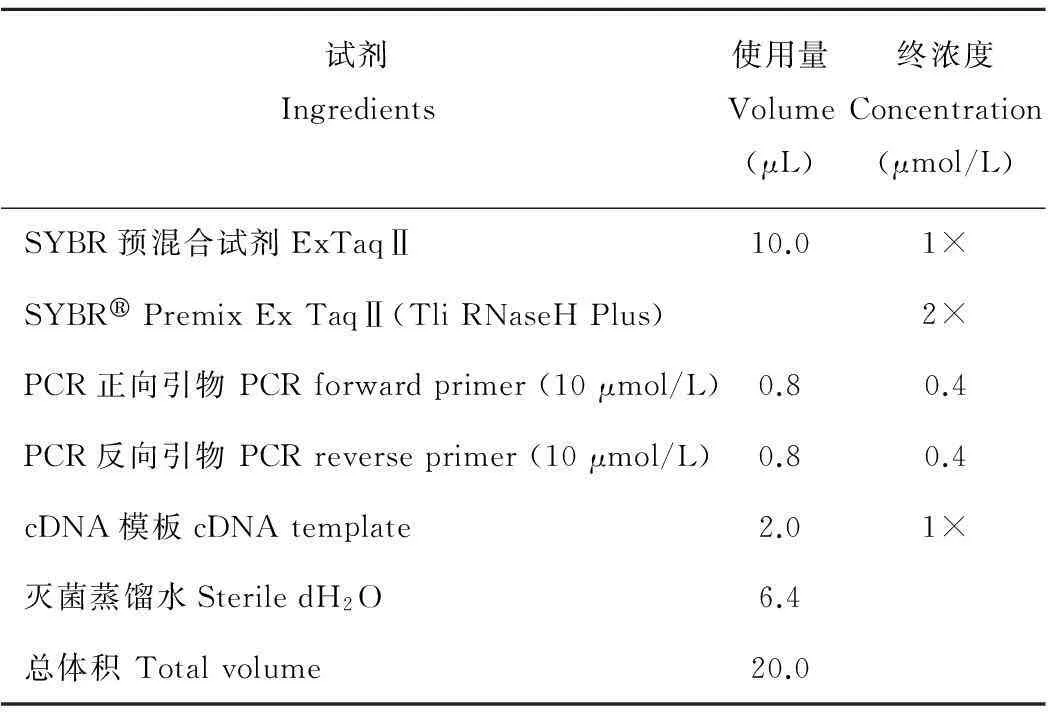
表2 RT-PCR反应液
PCR反应条件为:95℃预变性30 s;PCR反应为95℃、5 s,60℃、20 s,循环40次;融解曲线分析65℃、15 s。Reaction conditions of PCR: initial denaturation in 95℃,30 s;PCR reaction in 95℃ 5 s,60℃ 20 s,40 cycles; melting curve analysis in 65℃,15 s.
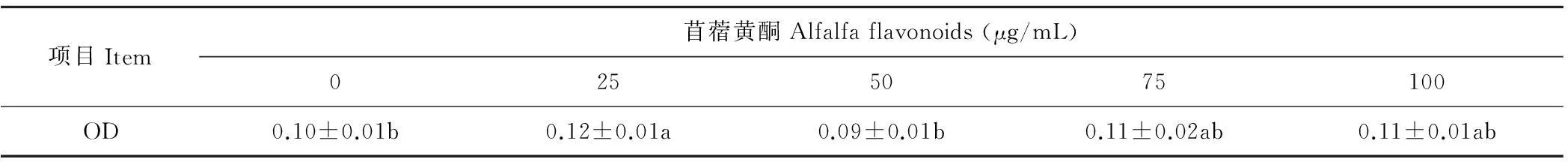
表3 苜蓿黄酮对乳腺上皮细胞活性的影响
注:同行不同小写字母表示差异显著 (P<0.05),不同大写字母表示差异极显著 (P<0.01),下同。
Note: In the same row, values with different lowercases mean significant differences (P<0.05) and different capital letters mean highly significant differences (P<0.01). The same below.
2.2苜蓿黄酮对乳腺上皮细胞抗氧化性指标的影响
由表4可知,相对于0 μg/mL组,25~100 μg/mL组细胞的GSH-Px活性均显著提高(P<0.01),但LDH活性则相反;100 μg/mL组细胞的NO含量降低(P<0.05),50~100 μg/mL组细胞MDA含量降低(P<0.01或P<0.05),50 μg/mL组细胞的SOD活性降低(P<0.01),但各处理组的CAT活性无显著性差异。说明添加苜蓿黄酮具有改善细胞的抗氧化功能。
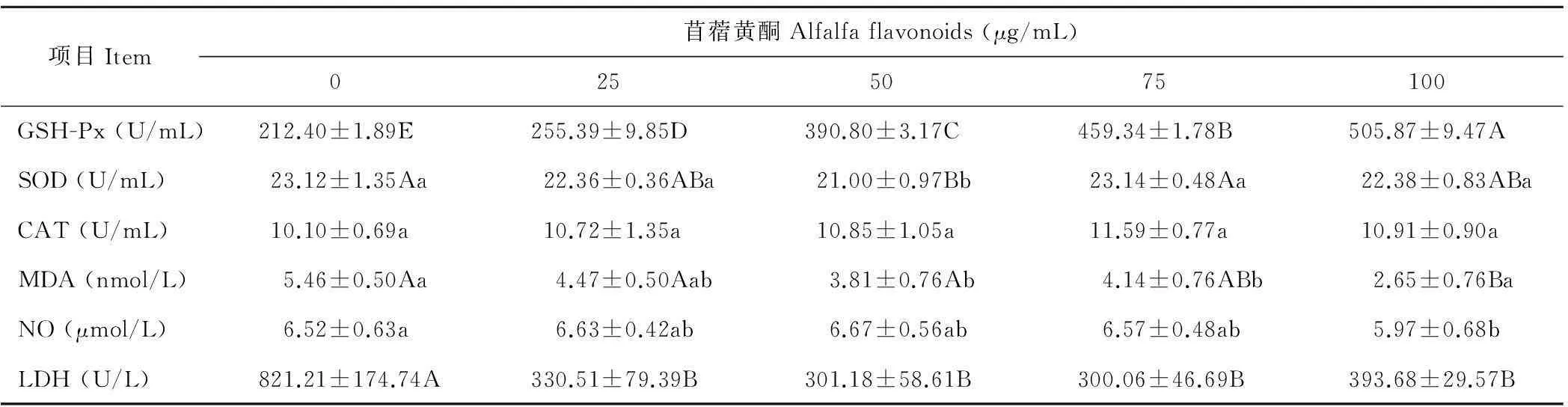
表4 苜蓿黄酮对乳腺上皮细胞抗氧化指标的影响
2.3苜蓿黄酮对乳腺上皮细胞相关基因表达的影响
由表5可知,各处理组Bcl-2和Fas基因表达无显著差异,50和75 μg/mL组Caspase3和Socs3基因表达显著低于0 μg/mL组(P<0.01)。相对于0 μg/mL组,25 μg/mL组P53、Stat1和Socs1基因表达升高(P<0.01或P<0.05)。说明添加适量的苜蓿黄酮能够抑制细胞的凋亡。
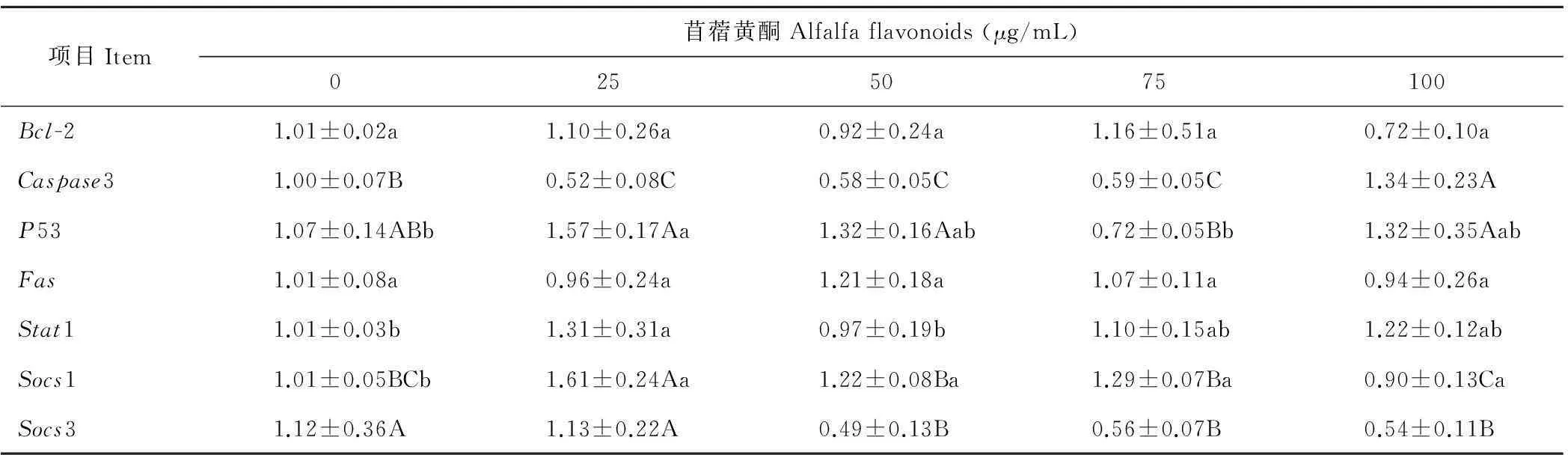
表5 苜蓿黄酮对乳腺上皮细胞相关基因表达的影响
3讨论
周振峰等[10]研究发现,奶牛乳腺上皮细胞在42℃高温处理下生长停滞,细胞凋亡率在 42℃高温培养测定的第3 h达到最大值。宋学立等[11]发现,热应激促使细胞活性氧(ROS)升高是导致心肌细胞损伤的重要机制之一,细胞凋亡是热应激心肌细胞死亡的主要途径。说明热应激能够导致细胞活力下降,诱导细胞凋亡。刘春龙等[12]和林成招等[13]研究发现,适量的大豆异黄酮能够促进奶牛乳腺上皮细胞和大鼠小肠细胞的增殖。陈静[14]研究发现,在一定范围内,槲皮素能够上调奶牛乳腺上皮细胞存活率。说明黄酮类化合物具有提高细胞活性的功能。在本试验中,添加苜蓿黄酮具有改善奶牛乳腺上皮细胞活性的趋势。原因可能是热应激导致细胞产生ROS,而黄酮通过释放的H+与活性氧ROS相结合,直接清除氧自由基[15-16],从而降低氧自由基对细胞的损伤,提高细胞活性。
一般情况下,细胞内自由基的产生和清除处于平衡状态,不会对细胞造成伤害。然而,当细胞内大量自由基积累,会产生大量MDA,促使细胞解体,最终导致细胞死亡[9]。牟瑛等[17]研究二羟异黄酮和三羟异黄酮处理过氧化氢诱导的中国仓鼠卵巢细胞,发现细胞的LDH释放量和MDA的含量降低。刘英华等[18]发现,大豆异黄酮能够升高氧化损伤的血管内皮细胞的SOD和GSH-Px的活性及NO的浓度。余薇等[19]发现,葛花总黄酮预处理能够提高缺氧/复氧心肌细胞的SOD活性,降低培养液中iNOS释放量及胞内MDA含量。陈静[14]研究表明,槲皮素能上调细胞SOD活性,下调MDA含量及胞外LDH活性。在本试验中,苜蓿黄酮提高奶牛乳腺上皮细胞的GSH-Px的活性,降低LDH活性和MDA的含量。说明苜蓿黄酮能够通过提高抗氧化酶的活性来减缓氧化应激,进而保护细胞免受损伤,抑制细胞死亡。
在热应激下,细胞的ROS活性升高,其在细胞内的积累会导致Bax表达、Caspase活化等现象[20]。Caspases家族成员大多数是凋亡的启动子或效应子,在细胞凋亡过程中发挥重要作用。其中 Caspase-3 被认为是凋亡的关键蛋白酶,一旦被激活,凋亡就不可避免[21]。在本试验中,添加25~75 μg/mL苜蓿黄酮组的Caspase-3 基因表达均显著低于未添加组,说明在热应激下,苜蓿黄酮可能通过清除细胞内的ROS来抑制Caspase蛋白的活化,进而抑制细胞的凋亡。Bcl-2可能是通过影响内质网内 Ca2+的释放、抑制氧自由基的产生以及和Bax等结合形成异构二聚体来抑制细胞凋亡[22]。张锦等[23]研究发现,黄酮类化合物通过上调Bcl-2蛋白的表达和抑制Bax蛋白的表达来抑制小鼠心肌细胞的凋亡。在本试验中,苜蓿黄酮对乳腺上皮细胞的Bcl-2基因表达没有显著影响。与其不同可能是物种不同以及黄酮的种类不同造成的。P53能够激活细胞凋亡受体Fas,而Fas与FasL 相结合产生三聚体Fas复合体,就能诱导细胞凋亡[24-25]。在本试验中,75 μg/mL组细胞的P53基因表达降低,说明苜蓿黄酮可能通过抑制P53的表达来抑制细胞凋亡。然而在本试验中Fas基因表达未降低,可能是因为DNA损伤而诱导的Fas表达具有组织特异性,并不需要P53参与[26]。在本试验中,Fas基因表达无显著性变化,说明苜蓿黄酮可能不通过调节Fas的表达来抑制细胞凋亡。信号传递与转录激活因子1(Stat1)通过激活P53、Caspases和TNF-α凋亡蛋白,抑制抗凋亡Bcl-2和Bcl-x基因的表达来促进细胞凋亡[27]。从本试验结果来看,苜蓿黄酮对细胞Stat1基因表达影响不大。热应激能够促进细胞因子IL-6的分泌,IL-6刺激细胞产生活化的Stat3,进而诱导Socs1的生成。Socs1能够干扰细胞中IL-6信号转导子gp130和Stat3的酪氨酸激酶磷酸化,从而抑制凋亡[28]。Socs3的过表达,会抑制Stat3信号路与NF-κB信号在细胞核内存在信号交联,促进细胞凋亡[29]。从本试验结果来看,在热应激下,苜蓿黄酮可能通过促进Socs1的表达和抑制Socs3的表达来调节Stat3的表达,进而抑制细胞凋亡。
4结论
在热应激下,添加低剂量的苜蓿黄酮能够提高体外培养奶牛乳腺上皮细胞的活性;苜蓿黄酮能够提高细胞的GSH-Px的活性,降低LDH活性和MDA的含量,从而改善细胞的抗氧化能力;苜蓿黄酮可能通过抑制Caspases3的表达以及通过促进Socs1的表达和抑制Socs3的表达来调节Stat3的表达,进而抑制细胞凋亡。从本试验结果来看,添加75 μg/mL 组的效果较好。
References:
[1]Zhan J S, Zhan K, Liu M M,etal. Effects of alfalfa pellet feed on slaughter performance, organ weights and blood biochemical indices of greese. Acta Prataculturae Sinica, 2015, 24(8): 180-187.
[2]Zhan J S, Ou R D, Zhang T,etal. Progress on application of alfalfa meal in livestock and poultry production. Hunan Feed, 2013, 3: 27-30.
[3]Zhan J S, Liu M M, Zhao G Q. Effect of flavonoids and application in ruminant. China Feed, 2014, 23: 29-31.
[4]Gao W W. Study on the Bioactivity of Alfalfa and the Influence Factors to Its Flavonoids and Saponins[D]. Beijing: Chinese Peking Union Medical College, 2004.
[5]Ou Y K H, Xiong X W, Wang W J,etal. Effects of alfalfa flavones on growth performance and carcass quality of female Chongren chickens. Acta Prataculturae Sinica, 2013, 22(4): 340-345.
[6]Zhu Y J, Zhang Y, Ning Z L,etal. Effect of isoflavone extracted from alfalfa on growth performance and immune function in mice. Acta Nutrimenta Sinica, 2008, 30(6): 615-618.
[7]Wang W, Tian M M, Liang X P,etal. Effect of alfalfa flavonoids on reproductive performance of female rats in pregnancy and on gene expression in the hypothalamus-pituitary-ovarian gonadal axis. Acta Prataculturae Sinica, 2013, 22(6): 249-256.
[8]Zhan J S, Xing Y T, Zhang B. Progress on application of cell culture. Feed Review, 2013, 1: 8-11.
[9]Zhan J S, Wu L Z, Li L L,etal. Effect of metallothionein on lymphocyte apoptosis of the dairy cow culturedinvitrounder heat stress. Acta Prataculturae Sinica, 2014, 23(3): 215-223.
[10]Zhou Z F, Cui R L, Wang J Q,etal. Cell growth, apoptosis and the mRNA transcription of heat shock protein: effects of heat stress on bovine mammary epithelial cells. Acta Veterinaria er Zootechnica Sinica, 2010, 41(5): 600-607.
[11]Song X L, Qian L J, Li F Z. Injury of heat stress to rat cardiomyocytes. Chinese Journal of Applied Physiology, 2000, 16(3): 227-230.
[12]Liu C L, Li Z Q, Zhang F,etal. Effect of daidzein and genistein on proliferation and antioxid-ation of mammary epithelial cell of dairy cowinvitro. Acta Veterinaria er Zootechnica Sinica, 2008, 39(11): 1517-1522.
[13]Lin C Z, Ma H T, Zou S X,etal. Effects of soybean isoflavone on the growth of the rat epithelial cell and absorption of glucose and amino acids of small intestine. Journal of Nanjing Agricultural University, 2005, 28(1): 71-75.
[14]Chen J. Study on Biological Effects of Quercetin on Boviene Mammary Epithelial Cells[D]. Nanjing: Nanjing Agricultural University, 2012.
[15]Audrius M, Ona R, Ovidijus V,etal. Flavonoids of willow herb (Chamerionangustifolium(L.) Holub) and their radical scavenging activity during vegetation. Advances in Medical Sciences, 2014, 59: 136-141.
[16]Kristien J A L, Bregje Van D E W, Nathalie V,etal. The flavonoid 7-mono-O-(b-hydroxyethyl)-rutoside is able to protect endothelial cells by a direct antioxidant effect. Toxicology in Vitro, 2014, 28: 538-543.
[17]Mou Y, Ji A L, Cao R,etal. Comparison of antioxidant activities to CHO cell between daidzein and genistein. Chinese Journal of Aesthetic Medicine, 2006, 11: 1230-1232.
[18]Liu Y H, Huang G W, Chang H,etal. Study on antioxidant effects of soybean isoflavone on the cultured vein endothelial cells from oxidative injuryinvitro. Journal of Tianjin Medcial University, 2003, 9(1): 10-12, 15.
[19]Yu W, Zha W L, Wu J L,etal. Study on antioxidant effects of total flavonoids inPueraarialobataon the myocardial cell under anoxia/reoxygenation. Shizhen Medicine and Materia Medical Research, 2013, 24(3): 587-588.
[20]Zhan J S. Effect of Metallothionein on Lymphocyte Apoptosis of the Dairy Cow Under Heat Stress[D]. Changsha: Hunan Agricutural University, 2013.
[21]Zhao R J, Li Y Q, Wang H,etal. Relationship of caspase family and apoptosis. Chinese Journal of Animal Science, 2010, 46(17): 73-78.
[22]Wang T, Liu C Z, Liu Y Z,etal. Progress on mechanism of apoptosis regulated by bcl-2/bax. Chinese Journal of Gerontology, 2008, 28(16): 1658-1660.
[23]Zhang J, Zhao C C, Han W N,etal. Effect of flavonoids on myocardial apoptosis. Chinese Pharmacological Bulletin, 2008, 24(5): 635-639.
[24]Zhou J, Luo R B, Tang C F,etal. Effect of Bcl-2 protein family and p53 gene on regulating and controlling cell apoptosis. Journal of Clinical Rehabilitative Tissue Engineering Research, 2007, 11(10): 1950-1952.
[25]Zhang L M, Dong Q. The apoptosis of Fas/FasL and autoimmune diseases. Acta Academiae Medicinae Wannan, 2003, 22(1): 65-67.
[26]Pedreanez A, Rincon J, Romero M. Melatonin decreases apoptosis and expression of apoptosis-associated proteins in acute puromycin aminonucleoside nephrosis. Nephrol Dial Transplant, 2004, 19(5): 1098-1105.
[27]Stephanou A, Brar B K, Scarabelli T M,etal. Ischemia-induced STAT-1 expression and activation play a critical role in cardiomyocyte apoptosis. The Journal of Biological Chemistry, 2000, 275(14): 10002-10008.
[28]Yang H P, Dai M, Zhang D H. Progress of study on suppressor of cytokine signaling-1—review. Journal of Experimental Hematology, 2007, 15(2): 437-440.
[29]Gu Q. The Significance of IL-6-JAK2-STAT3-SOCS3 Signaling in Myocardial Adaptation to Chronic Hypoxia[D]. Chong qing: Third Military Medical University, 2011.
参考文献:
[1]占今舜, 詹康, 刘明美, 等. 苜蓿草颗粒饲料对鹅屠宰性能、器官和血液生化指标的影响.草业学报, 2015, 24(8): 181-187.
[2]占今舜, 欧荣娣, 张婷, 等. 苜蓿草粉在畜禽生产上的应用研究进展. 湖南饲料, 2013, 3: 29-31.
[3]占今舜, 刘明美, 赵国琦. 黄酮的作用及其在反刍动物上的应用. 中国饲料, 2014, 23: 13-15.
[4]高微微. 苜蓿生物活性及影响其黄酮和皂苷成分因素的研究[D]. 北京: 中国协和医科大学, 2004.
[5]欧阳克蕙, 熊小文, 王文君, 等. 苜蓿黄酮对崇仁麻鸡生长性能及肌肉化学成分的影响. 草业学报, 2013, 22(4): 340-345.
[6]朱宇旌, 张勇, 宁自利, 等. 苜蓿异黄酮提取物对小鼠生长和免疫功能的影响. 营养学报, 2008, 30(6): 615-618.
[7]王伟, 田苗苗, 梁新平, 等. 苜蓿总黄酮对妊娠雌鼠繁殖性能及相关基因表达量的影响. 草业学报, 2013, 22(6): 249-256.
[8]占今舜, 邢月腾, 张彬. 细胞培养技术的应用研究进展. 饲料博览, 2013, 1: 8-11.
[9]占今舜, 吴力专, 李丽立, 等. 金属硫蛋白对热应激下体外培养奶牛淋巴细胞的影响. 草业学报, 2014, 23(3): 215-223.
[10]周振峰, 崔瑞莲, 王加启, 等. 热应激对体外培养奶牛乳腺上皮细胞生长、凋亡及其热休克蛋白mRNA 转录的影响. 畜牧兽医学报, 2010, 41(5): 600-607.
[11]宋学立, 钱令嘉, 李凤芝. 热应激对乳鼠心肌细胞损伤作用的研究. 中国应用生理学杂志, 2000, 16(3): 227-230.
[12]刘春龙, 李忠秋, 张帆, 等. 大豆黄酮和染料木素对体外培养奶牛乳腺上皮细胞增殖及抗氧化水平的影响. 畜牧兽医学报, 2008, 39(11): 1517-1522.
[13]林成招, 马海田, 邹思湘, 等. 大豆异黄酮对大鼠小肠上皮细胞生长及葡萄糖和氨基酸吸收的影响. 南京农业大学学报, 2005, 28(1): 71-75.
[14]陈静. 槲皮素对奶牛乳腺上皮细胞的生物学效应研究[D]. 南京: 南京农业大学, 2012.
[17]牟瑛, 季爱玲, 曹瑞, 等. 二羟异黄酮和三羟异黄酮对CHO细胞抗氧化活性的比较研究. 中国美容医学, 2006, 11: 1230-1232.
[18]刘英华, 黄国伟, 常红, 等. 大豆异黄酮对氧化损伤血管内皮细胞抗氧化作用的研究. 天津医科大学学报, 2003, 9(1): 10-12, 15.
[19]余薇, 查文良, 吴基良, 等. 葛花总黄酮对缺氧/复氧心肌细胞的抗氧化作用研究. 时珍国医国药, 2013, 24(3): 587-588.
[20]占今舜. 外源金属硫蛋白对热应激下奶牛淋巴细胞凋亡的影响[D]. 长沙: 湖南农业大学, 2013.
[21]赵瑞杰, 李引乾, 王会, 等. Caspase 家族与细胞凋亡的关系. 中国畜牧杂志, 2010, 46(17): 73-78.
[22]王彤, 刘存志, 刘玉珍, 等. bcl-2/bax基因调控机体细胞凋亡的机制研究进展. 中国老年学杂志, 2008, 28(16): 1658-1660.
[23]张锦, 赵翠翠, 韩维娜, 等. 黄酮类化合物对心肌细胞凋亡的作用. 中国药理学通报, 2008, 24(5): 635-639.
[24]周桔, 罗荣保, 汤长发, 等. Bcl-2 蛋白家族和p53基因在细胞凋亡中的调控效应. 中国组织工程研究与临床康复, 2007, 11(10): 1950-1952.
[25]张雷明, 董群. 凋亡的Fas/FasL与自身免疫病. 皖南医学院学报, 2003, 22(1): 65-67.
[28]杨海平, 戴敏, 张东华. 细胞因子信号传导抑制蛋白-1(SOCS-1) 研究进展. 中国实验血液学杂志, 2007, 15(2): 437-440.
[29]顾强. SOCS3调控JAK2/STAT3信号通路在心肌慢性缺氧适应中意义的研究[D]. 重庆: 第三军医大学, 2011.
Effect of alfalfa flavonoids on bovine mammary epithelial cell culturesinvitrounder heat stress
ZHAN Jin-Shun1, WEI Ming-Ji1,2, SU Xiao-Shuang1, ZHAN Kang1, LIU Ming-Mei1,3, ZHANG Chun-Gang1,4, ZHAO Guo-Qi1*
1.CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China; 2.CollegeofAnimalScience,LinyiUniversity,Linyi276000,China; 3.JiangsuJointInstituteofTechnologyofProfessionofHuai’anBio-engineeringBranch,Huai’an223200,China; 4.ShanghaiBrightHolstanCo.,Ltd,Shanghai200443,China
Abstract:The aim of this study was to evaluate the effect of alfalfa flavonoids on in vitro bovine mammary epithelial cells under heat stress. Bovine mammary epithelial cells were cultured on media with different concentrations of alfalfa flavonoids (0, 25, 50, 75, and 100 μg/mL) at 37℃ with 5% CO2 for 72 h. Then, the cultured cells were subjected to a heat-shock treatment (42℃ for 1 h) before being returned to 37℃ with 5% CO2 for 12 h. The cell activity, antioxidant index, and gene transcript levels were evaluated. The results showed that the cell activity was significantly higher in the 25 μg/mL treatment group than in the 0 and 50 μg/mL treatment groups (P<0.05), but cell activity did not differ significantly among the other groups. Compared with the control group (0 μg/mL) the 50, 75, and 100 μg/mL treatment groups showed significantly higher glutathione peroxidase activity (P<0.01) and significantly lower lactate dehydrogenase activity and malondialdehyde contents (P<0.01 and P<0.05, respectively). The catalase activity did not differ significantly among the five groups. Compared with the control group (0 μg/mL), the 50 and 75 μg/mL treatment groups showed reduced transcript levels of Caspase3 and Socs3, and the 25 μg/mL group showed significantly increased transcript levels of P53, Stat1, and Socs1 (P<0.01 or P<0.05). The transcript levels of Bcl-2 and Fas did not differ significantly among the groups. Together, these results show that alfalfa flavonoids can increase cell activity and antioxidant capacity and inhibit cell apoptosis, and that the optimal concentration of alfalfa flavonoids is 75 μg/mL.
Key words:flavonoids; dairy cow; mammary epithelial cell; heat stress
*通信作者
Corresponding author. E-mail:gqzhao@yzu.edu.cn
作者简介:占今舜(1985-),男,江西玉山人,在读博士。E-mail:zhanjinshun1985@163.com
基金项目:江苏省高校优势学科建设工程项目(PAPD),长三角地区生鲜乳质量安全追溯体系关键技术研究应用项目(14395810100)和江苏省高校研究生科研创新计划项目(KYZZ_0367)资助。
*收稿日期:2015-06-25;改回日期:2015-09-30
DOI:10.11686/cyxb2015317
http://cyxb.lzu.edu.cn
占今舜, 魏明吉, 苏效双, 詹康, 刘明美, 张春刚, 赵国琦. 苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响.草业学报, 2016, 25(4): 159-165.
ZHAN Jin-Shun, WEI Ming-Ji, SU Xiao-Shuang, ZHAN Kang, LIU Ming-Mei, ZHANG Chun-Gang, ZHAO Guo-Qi. Effect of alfalfa flavonoids on bovine mammary epithelial cell culturesinvitrounder heat stress.Acta Prataculturae Sinica, 2016, 25(4): 159-165.
