GeXP多重分析技术对四氢叶酸还原酶基因多态性与先天性心脏病相关性的研究
2016-05-10冯志山赵梦川王乐李贵霞陶曙光温琳琳王琨马学军
冯志山 赵梦川 王乐 李贵霞 陶曙光 温琳琳 王琨 马学军
·论著·
GeXP多重分析技术对四氢叶酸还原酶基因多态性与先天性心脏病相关性的研究
冯志山 赵梦川 王乐 李贵霞 陶曙光 温琳琳 王琨 马学军
目的 利用GeXP多重分析技术,探讨四氢叶酸还原酶基因(MTHFR)多态性与先天性心脏病相关性。方法 收集2013年2月至2014年12月河北省儿童医院心脏外科手术的261例先心病患儿及49例健康对照儿童外周血,提取全血DNA,使用GeXP多重测序平台的多重分析技术对其MTHFR基因上的两个易感位点rs1801131和rs1801133进行基因分型,采用SPSS 16.0软件的χ2检验,分析先心病与MTHFR基因多态性的相关性。结果 GeXP多重测序平台可同时测量2个SNP的四种基因型,先心病组与对照组MTHFR677C/T等位基因和基因型频率差异无统计学意义(χ2=0.853,P=0.356;χ2=0.898,P=0.343)。结论 GeXP多重分析平台是筛查先心病易感基因特异性良好、操作简便的多重分析技术,本研究入选的先心病患儿与健康对照MTHFR等位基因或其基因型分布无显著性差异,为后期大样本量探寻先心病发病易感基因起到启示作用和奠定了方法学基础。
先天性心脏病;亚甲基四氢叶酸还原酶;儿童
先天性心脏病(先心病)是一种严重威胁儿童健康的出生缺陷[1,2],发病率6%~9%,每年将有10多万先心病患儿出生,也是造成孕期流产、死胎的主要原因,给家庭和社会带来沉重负担[3]。先心病病因尚未完全阐明,但多数学者认为,少数是单基因突变和染色体畸变引起,大多数是由遗传和环境因素相互作用引起的多基因遗传病[4]。针对先心病易感基因已开展大量研究,仍有约3/4的患者致病基因不明[5],因此,寻找先心病相关基因、易感基因十分必要。本研究使用前期建立的一种简便快捷、特异性强、可同时检测多个单碱基突变和单核苷酸多态(single nucleotide polymorphisms,SNP)位点的GeXP多重检测方法,对261例先心病患儿和49例健康儿童亚甲基四氢叶酸还原酶(MTHFR)基因上的两个易感位点rs1801131和rs1801133进行基因分型,分析先心病与MTHFR基因多态性的相关性,筛选先心病发病相关基因。
1 资料与方法
1.1 一般资料 选择2013年2月至2014年12月在河北省儿童医院心脏外科确诊的261例先心病患儿(先心病组),所有入选患儿均经术前超声心动图和术中确认先心病类型及其严重程度;其中单纯型先心病186例,复杂型先心病70例,均排除因染色体异常而导致的综合征或其他先天疾病的患儿;其中男121例,女140例;年龄中位数1.3岁(四分位数0.6~3.1岁)。选择同期河北省儿童医院儿童保健科健康体检的儿童49例(对照组),男31例,女18例;年龄中位数1.9岁(四分位数1.0~3.4岁);经心外科医生及超声心动图排除先心病,且根据体检结果及病史确认无其他先天性疾病和遗传因素;2组年龄差异无统计学意义(Z=-0.121,P=0.904)。入选先心病患儿术前及健康儿童均采集枸橼酸钠抗凝外周静脉全血1 ml -80℃保存,用于DNA提取。所有入组对象为无亲缘关系的中国北方人群散发病例。本研究经医院伦理委员会同意,并由儿童父母签署知情同意书。Hardy-Weinberg遗传平衡检验表明,rs1801131和rs1801133在对照组中检验结果分别为(χ2=2.749,P>0.05;χ2=2.208,P>0.05),说明样本具有较好的群体代表性。见表1。
1.2 方法
1.2.1 试剂与仪器:核酸自动提取试剂盒(台湾圆点奈米技术有限公司),胶回收试剂盒和质粒小体试剂盒(美国Omega Bio-Tek公司),pMD18-T 载体克隆试剂盒、10×上样液、DL 1 000 DNA Marker(大连宝生物公司),dNTP、MgCl2、PCR buffer、Taq DNA 聚合酶(美国Sigma公司)。磁珠式核酸提取仪Smart LabAssist-32(台湾圆点奈米技术有限公司),K5600超微量分光光度计(北京凯奥科技发展有限公司),电泳仪(北京市六一仪器厂),Veriti 96孔PCR仪(美国ABI公司),GenomeLab GeXP遗传分析系统(美国贝克曼库尔特有限公司)。
1.2.2 SNPs的选择:根据本课题组前期研究和文献已报道的与先心病相关的MTHFR基因,在其上选取两个阳性位点,其最小等位基因频率(minor allele frequency,MAF)大于5%,做哈迪温伯格平衡检验。
1.2.3 引物设计:通过NCBI数据库获得两突变位点前后各500 bp的基因序列,以此为模板,使用Primer Premier 6.0软件进行引物设计,使扩增后的产物长度不同。在全部正向引物和反向引物的5’端分别加入一段非同源性序列作为通用引物(universal tag),构成特异性嵌合引物,嵌合引物扩增出的预期片段长度不同,可被毛细管电泳区分。引物由上海英潍捷基公司合成。见表2。
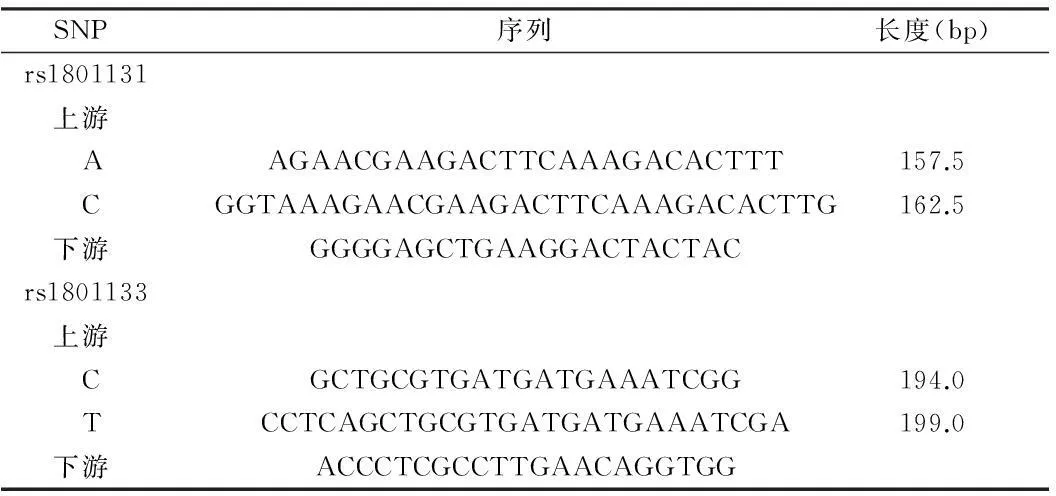
表2 GeXP多重测序平台所用引物信息
1.2.4 基因测序:上样板的检测孔中分别加入38.5 μl 上样溶液、0.5 μl DNA分子长度标准品和 1 μl PCR产物,每孔加1滴矿物油;同时分离板中与样品板相对应位置每孔加入220 μl分离溶液,使用无DNA水和携带相应DNA的质粒分别作阴性对照和阳性对照,按上述方法预处理后采用GeXP分析平台多重分析技术完成基因测序。具体细节参见本课题组已发表文章的材料与方法部分[6]。
1.3 统计学分析 应用SPSS 16.0统计软件,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基因位点多态性 rs1801131位点对照组A和C等位基因分别占85.7%和14.3%;先心病组A和C等位基因分别占85.4%和14.6%,2组差异无统计学意义(χ2=0.006,P=0.937)。rs1801133位点对照组C和T等位基因分别占34.7%和65.3%;先心病组C和T等位基因分别占30.0%和70.0%,2组差异无统计学意义(χ2=0.853,P=0.356)。见表3。

表3 2组MTHFR基因两等位基因位点多态性比较
2.2 基因型多态性
2.2.1 多态性隐形模型中:rs1801131位点对照组AA和AC+CC基因型分别占71.4%和28.6%;先心病组AA和AC+CC基因型分别占75.5%和24.5%,2组差异无统计学意义(χ2=0.360,P=0.549)。rs1801133位点对照组CC和CT+TT基因型分别占12.2%和87.8%;先心病组CC和CT+TT基因型分别占8.2%和91.8%,2组差异无统计学意义(χ2=0.898,P=0.343)。见表4。

表4 2组MTHFR基因隐形模型多态性的比较
2.2.2 多态性显形模型:rs1801131位点在对照组和先心病组都未见CC型纯合子,所以对比的χ2值空缺。rs1801133位点对照组TT和CT+CC基因型分别占42.9%和57.1%;先心病组TT和CT+CC基因型分别占48.6%和51.4%,2组差异无统计学意义(χ2=0.551,P=0.458)。见表5。

表5 2组MTHFR基因显形模型多态性比较
3 讨论
单核苷酸多态SNP是继限制性片段长度多态性和短串联重复序列这两种遗传标记之后的第三代DNA分子标记。近年来已被广泛应用于胚胎心脏发育相关基因的发现及鉴定中[7,8]。MTHFR是一种重要的叶酸代谢酶,MTHFR缺陷不仅可以引起心血管系统的多种疾病,而且会导致体内致畸性物质同型半胱氨酸(homocysteine,Hcy)蓄积。MTHFR基因具有多态性,最常见的为677位点C-T改变,使酶的活力降低50%左右,可导致DNA甲基化水平降低以及体内Hcy水平增高[9]。MTHFR上两个SNP位点与先心病发生的相关性多有报道,但结果差异性很大,阳性、阴性结果皆有报道[10,11]。目前,现有的单个碱基突变和SNP的分析方法存在通量低、工作量大、周期长,且大多操作复杂,费用昂贵,不适合大样本多位点的分析研究。
本研究基于前期建立的GeXP多重分析平台,原理是在同一体系中扩增多个靶基因位点,因扩增产物的长度不同,可被毛细管电泳分开,达到基因分型的目的。该平台利用96孔板、双通道的设置,可同时检测192个样品;四色荧光染色、毛细管电泳分离,使分辨率达到1 bp。本研究设计在同一体系内同时检测2个SNP位点的4个基因型,选取MTHFR基因上2个易感位点rs1801131(A1298C)和rs1801133(C677T)。Zidan等[12]在2013年报道的病例对照研究表明,两位点的突变等位基因携带型其发生先心病的几率是对照组的2倍,且A1298C一般作为辅助,联合C677T突变对先心病的发生起推动作用,单纯A1298C突变与先心病的相关性常为阴性[4]。
本研究中,研究对象是中国北方散发儿童,共检测了261例先心病患儿和49例健康对照儿童的血标本,2组比较其等位基因位点及其基因型多态性差异无统计学意义。与本研究相似,蒋幼芳等[13]研究报道母亲MTHFR 677C/T多态性与子代先心病发生未见关联。有资料显示在我国不同地区不同民族MTHFR基因存在明显差异[14],且高加索人、墨西哥等人群先心病患者与健康人群在此基因位点上的相关性报道也不统一[15]。可见人种、地域等差异是导致MTHFR基因致病性的协同因素。另外,本研究所选SNP为两个研究最热的位点,数量过少,不足以覆盖整个MTHFR基因,使SNP对该基因的代表性弱;且所检标本数量较少,对先心病人群的代表性不足,可能也是阴性结果的影响因素之一。
此外,除了遗传因素外,环境因素也对先心病的发生起到重要影响。多因素logistic回归将多种环境因素纳入模型后发现母亲教育程度、家庭收入、患慢性病、优生认知得分、血清内叶酸代谢物(Hcy)水平、异常生育史等因素都可提高先心病的发生几率,不考虑环境因素,未观察到母亲MTHFR基因与子代先心病发生的相关性[13]。
综上,本研究得到的无差异结果不能完全说明MTHFR基因与先心病没有相关性,下一步工作需扩大样本量,并将患儿的父母纳入研究,将先心病患儿临床表型归类汇总,以探讨基因型与不同临床类型的相关性,同时寻找叶酸代谢通路上的其他关键基因,设计可覆盖相关基因的若干个SNP标记,研究其与先心病发病的相关性。
1 Hoffman JI.Incidence of congenital heart disease: II.Prenatal incidence.Pediatric cardiology,1995,16:155-165.
2 Botto LD,Correa A,Erickson JD.Racial and temporal variations in the prevalence of heart defectsb.Pediatrics,2001,107:E32.
3 Clark KL,Yutzey KE,Benson DW.Transcription factors and congenital heart defects.Annu Rev Physiol,2006,68:97-121.
4 张婧.先天性心脏病病因和预防的研究进展.中国循证儿科杂志, 2012,7:231-238.
5 Soemedi R,Wilson IJ,Bentham J,et al.Contribution of global rare copy-number variants to the risk of sporadic congenital heart disease. American journal of human genetics,2012,91:489-501.
6 王乐,赵梦川,李贵霞,等.GeXP多重RT-PCR技术在儿童呼吸系统病毒感染病原体检测中的应用,2015,38:852-856.
7 Lourdes GF,Ines GG,Gloria L,et al.MTHFR polymorphisms in Puerto Rican children with isolated congenital heart disease and their mothers.Int J Genet Mol Biol,2010,2:43-47.
8 张佳,廖端芳,张旭,等.高保真DNA聚合酶在SNP检测中的应用.南华大学学报医学版,2003,31:128-133.
9 Zhu H,Yang W,Lu W,et al.Gene variants in the folate-mediated one-carbon metabolism (FOCM) pathway as risk factors for conotruncal heart defects.Am J Med Genet A,2012,158A:1124-1134.
10 闫丽盈,李勇.MTHFR C677T基因多态性与先天性心脏病的关系.北京大学学报(医学版),2003,3:448.
11 RaIf J,Stefam K,Heinrich V.Infant methyIenetetrahydrofoIate reductase677TTgenotypeis a riskfactor for congenitaI heart disease.CardiovascRes,2001,5:251-254.
12 Zidan HE,Rezk NA,Mohammed D.MTHFR C677T and A1298C gene polymorphisms and their relation to homocysteine level in Egyptian children with congenital heart diseases.Gene,2013,529:119-124.
13 蒋幼芳,梅瑾,张闻,等.母亲MTHFR 677C/T多态性和孕期状况与子代发生先天性心脏病的相关性研究.中华流行病学杂志,2015,36:1072.
14 王莉娜,周世媛.MTHFR基因突变在先天性心脏病发病机制中的研究进展.临床和实验医学杂志,2012,11:1430-1431.
15 Sahiner UM,Alanay Y,Alehan D,et al.Methylene tetrahydrofolate reductase polymorphisms and homocysteine level in heart defects.Pediatr Int,2014,56:167-172.
The investigation of correlation between MTHFR gene polymorphism and congenital heart disease by means of GeXP multiplex analysis technique
FENGZhishan*,ZHAOMengchuan,WANGLe*,etal.
*PediatricResearchInstitute,HebeiProvincialChildren’sHospital,Shijiazhuang050031,China
Objective To investigate the correlation between methylenetetrahydrofolate reductase (MTHFR) gene polymorphism and congenital heart disease (CHD) by means of Genomelab genetic analysis system (GeXP).Methods The peripheral blood specimens of 261 children patients with CHD who
cardiac surgical procedures in Department of Cardiac Surgery of Hebei Provincial Children Hospital from February 2013 to December 2014 were collected,moreover, the peripheral blood specimens of 49 healthy children were collected as control group. The whole blood DNA was extracted from the blood specimens,then the two sensitive loci (rs1801131 and rs1801133) in MTHFR gene were detected by GeXP multiplex analysis technique. The correlation between MTHFR gene polymorphism and congenital heart disease was analyzed and statistically tested by chi-square test (χ2) with SPSS 16.0 software.Results The GeXP gene sequencing technique could simultaneously detect four kinds of genotypes of two single nucleotide polymorphism (SNP) . There were no significant differences in MTHFR677C/T allele and genotype frequency between CHD group and control group (χ2=0.853,P=0.356;χ2=0.898,P=0.343).Conclusion GeXP multiplex analysis platform is a kind of multiplex analysis technique in screening susceptibility genes of CHD,with fine specificity and simple operation.The experimental results show that there are no significant differences in MTHFR allele or its genotype distribution between patients with CHD and healthy children,which can be used to explore susceptibility genes of CHD and establish the basis of methodology for large sample study later.
congenital heart disease; MTHFR;children
10.3969/j.issn.1002-7386.2016.08.006
项目来源:河北省科学技术研究与发展支撑计划项目(编号:13277747D);传染病重大专项(编号:2013ZX 10004-001,2012ZX10004-215,2013ZX10004-202,2013ZX10004804-007)
050031 石家庄市,河北省儿童医院(冯志山、王乐、李贵霞、陶曙光、温琳琳、王琨);河北医科大学研究生学院(赵梦川);中国疾病预防控制中心病毒病预防控制所中心实验室(马学军)
李贵霞,050031 石家庄市,河北省儿童医院;
E-mail:13832179762@139.com
R 725.411
A
1002-7386(2016)08-1143-04
2015-11-21)
