溴化四苯基膦催化碳酸乙烯酯水解合成乙二醇反应
2016-05-06刘晓勤
张 民,刘晓勤
(1.江苏工程职业技术学院 纺染工程学院,江苏 南通 226007;2.南京工业大学 化学化工学院,江苏 南京 210009)
溴化四苯基膦催化碳酸乙烯酯水解合成乙二醇反应
张民1,刘晓勤2
(1.江苏工程职业技术学院 纺染工程学院,江苏 南通226007;2.南京工业大学 化学化工学院,江苏 南京210009)
摘要:通过对碳酸乙烯酯催化水解合成乙二醇反应机理的研究,找到了一种适合本法较好的催化剂-溴化四苯基膦,然后考察了催化剂的量、水比、反应温度、反应压力、反应时间等因素对反应转化率和选择性的影响,确定了本法较佳的反应工艺条件为:水比2.0-3.0,反应温度140-150℃,反应压力3.0-4.0MPa,催化剂用量2%左右,反应时间2-2.5h,在此条件下反应的转化率和选择性都能达到98%以上,并对各因素的影响运用STATISTICA 6.0进行了统计分析,得出水比和催化剂的量是影响转化率的主要因素,而选择性主要由水比和反应温度所决定.
关键词:碳酸乙烯酯;催化水解;乙二醇;水比;转化率;选择性
目前我国乙二醇的生产与需求存在着比较大的缺口,根据最新统计,截止2012 年底国内的聚酯(聚对苯二甲酸乙二醇酯,PET)产能已达3500 万吨/年,目前在建、拟建产能达1400万吨/年,预计到2015 年,国内PET 产能保守估计将达5000万吨/年.如果PET 装置开工率按80%计,单PET产业折算就需要乙二醇1300 多万吨/年,考虑其它行业需求,乙二醇总需求量将达1400 万吨/年.而目前我国乙二醇生产企业产能约为463.8万吨/年,即使目前国内在建、拟建的乙二醇项目全部建成投产,缺口仍达500 万吨/年左右[1,2].
目前乙二醇主要是采用环氧乙烷直接水合工艺生产,但是该工艺中水和环氧乙烷的摩尔比高达22:1,以致于后续精馏提纯工艺中要消耗大量的能量除去多余的水分,而且该法的转化率只有90%左右,产物中还有10%左右的二甘醇、三甘醇和聚合度更大的聚乙二醇等副产物[3-5].本文是对碳酸乙烯酯催化水解乙二醇反应工艺进行的研究,该工艺具有节约原料,节省能耗,减少设备投资,CO2循环利用等优点,弥补了当前生产工艺的不足,其生产成本比现行的环氧乙烷直接水合法工艺要低得多,而且CO2的回收利用,不仅减少资源的浪费,同时也抵制了排放的大量的CO2气体可能带来的“温室效应”,具有一定的环保意义[6-8].所以,该方法生产的乙二醇产品具有很强的市场竞争力,是一条非常具有吸引力的生产乙二醇的工艺方法,其应用前景非常广阔.
1实验部分
1.1基本原理
碳酸乙烯酯水解法合成乙二醇主要由酯化和水解两步组成.首先是由二氧化碳和环氧乙烷在催化剂作用下反应生成碳酸乙烯酯,然后碳酸乙烯酯再经催化水解制得乙二醇.其中,第一步酯化工艺的研究已经比较成熟[9,10],而对第二步水解反应的研究还不够深入.因此,本文选用碳酸乙烯酯为原料,以溴化四苯基膦为催化剂,通过催化水解反应合成乙二醇,其过程发生的主反应如下:
该反应实际上为酯化反应的逆反应,对于EC来说,又属于亲核取代反应.该反应的发生关键步骤是酰氧键的断裂,因此,选择合适的催化剂是至关重要的因素.据文献[11-13]报道,选用基于四价磷的相转移催化剂[其结构式为[(RI)4P]+X-,其中RI为烷基或芳基基团,X为卤素基团]有利于该反应的发生,因为体积大、极性大的季磷盐阳离子容易与RO-形成离子对,从而促进了酰氧键的断裂[14].本文正是选用了此种类型的催化剂——溴化四苯基膦对该反应进行了研究,实验证明采用此种催化剂时的反应速率比不采用催化剂时快数百倍,而且副产物DEG和TEG更少,乙二醇的选择性能够达到98%以上.
1.2试剂及仪器
碳酸乙烯酯(纯度不小于99.5%)、溴化四苯基膦,南通默克化学试剂有限公司;乙二醇,分析纯,上海凌峰化学试剂有限公司;高压反应釜,Ф15cm×2cm×18cm,温度程序自动控制仪,威海新元化工机械厂;SP-6801气相色谱仪,山东鲁南瑞虹化工仪器有限公司;分析天平、蒸馏瓶、冷凝管、温度计等.
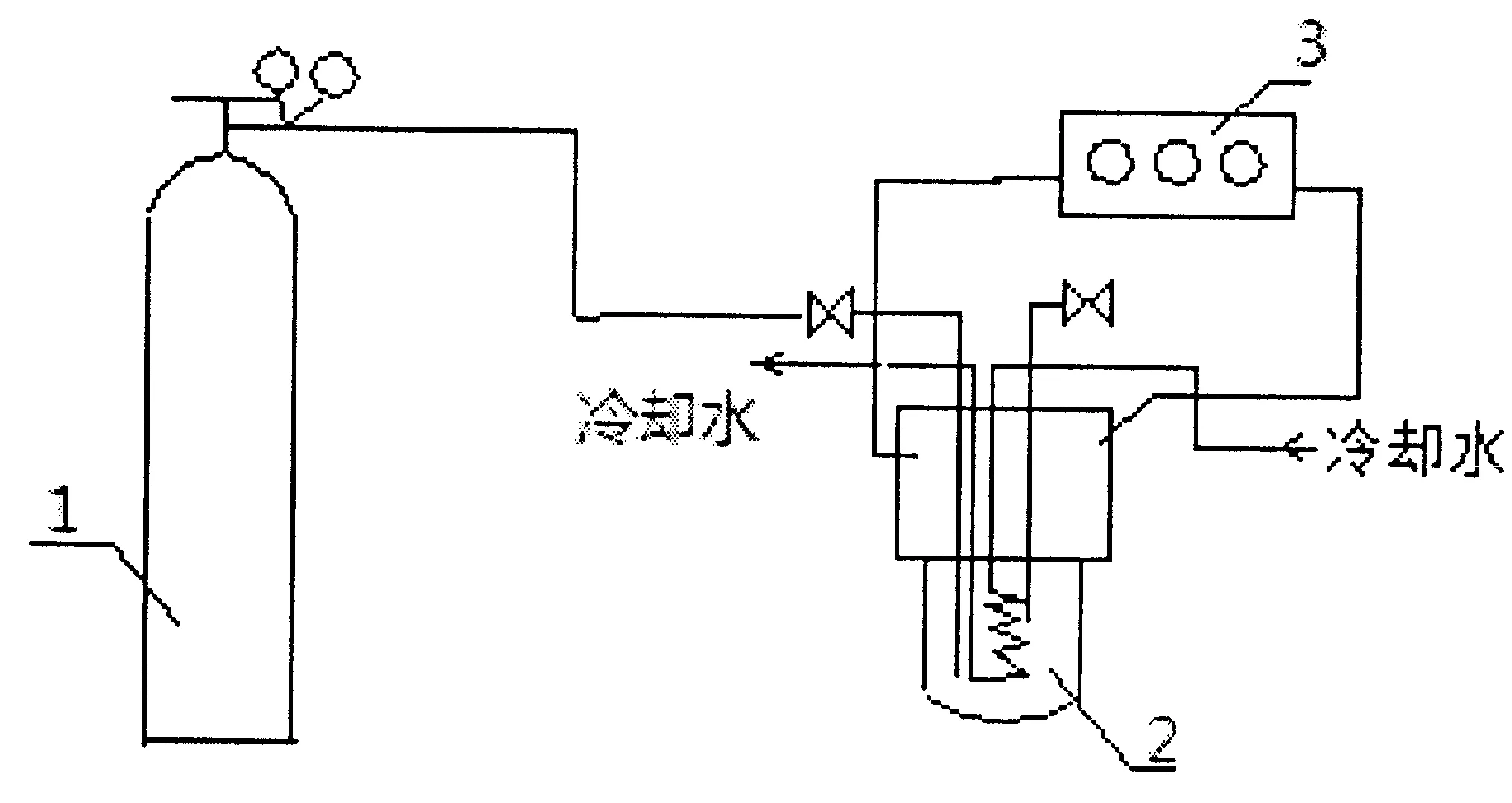
1-N2气体钢瓶;2-高压反应釜;3-温度控制器图1 实验装置图Fig.1 Chart of experimental apparatus
1.3实验方法
催化水解反应是在内径为11cm、高为18cm的圆柱型反应釜中进行的.反应前,先将反应釜洗净干燥,然后将由水和EC摩尔比为2.0的混合液200g(其中水58g,EC142g)、4g溴化四苯基膦催化剂加入到反应釜中,用N2置换系统中的空气3次,再用N2充压至4.0MPa,套上加热器,设定温度程序控制仪的升温程序,开启加热开关,逐渐升高温度.当温度升高到140℃时保持在该温度下反应2小时,反应过程中温度控制在140-150℃,当温度较高时适当通入冷却水.反应完毕后,移走加热器,开启冷却水,当冷却至室温时将釜内的残存气体放空,倒出反应产物、称重,然后进行气相色谱分析[15].本实验装置如图1所示.
1.4分析方法
气相色谱分析条件:色谱柱为柱长2m、Φ4mm×1mm的不锈钢填充柱,内装GDX-103固定相;载气H2,柱前压为0.06MPa;热导池检测器,桥流125mA;气化室温度250℃,检测室温度250℃,柱温220℃;进样量1.0μL.
分析方法:利用与标准物质对照的方法对产物进行定性分析,并通过配制不同溶度的标准溶液进行色谱分析,计算各组分的相对质量校正因子,然后采用面积归一化化法计算EC的转化率和选择性[16,17].

表1 各组分的相对质量校正因子
本实验测定的各组分的相对质量校正因子如表1所示,反应产物的气相色谱分析结果如图2和表2所示.
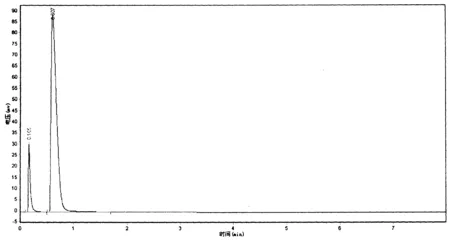
图2 反应产物的气相色谱分析图谱Fig.2 Gas chromatographic analysis of reaction products
从图2和表2的分析结果可以看出,在上述实验方法条件下,产物中只有水和乙二醇,没有其它的副产物,说明EC的转化率和选择性都为100%,结合表1中各组分的相对质量校正因子,计算出产物中乙二醇的质量分数为90.436%,产量约为117g.

表2 反应产物的气相色谱结果分析表
2结果与讨论
2.1影响因素
2.1.1催化剂及其用量的影响本文所加的催化剂的量是指为反应物碳酸乙烯酯和水的总量的质量百分数,实验过程中保持每次实验的反应物碳酸乙烯酯和水的总量不变.该催化剂的量对反应的影响见图3,从图中可以看出,催化剂的量宜选用2%左右,此时反应的转化率和选择性都接近100%.
该催化剂与其它催化剂如南京工业大学化学化工学院实验室自制的NY系列催化剂[10]相比具有反应温度更低,水比进一步缩小等优点,而对产物的收率没有影响,进一步节省了能耗.而且由于本催化剂沸点较高,易与产物在后续提纯工艺中分离,可以反复循环使用.
2.1.2水与碳酸乙烯酯的摩尔比的影响从主反应式可以看出,水与碳酸乙烯酯的摩尔比(以下简称“水比”)理论上为1:1,适当加大水的用量可以提高碳酸乙烯酯的转化率,促使碳酸乙烯酯反应完全,能够节省原料、降低生产成本.但水的用量也不能太大,否则后续将会消耗更多的热量用于产物中水的蒸发,所以水比应控制在适宜的范围内.水比对EC的转化率的影响和反应产物中水和乙二醇的质量分数见图4.从图中可以看出,当水比≥2.0时,产物中水和乙二醇的质量分数之和为100%,产物中只有水和乙二醇,说明EC转化率和EG选择性都是100%,但当水比大于3.5时,产物中水的含量超过40%,因此综合两方面考虑,水比适宜控制在2.0-3.0.
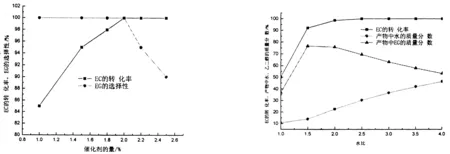
图3 催化剂量对反应的影响 图4 水比对反应的影响 Fig.3 Effect of catalyst dosage on the reaction Fig.4 Effect of n(H2O):n(EC)=2.0 on the reaction反应条件: n(H2O):n(EC)=2.0, 140℃, 3.0MPa, 2 h 反应条件: 催化剂量2%, 140℃, 3.0MPa, 2 h
2.1.3反应温度的影响本反应是微放热反应,从热力学角度考虑,升高反应温度不利于平衡向右移动,而从动力学角度考虑,提高反应温度有利于增加反应速度.但温度也不宜太高,否则乙二醇的选择性会下降,这主要是因为随着温度升高,EC的分解速率加快,分解产生的环氧乙烷与乙二醇继续反应生成了二甘醇的缘故,导致了乙二醇的选择性下降[18].反应温度对反应结果的影响见图5.从图中可以看出,反应温度宜控制在140-150℃,此时反应的转化率为100%,选择性大于98%.
2.1.4反应压力的影响从主反应式可以看出,该反应属于体积增大的反应,降低压力有利于反应向正反应方向进行,因此,本反应的压力不宜太高.本研究分别讨论了压力为1.0、2.0、3.0、3.5、4.0、4.5、5.0MPa时对反应产物的影响,结果见图6.从图中可以看出,反应压力宜控制在3.0-4.0MPa,此时反应的转化率和选择性都达到98%以上.
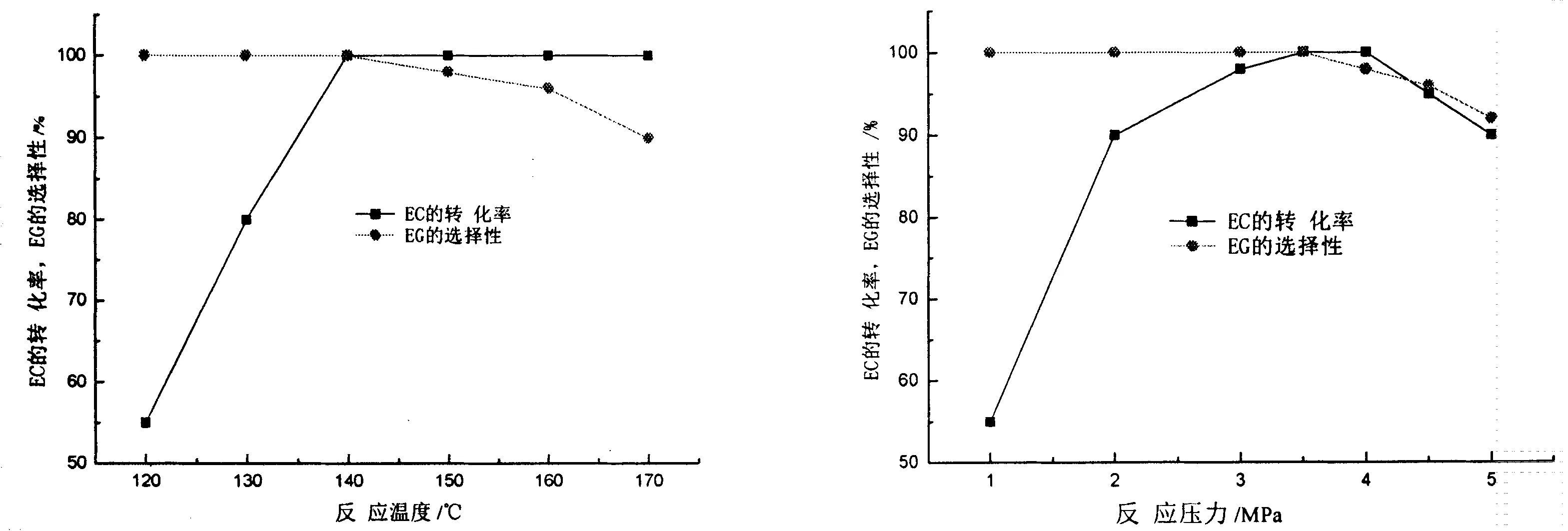
图5 反应温度对反应的影响 图6 反应压力对反应的影响Fig.5 Effect of temperature on the reaction Fig.6 Effect of reaction pressure on the reaction反应条件:n(H2O):n(EC)=2.0,催化剂量 反应条件: n(H2O):n(EC)=2.0, 催化剂量2%,3.0MPa,2h 2%,140℃,2h

图7 反应时间对反应的影响Fig.7 Effect of reaction time on the reaction反应条件:n(H2O):n(EC)=2.0,催化剂量2%,140℃,3.0MPa
2.1.5反应时间的影响反应时间较短,会使反应不完全;反应时间较长,则有可能会导致某些副产物的生成,所以反应时间应控制在适宜的范围之内,其对反应结果的影响见图7.从图中可以看出,反应时间以2-2.5h为宜,此时反应的转化率为100%,选择性达到98%以上.
综合上述各因素对反应的影响,确定了本工艺的较佳反应条件为:水比2.0-3.0,反应温度140-150℃,反应压力3.0-4.0MPa,催化剂质量分数2%左右,反应时间2-2.5h,在此条件下,反应的转化率和选择性都能够达到98%以上.
2.2各因素影响的统计分析
为了进一步确认水比(WR)、反应温度(T)、催化剂的量(CMF)、反应压力(P)等因素对反应转化率和选择性的影响程度的大小,参照相关文献[19],选用L9(34)正交表,制定了四因素三水平的正交实验.各因素的水平设计如表3所示,相应所得的实验结果如表4所示.
参考相关文献[20],对上述实验结果用STATISTICA 6.0中Experimental Design模块进行处理和分析,选择无交互作用(Include in model 中的No interactions),运用因素的正态概率图对各因素对转化率的影响进行分析,运用Pareto图对各因素对选择性的影响进行分析,分析结果如图8和图9所示.
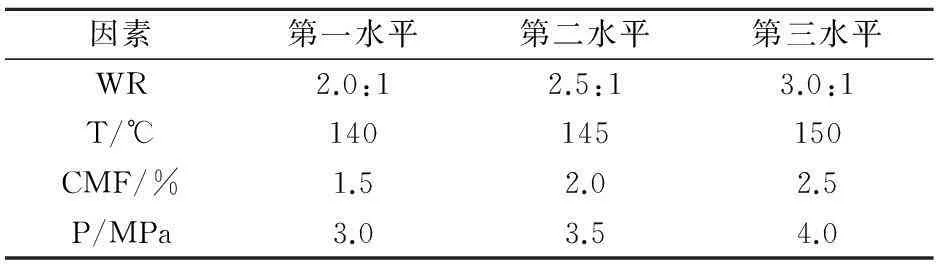
表3 正交实验因素水平设计表
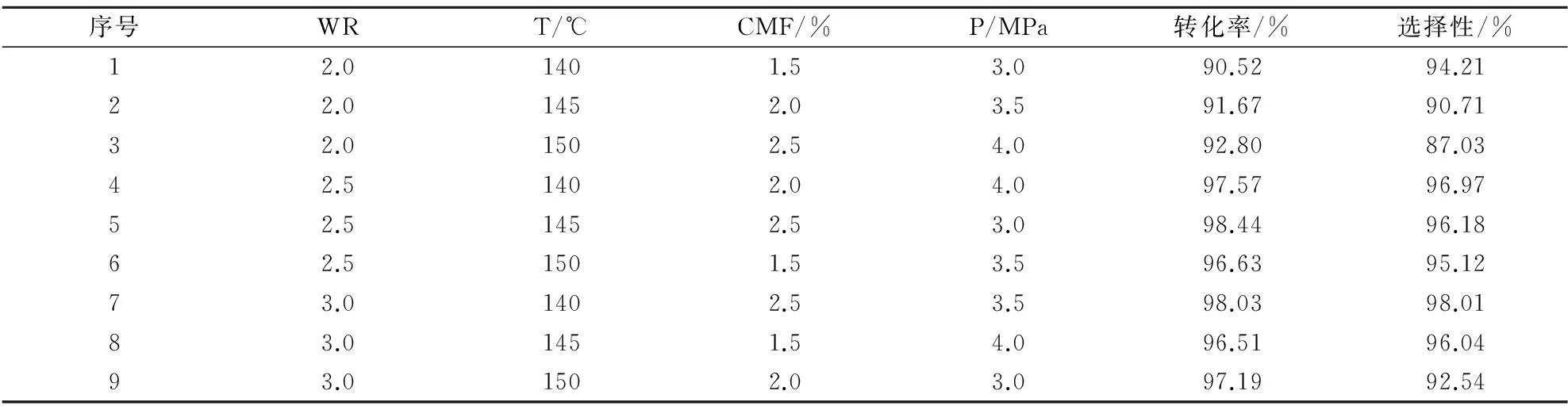
表4 正交实验结果表
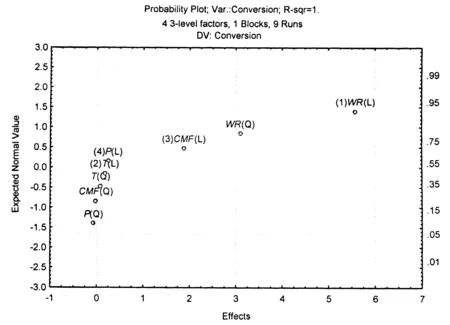
图8 影响转化率的各因素正态概率图Fig.8 Normal probability distributions for influencing factors of conversion

图9 影响EG选择性的各因素Pareto图Fig.9 Pareto distributions for influencing factors of selectivity
从图8可以看出,除了水比的一次效应WR(L)、二次效应WR(Q)和催化剂量的一次效应CMF(L)之外,其它的主效应都集中在一起,且随机分布在零的两边,数据点几乎形成一直线,这充分说明了主效应反应压力、反应温度以及催化剂的二次效应(Q)对转化率的影响较小,而WR(L)、WR(Q)和CMF(L)明显偏离零点,相互分开在图的右上方,说明水比和催化剂的量是影响转化率的主要因素,且相互之间没有关联.
从图9可以看出,选择性主要由水比WR和反应温度T(L)这二个因素决定,而主效应催化剂的量、反应压力对选择性的影响程度较小.
3结论
3.1通过对碳酸乙烯酯水解制乙二醇的反应机理的研究与分析,找到了一种适合本法较好的催化剂——溴化四苯基膦.
3.2通过对催化剂用量、水比、反应温度、反应压力和反应时间各因素对碳酸乙烯酯催化水合法制乙二醇反应影响的研究,得出了本法较佳的反应工艺条件为:水比2.0-3.0,反应温度140-150℃,反应压力3.0-4.0MPa,催化剂用量2%左右,反应时间2-2.5h,在此条件下,反应的转化率和选择性都能够达到98%以上.
3.3通过正交实验并运用STATISTICA 6.0对正交实验结果进行分析,得出水比和催化剂的量是影响转化率的主要因素,而选择性主要由水比和反应温度所决定,因此生产中要严格控制好水比、催化剂的量和反应温度这三个因素,保证反应高的转化率和选择性.
参考文献:
[1]谭捷.国内外乙二醇的供需现状及发展前景[J].石油化工技术与经济,2014,30(6):10-15.
[2]晓铭.世界乙二醇的供需分析及未来发展趋势[J].乙醛醋酸化工,2014,12:44-46.
[3]宋扬,陈迎,代艳平.环氧乙烷催化水合制乙二醇的工艺分析[J].化工与医药工程,2015,36(1):1-2.
[4]YUE Hairong, ZHAO Yujun, MA Xinbin, et al. Ethylene glycol: Properties, synthesis, and applications[J]. Chemical Society Reviews, 2012,41:4218-4244.
[5]SONG Heyuan, JIN Ronghua, KANG Meirong, et al. Progress in synthesis of ethylene glycol through C1 chemical industry routese[J]. Chinese Journal of Catalysis, 2013,34:1035-1040.
[6]MENG Zhenying, SUN Jian, WANG Jinquan,et al. An efficient and stable ionic liquid system for synthesis of ethylene glycol via hydrolysis of ethylene carbonate[J]. Chinese Journal of Chemical Engineering, 2010,18(6):962-966.
[7]SUN Jian, WANG Lei, ZHANG Suo Jiang, et al. ZnCl2/phosphonium halide: An efficient Lewis acid/base catalyst for the synthesis of cyclic carbonate[J]. J Mol. Catal. A: Chem., 2006,256:295-300.
[8]成卫国,孙剑,张军平,等.环氧乙烷法合成乙二醇的技术创新[J].化工进展,2014,33(7):1742-1745.
[9]沈玺,刘定华,刘晓勤.环氧乙烷水溶液和CO2合成碳酸乙烯酯[J].石油化工,2007,36(9):885-888.
[10]贺涛,刘定华,刘晓勤.碳酸乙烯酯催化水解合成乙二醇[J].化工进展,2008,27(11):1808-1812.
[11]KAWABE Kazuki. Development of highly selective mono-ethylene glycol production from ethylene oxide via ethylene carbonate using phosphonium salt catalyst[J]. Catal Surv Asia, 2010,14:111-115.
[12]张锁江,孙剑,成卫国,等.一种羟基离子液体制备环状碳酸酯的方法:中国,2007101199493[P].2008-02-27.
[13]KAWABE K. Method for producing mono-ethylene glycol: US, 6080897[P]. 2000-06-27.
[14]李丽娟,刘崧,温志刚.药物合成技术[M].北京:化学工业出版社,2010:124-125.
[15]张民.催化水合乙二醇工艺中催化剂的溶剂研究[D].南京:南京工业大学,2005.
[16]王浩,陈建,刘定华,等.碳酸乙烯酯水解法合成乙二醇气相色谱分析[J].石油与天然气化工,2011,40(5):514-518.
[17]黄一石.仪器分析[M].北京:化学工业出版社,2002:274-279.
[18]陈蓝天,龚涛.碳酸乙烯酯的分解反应[J].石化技术与应用,2008,26(3):216-217.
[19]北京大学数学力学系概率统计组.正交设计——一种安排多因素实验的数学方法[M].北京:人民教育出版社,1976:62-80.
[20]马正飞,殷翔.数学计算方法与软件的工程应用[M].北京:化学工业出版社,2002:225-240.
Synthesis Reaction of Ethylene Glycol by Catalytic Hydrolysis of Ethylene Carbonate with Tetraphenylphosphonium Bromide
ZHANG Min1,LIU Xiao-qin2
(1. Secondary College of Textile and Dye Engineering, Jiangsu College of Engineering and Technology, Nantong 226007, China; 2. Chemical Engineering Institute, Nanjing University of Technology, Nanjing 210009, China)
Abstract:A better catalyst had been found for synthesis process of ethylene glycol by catalytic hydrolysis of ethylene carbonate, which was tetraphenylphosphonium bromide. The effects of the factors on the reaction conversion and selectivity had been studied, including the amounts of catalyst, water ratio (short for molar ratio of ethylene carbonate to water), reaction temperature, reaction pressure and reaction time. The optimal reaction process conditions had been obtained as follows: water ratio was 2.0-3.0, reaction temperature was 140-150 ℃, reaction pressure was 3.0-4.0MPa, the mass fraction of catalyst was about 2%, the reaction time was 2-2.5 hours. Under above conditions, the reaction conversion and selectivity can both reach above 98%. Then the effects of every factor had been analyzed more deeply by STATISTICA 6.0. The conclusions had been drawn that the influences of water ratio and the amounts of catalyst were more remarkable on the conversion rate, and the more significant factors to influence the selectivity were water ratio and reaction temperature.
Key words:ethylene carbonate; catalytic hydrolysis; ethylene glycol; water ratio; conversion; selectivity
中图分类号:TQ223.1
文献标志码:A
文章编号:1001-2443(2016)02-0144-06
作者简介:张民(1980-),男,汉,江苏阜宁人,讲师,硕士,主要从事化学化工方面的教学与乙二醇合成新工艺的研究工作.
基金项目:江苏工程职业技术学院院级科研基金项目(FYKY/2013/16).
收稿日期:2015-06-25
DOI:10.14182/J.cnki.1001-2443.2016.02.010
引用格式:张民,刘晓勤.溴化四苯基膦催化碳酸乙烯酯水解合成乙二醇反应[J].安徽师范大学学报:自然科学版,2016,39(2):144-149.
