二苯乙烯苷及其β-环糊精包合物的稳定性研究
2016-05-05王文静刘冬丽王葳魏泽英
王文静 刘冬丽 王葳 魏泽英
650500 昆明,云南中医学院中药学院[王文静、刘冬丽(硕士研究生)、王葳、魏泽英]
·论著·
二苯乙烯苷及其β-环糊精包合物的稳定性研究
王文静刘冬丽王葳魏泽英
650500昆明,云南中医学院中药学院[王文静、刘冬丽(硕士研究生)、王葳、魏泽英]
【摘要】目的明确影响二苯乙烯苷及其β-环糊精包合物稳定性的因素。 方法以β-环糊精与二苯乙烯苷用量比、包合时间、包合温度为影响因素,按L9(34)正交实验筛选包合条件;利用高效液相色谱法,以二苯乙烯苷含量为指标,分别考察了人工胃液、人工肠液及醋酸-醋酸钠缓冲液、氨-氯化铵缓冲液、光照对二苯乙烯苷及其β-环糊精包合物稳定性的影响。 结果(1)根据正交实验结果,确定最佳包合条件为:8倍量的β-环糊精,包合时间为2小时,包合温度为35℃;(2)12小时内,二苯乙烯苷未包合物的含量在人工胃液中由100%下降至79.7%,在醋酸-醋酸钠缓冲液中由100%下降至15.9%;β-环糊精包合物中二苯乙烯苷含量在人工胃液中1小时达到100%,在醋酸-醋酸钠缓冲液中2小时达到100%,随后受酸度影响逐渐下降。二苯乙烯苷未包合物在人工肠液及氨-氯化铵缓冲液中的稳定性差,几乎无法存在;其β-环糊精包合物的稳定性有所改善,在肠液中0.5小时含量达95.8%,之后未检出;在碱性缓冲液中4小时达到峰值,6小时后未检出。光照条件下,48小时后二苯乙烯苷的含量由100%下降至50.2%;β-环糊精包合物的含量在实验条件下明显得到改善,48小时后含量仍可达90.5%。 结论二苯乙烯苷及其β-环糊精包合物在酸性环境下较碱性条件下稳定;在酸性溶液中,随着溶液酸性增强,其稳定性变差;β-环糊精包合物的稳定性明显强于未包合物,说明利用β-环糊精对二苯乙烯苷进行包合可以在一定程度上使其稳定。
【关键词】二苯乙烯苷;β-环糊精包合物;何首乌;稳定性;含量测定
何首乌为蓼科植物何首乌PolygonummultiflorumThumb.的干燥块根,是常用补益中药,二苯乙烯苷是其主要化学成分[1-3],具有降血脂、抗动脉粥样硬化、抗衰老等作用,应用前景较好,但由于其稳定性较差[4-6],在一定程度上限制了对其开发利用。就给药途径看,何首乌主要通过口服给药,因此课题组考察了人工胃液、人工肠液、醋酸-醋酸钠缓冲液、氨-氯化铵缓冲液等对二苯乙烯苷及其包合物稳定性的影响。
1材料与方法
1.1试剂
二苯乙烯苷对照品(批号:0844-200003)购于中国药品生物制品检定所;二苯乙烯苷样品(自制,98.77%);β-环糊精(批号:T20140424)购于中国医药(集团)上海化学试剂公司;甲醇、乙腈购于德国Merk公司(色谱纯);实验用水为石英二次重蒸水,其余试剂均为分析纯。
1.2仪器
U-3000型高效液相色谱仪(美国Dionex公司);YSEI药品稳定性试验箱(重庆市永生实验仪器厂);UV-2450型紫外-可见分光光度计(日本岛津公司);pH-10型酸度计(德国赛多利斯);先行者CP214型分析天平(上海奥豪斯仪器有限公司)。
1.3色谱条件及含量测定
C18色谱柱:(150 mm×0.5 mm,0.45 μm),phelomen公司;流动相:乙腈-水(25︰75,V︰V);检测波长:320 nm;柱温:25 ℃;流速:1.0 mL/min[2-3]。采用高效液相色谱(HPLC)测定[2-3,7],进样10 μL,检测二苯乙烯苷的含量变化。
1.4对照品及供试品溶液的制备
对照品溶液的制备:精密称取二苯乙烯苷对照品11.0 mg,置于10 mL容量瓶中,甲醇溶解并定容,制成1.10 mg/mL的对照品溶液,备用。
供试品溶液的制备:精密称取自制二苯乙烯苷样品2.2 mg,置于10 mL容量瓶中,甲醇溶解并定容,制成0.22 mg/mL的供试品溶液,备用。
1.5线性范围、精密度及稳定性考察
取对照品溶液适量,分别配制成浓度为0.22、0.44、0.66、0.88、1.10、2.20和3.30 μg/μL的标准品溶液,经0.45 μm微孔滤膜过滤,置于样品瓶中,HPLC测定,自动进样,进样体积为5.0 μL。回归分析,标准曲线为A = 6820.20 m+24.20(r=0.9996),A为峰面积,m为进样质量(μg)。即进样量在1.1~16.5 μg之间线性关系良好。
仪器精密度考察:取上述对照品溶液,在测定条件下进样5 μL,连续进样6次,其峰值面积相对标准偏差(relative standard deviation,RSD)为0.12%,表明仪器精密度良好。
标准品溶液稳定性考察:取上述对照品溶液,在测定条件下进样5 μL,分别于0天、1天、2天、3天、4天、5天、6天、7天时考察峰面积的变化,其RSD为1.29%。结果表明,二苯乙烯苷溶液在7天内稳定。
1.6理论塔板数
色谱条件及系统适用性实验:C18色谱柱150 mm×0.5 mm,0.45 μm,phelomen公司;以乙腈-水(25︰75,V︰V)为流动相;检测波长为320 nm。理论塔板数按2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷计算,不低于3500。分离度均大于1.5,拖尾因子均在0.95~1.05之间。
1.7β-环糊精包合二苯乙烯苷条件优化
通过预实验结果,以β-环糊精为主体,二苯乙烯苷为客体,饱和水溶液法进行包合实验。以β-环糊精与二苯乙烯苷用量比、包合时间、包合温度为影响因素,按L9(34)正交实验筛选包合条件。因素水平设计见表1,实验安排见表2,方差分析见表3。
操作方法:取一定量β-环糊精,加水1500 mL,50℃水浴中溶解,置磁力搅拌器上搅拌,转速500 rpm;取二苯乙烯苷样品10.0 g,用15.0 mL蒸馏水溶解,缓慢滴加进β-环糊精的水溶液中,按相应的时间和温度进行包合实验[8~10]。按1.3项下方法对包合物进行定性和定量检测。

表1 二苯乙烯苷包合正交实验因素水平表

表2 二苯乙烯苷提取工艺正交实验表
注: 包合率=(包合物中药物的量/药物投药总量)×100%
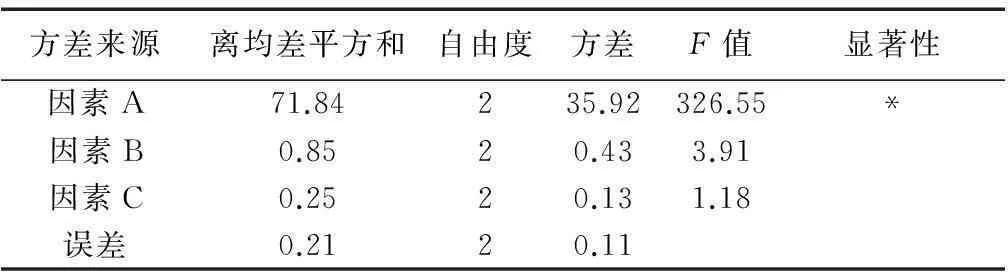
表3 实验结果方差分析
注: F0.05(2,6)=5.14;*P<0.05
1.8统计学处理
采用SPSS 18.0统计学软件对正交实验进行多因素方差分析,比较因子水平变化对指标实验的显著差别的影响。根据结果分析,其中因素A对包合实验的影响最大。
1.9二苯乙烯苷及其包合物的稳定性实验
1.9.1二苯乙烯苷及其包合物在人工胃液及人工肠液中的稳定性分别取二苯乙烯苷及其包合物样品2.3 mg和31.5 mg,置25 mL容量瓶中,分别用人工胃液、人工肠液溶解,定容,置于37.5℃水浴中保温,按HPLC测定条件分别测定其在0小时、0.5小时、1.0小时、2.0小时、4.0小时、6.0小时、8.0小时、12.0小时、24.0小时、48.0小时二苯乙烯苷含量变化。
1.9.2二苯乙烯苷及其包合物在醋酸盐和氨-氯化铵缓冲液中的稳定性分别配制醋酸-醋酸钠缓冲液和氨-氯化铵缓冲液,pH值分别为5.0和9.0,备用。按1.9.1项方法实验,测定二苯乙烯苷的含量变化。
1.9.3光照条件下二苯乙烯苷的稳定性将二苯乙烯苷样品置于光照试验箱内,强光照条件下,与1.9.1项时间设定相同,分别考察二苯乙烯苷的含量变化。
2结果
2.1β-环糊精包合二苯乙烯苷条件
由表2可见,提取二苯乙烯苷的较佳工艺条件是A2B3C1组合。方差分析表3表明,包合温度(因素C)和包合时间(因素B)有较小的影响,β-环糊精与二苯乙烯苷用量比例(因素A)有显著影响。综合分析,最佳包合条件为用8倍量的β-环糊精,包合时间为2.0小时,包合温度为35℃。
2.2不同介质中二苯乙烯苷及其包合物的稳定性
二苯乙烯苷及其包合物在人工胃液中稳定性较好,48小时后,仍有50%左右可检出。但在人工肠液中,二苯乙烯苷样品稳定性差,几乎没有检出;二苯乙烯苷包合物的稳定性有所改善,0.5小时后达95.8%,之后未检出。结果见表4和图1的A、B。
二苯乙烯苷及其包合物在醋酸盐缓冲液中,24小时内稳定性较好,之后稳定性较差。在氨-氯化铵缓冲液中,二苯乙烯苷样品稳定性差,不能检出;但二苯乙烯苷包合物的稳定性在3小时内明显改善,但之后稳定性变差,6小时后未检出。结果见表4和图1的C、D。

表4 二苯乙烯苷及其包合物在不同条件下的稳定性±s,%,n=5)
注: 1#:二苯乙烯苷样品;2#:二苯乙烯苷包合物样品。

图1 二苯乙烯苷在不同环境中的HPLC图
在人工肠液及氨-氯化铵缓冲液中的二苯乙烯苷及其包合物的色谱峰均无法检测到,说明二苯乙烯苷对碱性环境敏感,易分解或转化,因此,分别考察了不同碱性环境对二苯乙烯苷稳定性的影响。结果表明,二苯乙烯苷在碱性环境中 (pH≥9) 稳定性较差,不能以原形式存在。结果见表4和图1的B、D。
在光照条件下,二苯乙烯苷包合物的稳定性明显强于未包合物。
分析结果表明,二苯乙烯苷在酸性环境下的稳定性较在碱性环境下好;而在醋酸-醋酸钠缓冲液中的稳定性又较在胃液中的稳定性好,即随着酸性增强,二苯乙烯苷变得不稳定。
3讨论
二苯乙烯苷具有多种药理作用,近年来其抗癌活性及相关化学研究报道也较多[11~14],但其稳定性较差,一定程度上限制了对其开发利用。因此,有必要对二苯乙烯苷的吸收及代谢形式进行系统考察。
本文从“模拟人体环境”的胃肠液及酸碱性、光照等化学及存贮环境的影响对二苯乙烯苷的含量进行了分析。二苯乙烯苷及其包合物在人工胃液及醋酸-醋酸钠缓冲液中的稳定性均较好,但相比之下,β-环糊精包合物的二苯乙烯苷量在胃液和醋酸缓冲液中分别在1.0小时和2.0小时达到峰值;二苯乙烯苷在人工肠液及氨-氯化铵缓冲液中的稳定性差,几乎无法存在(放置5分钟后即无法检测到其紫外吸收)。结果表明,二苯乙烯苷在酸性环境下的稳定性较在碱性环境下好;而在醋酸-醋酸钠缓冲液中的稳定性又较在胃液中的稳定性好,即随着酸性的增强,二苯乙烯苷会变得更加不稳定。β-环糊精包合物的稳定性又与碱性强弱有关,因此,在一定程度上保护了二苯乙烯苷的有效存在。光照条件对二苯乙烯苷的稳定性也有一定影响,β-环糊精包合物可以改善人体环境及光照等因素对二苯乙烯苷稳定性造成的影响。
二苯乙烯苷是中药何首乌的主要有效成分之一,传统用药方式为水煎煮或者制成“药酒”,传统给药方式以口服为主,二苯乙烯苷进入体内后吸收程度如何,是否发生变化,到达靶器官的作用形式是什么等,这些问题有待今后的深入探讨。体外实验结果表明,二苯乙烯苷在人工肠液中稳定性较差,提示二苯乙烯苷在体内可能并不以原形式吸收和发挥药效。苷类物质由于其结构的不稳定性在体内主要以代谢物存在,代谢物是其药效的主要来源,二苯乙烯苷在体内生物和化学环境下会发生什么样的变化,以何种形式作用于靶点,有待进一步的体内代谢研究。
参考文献
[1]李建北,林茂.何首乌化学成分的研究[J]. 中草药,1993,24(3): 115-118.
[2]国家药典委员会. 中华人民共和国药典(一部)[M].北京:化学工业出版社,2005: 122.
[3]国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010: 164.
[4]班翔,刘其礼,金悠.二苯乙烯苷的稳定性研究[J].中草药,2004,35(11): 1235-1237.
[5]刘振丽,宋志前.不同地区制首乌中二苯乙烯苷含量测定及稳定性考察[J].中成药,2002,24(9): 684-685.
[6]吕丽爽.何首乌中二苯乙烯苷的制备及抗氧化机理研究[D].无锡:江南大学,2006:27-28,46-47,61-66.
[7]武政,张勉,张朝凤,等.36批何首乌药材质量的 HPLC 指纹图谱评价研究[J].中国药学杂志,2006,41(4): 257-260.
[8]陈晓灵,李祥.正交实验法研究白术挥发油提取及β-环糊精包合工艺[J].河北医药,2006,28(3): 228-229.
[9]郭炜,袁志芳,张兰桐.当归芍药软胶囊中挥发油提取及其β-环糊精包合工艺的研究[J].中成药,2006,28(1): 128-130.
[10]李慧,王一涛,费超.β-环糊精包合川芎、当归共有挥发性成分的工艺优选[J].中国医院药学杂志,2006,26(3): 264-266.
[11]Ioanna P, Meletios V, Betina M, et al. Plant stilbenes induce endoplasmic reticulum stress and their anti-cancer activity can be enhanced by inhibitors ofautophagy[J]. Experimental Cell Research, 2015, 339(1): 147-153.
[12]Rosa MC, Eva F, Juan M, et al. Inhibitory effect of cytotoxic stilbenes related to resveratrol on the expression of the VEGF, hTERT and c-Myc genes[J]. European Journal of Medicinal Chemistry, 2015, 103(10): 488-496.
[13]Federica M, Giuseppe G, Massimo C, et al. Effect of substituted stilbenes on plateletfunction[J]. Fitoterapia, 2015, 105(9): 228-233.
[14]Helmut K, Natalia Z, Leslie C. X-ray topographic study of growth defects of trans-stilbene crystals grown fromsolutions[J]. Journal of Crystal Growth, 2015, 429(11): 74-81.
(本文编辑: 韩虹娟)
The stability study of stilbene glucoside and its β-cyclodextrin inclusion complex
WANGWen-jing,LIUDong-li,WANGWei,etal.
FacultyofChineseMateriaMedica,YunnanUniversityofTraditionalChineseMedicine,Kunming650500,China
【Abstract】ObjectiveTo make certain the influence factors of affecting the stability of stilbene glucoside and its β-cyclodextrin inclusion complex. MethodsThe β-cyclodextrin inclusion of stilbene glucoside was conducted according to an L9(34) orthogonal experiment design with three factors, namely the ratio of β-cyclodextrin amount to stilbene glucoside, the time and temperature of inclusion. The contents of stilbene glucoside were detected by HPLC in a simulated gastric fluid, a simulated intestinal fluid, an acetic acid-sodium acetate buffer solution, an ammonia-ammonium chloride buffer solution, and under illumination, respectively. Results1. Optimal inclusion conditions from orthogonal experiments were an amount of β-cyclodextrin 8 times as much as that of stilbene glucoside, an inclusion time was 2.0 h and inclusion temperature was 35℃. 2. The content of stilbene glucoside without β-cyclodextrin inclusion in the simulated gastric fluid went down from 100% to 79.7% in 12.0h, and in the acetic acid-sodium acetate buffer solution declined from 100% to 15.9%. The content of the β-cyclodextrin inclusion complex of stilbene glucoside in the simulated gastric fluid went up to 100% in 1.0 h and 2.0h in the acetic acid-sodium acetate buffer solution, and afterwards went down gradually influenced by the acidity of the fluid. Stilbene glucoside without β-cyclodextrin inclusion was very unstable in the simulated intestinal fluid and the ammonia-ammonium chloride buffer solution. The β-cyclodextrin inclusion complex of stilbene glucoside was more stable, and the content was reached 95.8% in the simulated intestinal fluid in 0.5h, and became undetectable afterwards, and it was reached peaked in 4.0 h and became undetectable in 6.0 h in the alkaline solution. Under illumination, the content of stilbene glucoside without β-cyclodextrin inclusion went down from 100% to 50.2% in 48.0h, and its β-cyclodextrin inclusion complex was more stable with the content of 90.5% in 48.0h. ConclusionStilbene glucoside and its β-cyclodextrin inclusion complex are more stable in an acid solution than in an alkaline solution. In acid solution, the stability becomes weaker with the increment of the acidity. The stability of the β-cyclodextrin inclusion complex of stilbene glucoside is stronger than without β-cyclodextrin conclusion. β-cyclodextrin can be used to make stilbene glucoside more stable as an inclusion complex.
【Key words】Stilbene glucoside;β-cyclodextrin inclusion complex;Polygonum multiflorum;Stability;Determination of content
(收稿日期:2016-01-15)
Corresponding author:WEI Ze-ying, E-mail: janewei7@hotmail.com
【中图分类号】R932
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2016.04.008
作者简介:王文静(1977- ),女,博士,副教授。研究方向:中药化学成分及质量控制研究。E-mail: notoww@163.com通讯作者: 魏泽英(1964- ),女,硕士,副教授。研究方向:中药化学成分及质量控制研究。E-mail: janewei7@hotmail.com
基金项目:国家自然科学基金(81060337)
