聚焦离子束扫描电镜研究微体化石的微观孔隙结构
2016-05-03胥畅王文卉姚素平南京大学地球科学与工程学院南京20023中国科学院南京地质古生物研究所资源地层学与古地理学重点实验室南京20008
胥畅,王文卉,2*,姚素平.南京大学地球科学与工程学院,南京20023;2.中国科学院南京地质古生物研究所,资源地层学与古地理学重点实验室,南京20008
聚焦离子束扫描电镜研究微体化石的微观孔隙结构
胥畅1,王文卉1,2*,姚素平1
1.南京大学地球科学与工程学院,南京210023;2.中国科学院南京地质古生物研究所,资源地层学与古地理学重点实验室,南京210008
摘要:聚焦离子束扫描电镜(FIB-SEM)是将聚焦离子束切割和扫描电镜结合起来的双束系统,可以在纳米尺度对样品进行切割加工与实时成像。文中用聚焦离子束扫描电镜对兰多维列统(志留系)龙马溪组黑色页岩内的几类微体化石进行了观察研究,并显示牙形刺、几丁石、疑源类均发育有亚微米至纳米级孔隙,这些孔隙可以为页岩气的储集提供有效空间,不同的微体化石孔隙发育的差异可以为页岩中有机质孔隙非均质性成因研究提供重要依据。
关键词:聚焦离子束扫描电镜(FIB-SEM);兰多维列统;龙马溪组;微体化石;纳米孔隙
聚焦离子束扫描电镜(Focusedionbeamscanning electron microscopy,FIB-SEM)是用于纳米结构分析和纳米材料加工的仪器。聚焦离子束扫描电镜(FIB-SEM)通过聚焦离子束(Ga离子束)的连续切割和电子束的实时成像,可以清晰地在纳米尺度的分辨率下对页岩各组分尤其是孔隙进行三维、高稳定性、高质量的显微形貌及结构的观察与分析,因而在研究页岩储层的纳米级孔隙上得到广泛应用(焦堃,2015;马勇等,2014)。
上扬子区奥陶纪—志留纪之交的五峰组—龙马溪组是产页岩气的主力层系(郭彤楼和刘若冰,2013;郭彤楼和张汉荣,2014)。在四川盆地东缘焦石坝构造实施的JY1井,目前已经在上奥陶统五峰组—下志留统龙马溪组页岩中获得稳定高产工业气流。龙马溪组页岩气储层中存在大量的纳米孔隙(陈尚斌等,2012;陈文玲等,2013)。研究表明,有机质孔隙是其中最重要的孔隙类型(Lu et al,1995; Chalmers et al,2008),但有机质孔隙分布极不均匀,同一显微视域内,不同有机质颗粒纳米孔隙发育差异较大(Louckset al.,2009; Curtis et al,2012)。JY1井龙马溪组页岩内存在大量的微体化石,如:几丁石、疑源类、牙形刺和虫颚化石等,这些微体化石构成了龙马溪组页岩气的主要成烃母质(Suchy et al.,2002; Al-Ameri,2010; Petersen et al,2013),并且能作为页岩微孔的主要贡献者( Lu et al,1995; Ross et al,2006,2007; Chalmers et al.,2008)。对上述生物化石进行内部结构的研究,了解化石内部存在的孔隙(洞)类型和发育特征,有助于了解不同成烃母质在页岩气生成和储集中的作用。
传统的微体化石研究方法有两种,一是观察经化学溶蚀后的孤立化石(扫描电子显微镜SEM),二是观察磨制的化石薄片(常规光学显微镜和透射电子显微镜TEM)。这两种方法均有不足之处,前者难于观察到化石内部结构;后者制样繁杂,并且涉及到样品的富集,以及在切片过程中可能造成非样品原有的“伪构造”现象(王春朝等,2006)。近年来兴起的化石标本的X射线三维无损成像技术也已经成为古生物学研究中的重要手段之一(殷宗军等,2014),保持化石的无损性是其重要优势,但其空间分辨率为亚微米级,略逊于聚焦离子束扫描电镜的纳米尺度分辨率。本文尝试利用聚焦离子束扫描电镜对微体化石进行内部结构的观察。在纳米尺度的分辨率下观察微体化石内的细微构造,特别是微观孔隙结构,不仅利于微体化石的分类定名,还有助于了解页岩中微体化石内发育的亚微米—纳米孔隙对页岩储集空间的贡献。
1 研究材料及方法
本次实验样品(图1)均来自四川盆地东缘焦石坝地区的JY1井。实验用牙形刺(图1A),几丁石(图1B,C)和疑源类(图1D)化石产自深度2367.4 m的龙马溪组灰黑色泥岩样品,标本号:64-93-433;实验用虫颚(图1E)化石产自深度2368.94 m的龙马溪组灰黑色泥岩样品,标本号:H20121750。上述样品层位大致相当于Coronograptus cyphus笔石带。
用聚焦离子束扫描电镜观察微体化石,样品准备工作和SEM类似,样品采用Paris(1981)提出的标准微体化石处理分析方法。每块样品的质量为10 g。具体处理流程为:将去除表面污染的样品破碎到0.5 cm左右,而后,用10%的HCl和40%的HF浸泡处理去除碳酸钙和硅酸盐矿物,多次清水洗涤至中性后,用12.5%的盐酸加热处理4~5次,再多次清水洗涤至中性(Tang et al.,2007)。而后,用粒径为53 μm的筛子过筛,收集粒径大于53 μm的残留物。将残留物移至玻璃皿中,用特制的毛细吸管在体视显微镜下将几丁石等微体化石与杂质分开,提取的化石排置于扫描电镜用铜桩上,镀金后进行聚焦离子束扫描电镜下的观察和照相。
用聚焦离子束扫描电镜进行化石研究工作的流程一般是:首先将样品放入聚焦离子束微加工系统的样品室内,待抽真空后,首先用SEM进行观察。将电镜工作距离调至4 mm,再通过SEM成像,找到单个微体化石样品。选定适当的切面位置后,将样品台旋转52°,使离子束与样品所固定平面垂直,然后使用适当能量的镓离子束对样品选定位置进行切割。微体化石样品经离子束切割后,切面是平行于离子束方向的,此时可以通过SEM从侧上方直接进行观察。
微体化石样品的处理和挑选在南京地质与古生物研究所完成;利用聚焦离子束扫描电镜对微体化石的观察和照相在南京大学物理学院介电超晶格国家重点实验室Strata FIB 201聚焦离子束微加工系统内完成。该仪器采用离子源是镓液体源(1 500 h),加速电压: 5~30 KV,离子束流强度: 1~11 500 pA,离子束成像分辨率: 7 nm (1 pA 30 kv),样品台尺寸:50 mm×50 mm。上述化石样品均保存在南京大学地球科学与工程学院古生物实验室。
2 研究结果
图2及图3为微体化石在双束电镜下经FIB切割形成的SEM图像,显示了化石的内部微观结构。蓝色方框显示图片放大位置(下同)。
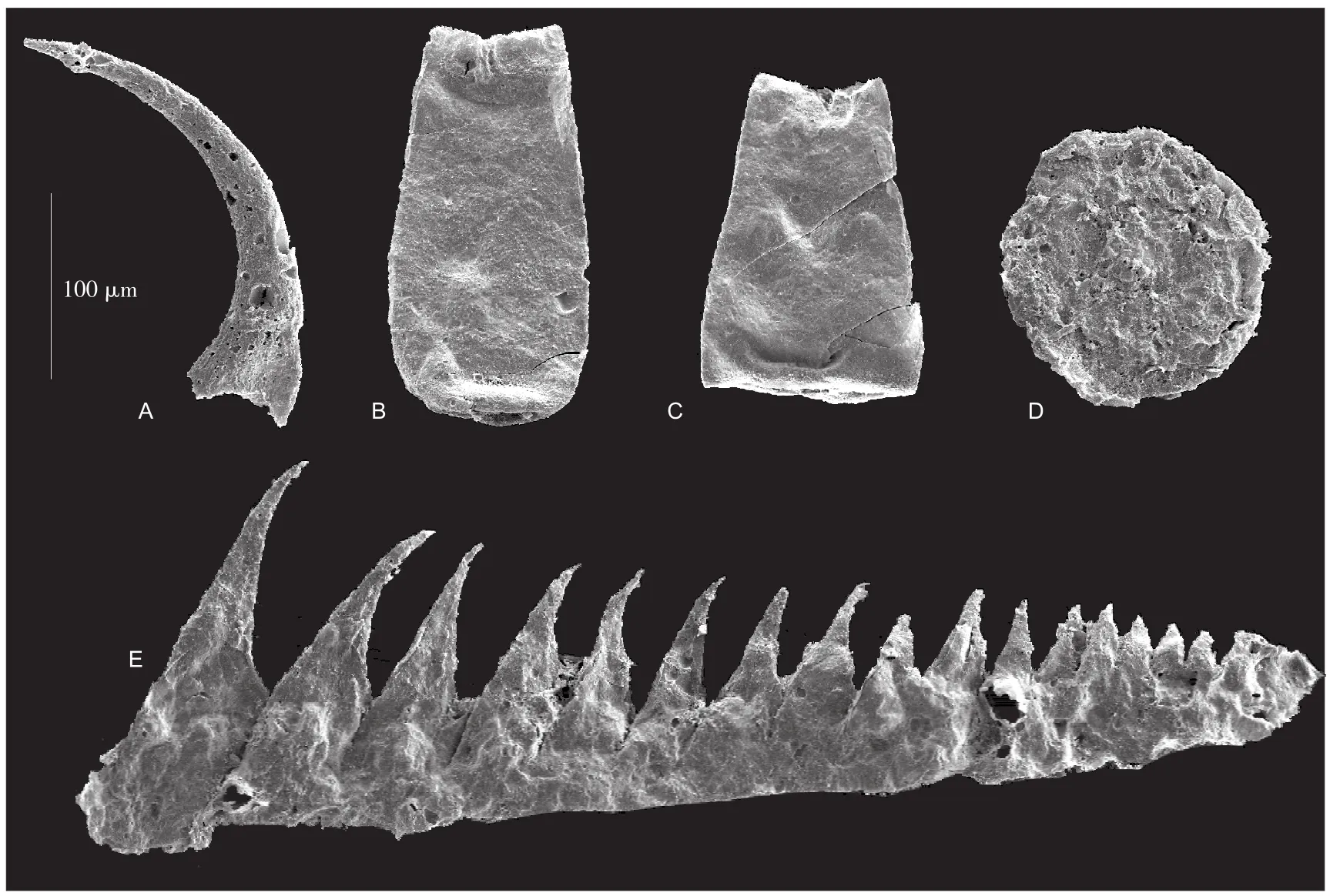
(A)牙形刺Paltodus unicostatus ( Branson and Mehl.); (B)几丁石Conochitina edjelensis (Taugourdeau); (C)几丁石Eisenachitina inanulifera; (D)疑源类Leiosphaeridia sp.; (E)虫颚化石Kozlowskiprion sp.(A) Specimen of conodont Paltodus unicostatus ( Branson and Mehl.); (B) Specimen of chitinozoan Conochitina edjelensis (Taugourdeau); (C) Specimen of chitinozoan Eisenachitina inanulifera;(D) Specimen of acritarch Leiosphaeridia sp.;(E) Specimen of scolecodont Kozlowskiprion sp.
2.1牙形刺
牙形刺(conodonts)是一类已经灭绝的牙形动物的骨骼,存在于寒武纪到三叠纪的海相地层中(Briggs et al.,1983),其主要化学成分是磷酸钙。牙形刺是解决井下碳酸盐地层的划分和对比的一种极好的手段(郝诒纯和茅绍智,1993)。
FIB-SEM通过离子束的连续切割和电子束的成像,展示了该牙形刺化石的内部结构(图2)。图2B显示牙形刺化石切割面厚度约为8~16 μm,切面及固着的铜片上有平行于聚焦离子束的纵纹,为聚焦离子束切割产生。位于前缘脊上的切割面显示为较致密层结构(图2C),下方亮色边缘为聚焦离子束激起的金粉重新沉淀造成。切面上发育有大量纳米级孔隙(图2D),这些孔隙以两端开口的圆筒孔及椭球体孔为主,多呈开放至半开放形态;位于化石不同部位的孔开放程度和粒径较均一;50~100 nm的孔占较大百分比的孔隙总体积;200~350 nm的孔则提供了主要的孔隙体积。
2.2几丁石化石
几丁石(chitinozoans)是早古生代海洋沉积中的一类具有有机质壳壁的海洋微体化石。这类微体化石虽然在地层识别中被广泛运用了几十年,但是其亲缘关系仍然未定。有学者认为它们可能和某种未知的后生动物的卵相关(Paris and Nõlvak,1999)。Jacobs等(2007)对孤立的几丁石的壳壁化学结构进行了研究,显示几丁石壁化学成分主要是一种由富氮、氧化合物,低脂类的芳族基团所组成的干酪根,未发现与几丁质相关的物质。几丁石是划分、对比奥陶系—泥盆系的一类重要的标准化石。
位于几丁石口孔附近的切面显示,几丁石壁较为致密,仅在切面接近下表面边缘的位置存在一宽约35 μm,延伸约半个样品宽度,近乎平行于样品边缘的孔隙。该孔隙局部放大之后,可见其内部有一定纵深(图3A,A1),且上下边界之外分布有一些小于100 nm的小孔。沿几丁石中央腔表面裂缝切割后的几丁石壁可观察到壁厚约2 μm(图3B),图3B1显示该几丁石壁具有双层结构,外层表现为灰度值相对高的亮色的结构,内层表现为灰度值相对低暗色结构。外层组成亮色结构的物质密度相对较大为较致密层结构(插图3B1中虚线以上a颜色较浅处),内层暗色物质的密度相对较低,比较疏松(插图3B1中虚线以下b颜色较深处)。这一差异显示,组成几丁石壳壁的物质,可能具有化学成分和堆积紧密程度的差异。在内外两层结构的相接处可见沿界线分布的一串纳米级孔隙(图3B 中C)。

图2 JY1井龙马溪组牙形刺Fig.2 Conodontfrom the Lungmachi Formation,JY-1 well
2.3疑源类化石
疑源类(acritarchs)是一类起源未知的或不确定的异源或多源的有机壁微体化石集合体(Evitt,1963)。
挑选的疑源类化石经过FIB-SEM离子束的连续切割,在SEM下观察到壁厚约1~4 μm,膜壳壁的切面为结构较为均一的单层粗纤维壁,纤维无规则排列,相互连通形成均匀的层,内发育大量亚微米—纳米级孔隙,这些孔隙大小约在0.2~0.5 μm之间,以亚球体孔为主,多呈开放至半开放形态,彼此相互连通直到膜壳表面(图3C,C1)。
2.4虫颚化石
虫颚(scolecodonts),又名虫牙,是一种微体化石,是环节动物门中海生多毛纲口中成对的角质颚器,是用来咀嚼食物的器官(高联达,1989)。探针分析表明,其薄外壁层则为高碳,低钙,并含有硫(Colbath and Larson,1980)。
FIB-SEM离子束对该虫颚化石的连续切割面位于尖齿根部,横穿髓腔。髓腔内有疏松矿物充填(插图3D,D1)。在SEM下观察到齿部壁厚约1~2 μm,齿部隐约可见双层结构,外层表现为灰度值相对高的亮色的结构,内层表现为灰度值相对低暗色结构。内部未见微孔隙发育。
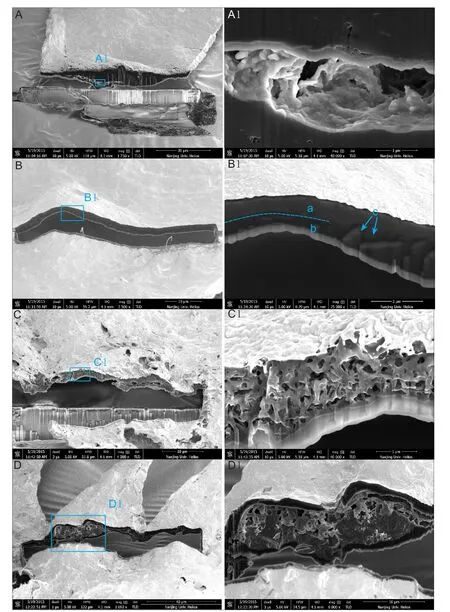
图3 JYI井龙马溪组微体化石Fig.3 Microfossils from Lungmachi Formation,JY-1 well
3 结论
(1)运用聚焦离子束扫描电镜对上扬子区龙马溪组页岩内的微体化石进行了外壁(膜)结构和微孔隙的研究,除了在纳米级分辨率下直观的展示了各化石的壁结构,本研究还显示,牙形刺、几丁石、疑源类均发育有微孔隙结构,大量的亚微米—纳米级孔隙呈开放至半开放形态存在,彼此相互连通直到化石表面。虫颚化石齿部未见孔隙结构。
(2)上扬子龙马溪组页岩微体化石内存在大量的亚微米—纳米孔隙。但不同的微体化石纳米孔隙发育程度仍存在一定差异,这为有机质孔隙分布的非均质性成因研究提供了重要依据。
致谢:感谢南京大学物理学院介电超晶格国家重点实验室王前进工程师在聚焦离子束扫描电镜实验中给予的巨大帮助。
参考文献(References):
陈尚斌,朱炎铭,王红岩,等.2012.川南龙马溪组页岩气储层纳米孔隙结构特征及其成藏意义[J].煤炭学报,37(3): 438-444.
陈文玲,周文,罗平,等.2013.四川盆地长芯1井下志留统龙马溪组页岩气储层特征研究[J].岩石学报,29(3): 1073-1086.
高联达.1989.虫颚化石浅谈[J].化石,(1): 22-23.
郭彤楼,刘若冰.2013.复杂构造区高演化程度海相页岩气勘探突破的启示——以四川盆地东部盆缘JY1井为例[J].天然气地球科学,24 (4): 643-651.
郭彤楼,张汉荣.2014.四川盆地焦石坝页岩气田形成与富集高产模式[J].石油勘探与开发,41(1): 28-36.
郝诒纯,茅绍智.1993.微体古生物学教程[M].武汉:中国地质大学出版社:1-351.
焦堃.2015.煤和泥页岩纳米孔隙的成因、演化机制与定量表征[D].南京:南京大学.
马勇,钟宁宁,黄小艳,等.2014.聚集离子束扫描电镜(FIB-SEM)在页岩纳米级孔隙结构研究中的应用[J].电子显微学报,33(3): 251-256.
王春朝,茅永强.2006.透射电子显微镜(TEM)在孢粉学研究中的应用[J].古生物学报,45(3): 425-429.
殷宗军,黎刚,朱茂炎.2014.两种微体化石三维无损成像技术的对比[J].微体古生物学报,31(4): 440-452.
Al-Ameri T K.2010.Palynostratigraphy and the assessment of gas and oil generation and accumulations in the Lower Paleozoic,Western Iraq [J].Arabian Journal of Geosciences,3(2): 155-179.
Briggs D E G,Clarkson E N K and Aldridge R J.1983.The conodontanimal [J].Lethaia 16 (1): 1-14.
Chalmers G R L and Bustin R M.2008.Lower cretaceous gas shales in northeastern britishcolumbia [J].Bulletin of Canadian Petroleum Geology,56(1): 1-21.
Colbath G K and Larson S K.1980.On the chemical composition of fossil polychaete jaws [J].Journal of Paleontology,485-488.
Curtis M E,Cardott B J,Sondergeld C H,et al.2012.Development of organic porosity in the woodford shale with increasing thermal maturity [J].International Journal of Coal Geology,103(23): 26-31.
Evitt WR.1963.Adiscussion and proposals concerning fossil dinoflagellates,hystrichospheres and acritarchs [J].I.Proc.Nat.Acad.Sci.49: 158-164.
Jacob J,Paris F,Monod O,et al.2007.New insights into the chemical composition of chitinozoans [J].Organic Geochemistry,38(10): 1782-1788.
Loucks R G,Reed R M,Ruppel S C,et al.2009.Morphology,genesis,and distribution of nanometer-scale pores in siliceous mudstones of the mississippianbarnett shale [J].Journal of Sedimentary Research,79 (11-12): 848-861.
Lu X C,Li F C and Watson A T.1995.Adsorption measurements in devonianshales [J].Fuel,74(4):599-603.
Paris F.1981.Les Chitinozoairesdans le Paléozoïque de sud-ouest de l'Europe: cadre géologique,étudesystématique,biostratigraphie [J].Mémoires de la Sociétégéologique et minéralogiquede Bretagne,26: 1-412.
Paris F and Nõlvak J.1999.Biological interpretationand paleobiodiversity of a cryptic fossil group: The“chitinozoan animal”[J].Geobios,32(2): 315-324.
Petersen H I.2013.Reflectance measurements of zooclasts and solid bitumen in Lower Paleozoic shales,southern Scandinavia: Correlation to vitrinite reflectance [J].International Journal of Coal Geology,114: 1-18.
Ross D J K and Bustin R M.2006.Sediment geochemistry of the lower jurassicgordondale member,northeastern British Columbia [J].Bulletin of Canadian Petroleum Geology,54(4): 337-365.
Suchy V.2002.Dispersed organic matter from silurianshales of the barrandian basin,czech republic: optical properties,chemical composition and thermal maturity [J].International Journal of Coal Geology,53(2): 1-25.
Tang P,Paris F,Geng,et al.2007.Chitinozoan biostratigraphy across the base of Darriwilian Stage from the type area in Eastern China [J].Review of Palaeobotany and Palynology,146: 74-101.
AStudyintothe Microscopic Pore Structureof Microfossils with Focused Ion Beam Scanning Electron Microscopy(FIB-SEM)
XU Chang1,WANG Wenhui1,2*,YAO Suping1
1.School of Earth Sciences and Engineering,Nanjing University,Nanjing 210023,China; 2.Key Laboratory of Economic Stratigraphy and Palaeogeography,Nanjing Institute of Geology and Palaeontology,Chinese Academy of Sciences,Nanjing 210008,China
Abstract:Focused ion beam scanning electron microscopy(FIB-SEM) is a dual beam system which combines focused ion beam (FIB) and scanning electron microscopy (SEM) to cut samples and display real-time images at nanometer scale.This study observed several kinds of microfossils from the Lungmachi Formation (Llandovery,Silurian) with FIB-SEM.The results reveal that submicron-nano pores,which provide valid space for shale gas reservoirs,are well-developed in conodonts,chitinozoans and acritarchs.Disparities of micro-pores in different fossil groups shown in this study will help to explain the cause of organic pore heterogeneity in shales.
Keywords:Focusedionbeamscanningelectronmicroscopy;Llandovery,the Lungmachi Formation;microfossils;Nanometer-Scale Pores
Corresponding author:WANG Wenhui,research-assistant; E-mail: wwhever@126.com
*通讯作者:王文卉,女,1986年生,助理研究员,主要从事生物地层学方向的研究;E-mail: wwhever@126.com
作者简介:胥畅,男,1992年生,硕士研究生,研究方向:油气地球化学;E-mail: 383563064@qq.com
基金项目:江苏省科技支撑计划项目(BE2013115);国家自然科学基金(41402010;41372017;41372127);江苏省青年基金项目(BK20140602)联合资助
收稿日期:2015-11-30;修回日期:2016-01-13
DOI:10.16108/j.issn1006-7493.2015230
中图分类号:Q915.4
文献标识码:A
文章编号:1006-7493(2016)01-0207-06
