广藿香叶片总蛋白双向电泳体系的建立
2016-05-03何丽平吴友根张军锋胡新文
何丽平+吴友根+张军锋+胡新文

摘要: 比较2种方法提取广藿香叶片总蛋白质的得率与聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白条带,同时对广藿香叶片总蛋白质双向电泳条件进行了优化,利用MALDI-TOF-TOF和Swiss-Prot软件对部分蛋白点进行质谱鉴定。结果表明:使用TCA/丙酮法提取广藿香叶片总蛋白,在10万Vhs聚焦强度下,可获得高分辨率双向电泳图谱,BPP酚抽法获得的蛋白不适用于双向电泳分析;经质谱成功鉴定了9个蛋白点,鉴定成功率90%。
关键词: 广藿香;叶片;双向电泳;蛋白质提取
中图分类号: S567.23+9.01 文献标志码: A 文章编号:1002-1302(2016)03-0306-04
广藿香[Pogostemon cablin (Blanco) Benth.]为唇形科刺蕊草属植物,是我国常用中药,具有芳香化浊、开胃止呕、发表解暑等功效[1],是著名国家中药保护品种藿香正气丸(胶囊、水)和抗病毒口服液的重要原料,也是其他30多种中成药的主要原料[2]。但是广藿香连作障碍现象十分突出,造成产量和品质明显下降,每茬收获后必须间种其他农作物后方可再种,严重影响了广藿香规范化生产与种植、药农种植积极性和区域经济发展,从而难以保障广藿香药材的质量及其标准化、现代化的实施。据报道,广藿香连作障碍的原因可归结为根系分泌物质的自毒作用[3]和根际微生物群落多样性变化[4],但无论何种机制,连作障碍现象都最终在广藿香植株上表现出来。近年来,随着现代系统生物学的快速发展,差异蛋白质组学技术逐渐成为研究连作障碍机理的有力工具,其中蛋白质双向电泳(2-DE)图谱的建立是进行蛋白质组学分析的前提和基础,而蛋白样品的制备则是双向电泳技术的核心与关键。本研究比较不同的广藿香叶片总蛋白提取与分离方法,旨在为广藿香叶片差异蛋白质组学分析奠定基础,进而为揭示广藿香连作障碍机制提供理论依据。
1 材料与方法
1.1 材料
广藿香植物材料于2014年4月种植于海南大学园艺园林学院广藿香种质资源圃。当年11月采集植株叶片,液氮速冻保存,用于总蛋白质提取。
1.2 试剂
三氯乙酸(TCA)、尿素(urea)、硫脲(thiourea)、3-[(3-胆酰胺丙基)-二乙胺]-丙硫酸(CHAPS)、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、硫酸铵、考马斯亮蓝G-250,购自美国Sigma公司。24 cm IPG胶条(pH值4~7)和琼脂糖,购自瑞典GE Healthcare公司。丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、交联聚乙烯吡咯烷酮(PVPP),购自美国Bio-Rad Labs公司。其他药品均为国产分析纯,购自北京化工厂。
1.3 方法
1.3.1 蛋白质样品的制备 分别称取广藿香叶片2份,每份1 g,分别放于预冷研钵中,加入适量PVPP,用液氮研磨至粉末,装入离心管,-80 ℃冰箱中保存待用。广藿香叶片总蛋白提取流程按照TCA/丙酮法、BPP(四硼酸钠/交联聚乙烯吡咯烷酮/苯酚Borax/PVPP/Phenol)酚抽法进行。
1.3.1.1 TCA/丙酮法 参照Wang等提取顽拗植物组织蛋白的方法[5],并略有改动。将1 g材料粉末加入10 mL预冷的含10%TCA、0.07%巯基乙醇的丙酮中,充分混匀后,-20 ℃沉淀过夜,4 ℃、15 000 g离心30 min,弃上清液。加入10 mL 预冷的含0.07 %巯基乙醇的丙酮,混匀后-20 ℃放置1 h,4 ℃、15 000 g离心30 min,弃上清液。以上步骤重复2次。将沉淀用甲醇洗涤2次,丙酮洗涤2次,室温干燥后溶解于蛋白裂解液(7 mol/L尿素,2 mol/L硫脲,2%CHAPS,13 mmol/L DTT)中,-20 ℃保存备用。
1.3.1.2 BPP酚抽法 采用BPP法[6]提取蛋白质。1 g材料粉末中加入5 mL BPP蛋白提取液[100 mmol/L EDTA,10 mmol/L Tris,50 mmol/L硼砂,50 mmol/L维生素C,1%PVPP(W ∶ V),1%Triton-100(V ∶ V),2% 2-巯基乙醇(V ∶ V)、30%蔗糖(W ∶ V),pH值 8.0]。在室温下涡旋混匀10 min,再加入等体积的Tris饱和酚(pH值>7.8)。室温涡旋10 min,4 ℃、15 000 g离心 15 min。转移上层酚相至另一个新离心管,加入等体积蛋白提取液,室温涡旋5 min,4 ℃、15 000 g离心15 min。吸取上层清液转入另一个新离心管,并加入5倍体积冰冷的过饱和硫酸铵甲醇溶液,混匀后在-20 ℃沉淀6 h以上。4 ℃、15 000 g离心15 min,去除上清液,收集沉淀。将沉淀用甲醇洗涤2次,丙酮洗涤2次,室温干燥后溶解于蛋白裂解液(7 mol/L 尿素,2 mol/L硫脲,2%CHAPS,13 mmol/L DTT)中,-20 ℃ 保存备用。
1.3.2 蛋白定量 蛋白质定量主要参考Bradford的方法[7],在紫外分光光度计上进行蛋白浓度测定,用牛血清蛋白(BSA)作为标准蛋白,绘制标准曲线,测定样品在波长 595 nm处的吸光度,每个样品至少重复3次,计算样品蛋白浓度。
1.3.3 聚丙烯酰胺凝胶(SDS-PAGE)电泳
1.3.3.1 一维凝胶电泳(1-DE) 1-DE主要采用不连续胶SDS-PAGE法[8],用4%浓缩胶和12.5%分离胶进行电泳分离,蛋白梯度上样分别为10、20、30 μg,电泳参数设置为 5 W/gel 50 min,7 W/gel 2 h。
1.3.3.2 二维凝胶电泳(2-DE) 第1向等电点聚焦在Ettan IPGphorⅡ等电聚焦仪(GE Healthcare)上完成。使用24 cm的pH值4~7线性IPG(GE Healthcare)干胶条,每根胶条上样量为1 300 mg蛋白,上样体积455 μL,常温水化18 h,每根胶条上覆盖5 mL矿物油防止样品挥发。采用2种聚焦程序,设定为:250 V,3 h;500 V,2 h;1 kV,1 h;8 kV,3 h;8 kV下进行10万 Volt hour(Vhs)和11万 Vhs聚焦,每根胶条限流50 μA。第2向电泳前进行胶条平衡,将聚焦好的胶条放入平衡缓冲液(50 mmol/L Tris-HCl,pH 值8.8,6 mol/L尿素,30%甘油,2%SDS,0.02%溴酚蓝)中平衡,先后浸泡在1%DTT的胶条平衡液和含4%碘乙酰胺的胶条平衡液中,各15 min。平衡结束后,转移胶条垂直放于12.5%聚丙烯酰胺凝胶的上端,用含有适量溴酚蓝的1%琼脂糖封住胶条,保证胶条与凝胶充分接触,在Ettan Daltsix电泳仪(GE Healthcare)中进行电泳,电泳参数设置为5W/gel 1 h,7 W/gel 3.5 h。
1.3.4 凝胶染色及图像采集分析 凝胶染色主要采用考马斯亮蓝(G-250)染色液进行染色[9]。脱色干净的凝胶采用Image ScannerⅢ扫描仪(GE Healthcare)进行扫描,扫描设置为灰阶256,投射扫描,分辨率为300 dpi,图像以TIF格式保存,用ImageMaster 2D Platinum软件(Amersham Bioscience)进行图像分析。
1.3.5 蛋白质质谱鉴定 挖取感兴趣的蛋白点,使用简化胶内酶解法进行酶解[10]。酶解得到的肽段混合物质谱鉴定(MALDI-TOF MS)采用AB SCIEX公司的基质辅助激光解析电离飞行时间质谱仪(5800 MALDI-TOFMS/MS)。将获得的胰蛋白酶解肽段信息通过Mascot引擎搜索NCBI中的绿色植物数据库,获得蛋白鉴定信息。
2 结果与分析
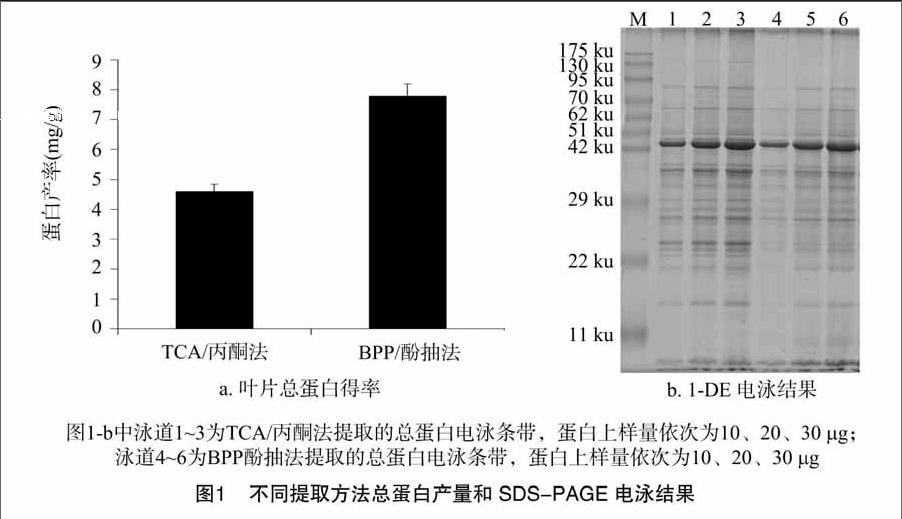
2.1 不同提取方法获得的总蛋白量及SDS-PAGE电泳单向条带比较
由图1-a可知,采用TCA/丙酮法可从1 g广藿香叶片材料中提取4.61 mg蛋白,采用BPP酚抽法可以得到7.79 mg蛋白。利用2种方法提取所得的广藿香叶片总蛋白SDA-PAGE电泳条带见图1-b。结果表明,采用梯度上样量10、20、30 μg蛋白质样品进行SDS-PAGE电泳后,TCA/丙酮法与BPP酚抽法提取的蛋白质条带数量差别不大,但在条带清晰度上有较大差异。TCA/丙酮法所得蛋白产量低于BPP酚抽法所得蛋白产量,但是其电泳条带清晰;而BPP酚抽法在30~42 ku 处以及52~75 ku处条带较为模糊。说明BPP酚抽法所提取的蛋白质纯度不够,含有干扰物质等杂质,可直接影响其蛋白定量和SDS-PAGE电泳过程。
2.2 广藿香叶片蛋白的2-DE分析
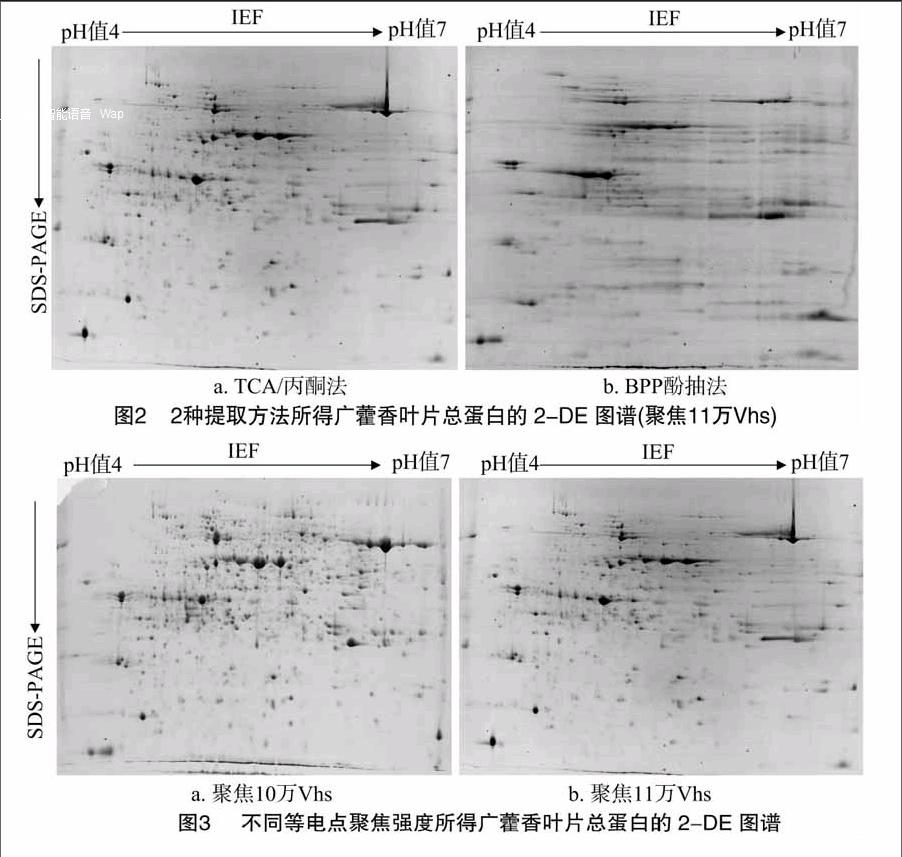
如图2所示,利用BPP酚抽法得到的样品蛋白2-DE图谱中蛋白点数量较少(183个),形状不圆滑,横条纹、纵条纹也较多,说明该方法得到的样品中确实有大量干扰物质存在,与SDS-PAGE电泳蛋白条带反映的结果一致。所以,尽管通过BPP酚抽法得到的样品蛋白量较多,但因其质量无法满足双向电泳的要求,不能用于广藿香叶片蛋白质组学分析。TCA/丙酮法得到的2-DE图谱中蛋白点数量较多(579个),形状多数圆滑,尤其集中在pH值5~6范围内。TCA/丙酮法所得图谱分辨率比BPP酚抽法好,可见TCA/丙酮提取法可减少广藿香叶片总蛋白质在提取过程中的蛋白质损失,有效去除广藿香叶片中次生代谢物质等杂质,表现为所获得电泳图谱中蛋白质点数量多,蛋白点清晰,无拖尾现象。
对TCA/丙酮法所得总蛋白进行不同聚焦强度比较,由图3可以看出,聚焦10万Vhs条件下,中高分子量处蛋白点的聚焦情况有明显改善,蛋白点的分离效果相对较好,蛋白点数明显多于聚焦11万Vhs,这可能与聚焦过度引起部分蛋白点丢失有关。
2.3 质谱鉴定与功能分析
对利用TCA/丙酮法获得的10个高分辨率蛋白点(图4)进行质谱鉴定,其中9个蛋白点被成功鉴定(蛋白得分>49),鉴定成功率90%(表1),表明该方法所得蛋白点具有良好的质谱兼容性。蛋白点1为热激蛋白70,是热激蛋白家族的一员,在细胞内主要参与新生肽的折叠与成熟、损伤蛋白的降解和蛋白运输。蛋白点3为预测蛋白——谷胱甘肽 S-转移酶 L3状 X1异构亚型,是谷胱甘肽代谢的膜相关蛋白,在植物的初级代谢和二级代谢、胁迫耐受和细胞信号转导中行使功能,从而影响植物生长发育。蛋白点5为预测蛋白——二氢硫辛酸脱氢酶,它以FAD为辅基,是参与丙酮酸形成乙酰-CoA以及α -酮戊二酸脱氢形成琥珀酰-CoA过程中多酶体系的一种酶。蛋白点10为光合系统Ⅰ反应中心第4单元叶绿体蛋白,其功能是稳定PsaC与光合反应中心之间的相互作用,协助铁氧还原蛋白与光合系统的对接,与铁氧还原蛋白——NADP还原酶互作。
3 结论与讨论
样品制备是蛋白质组学研究的重要因素,样品质量好坏直接决定电泳图谱进行软件分析的结果。最优的样品制备方法应该能有效除去影响蛋白质可溶性和电泳分离结果的各种杂质,防止蛋白变性,保持其活性,减少蛋白质的降解、磷酸化和甲基化修饰,并有高的分辨率和良好的重复性。
然而广藿香叶片组织中含有大量挥发油、黄酮类、倍半萜类、萜类、蒽醌类等次生代谢物[11-13],这些不利因素将直接导致难以获得无污染、无修饰、完整、高质量的植物细胞蛋白质,严重影响蛋白质的提取效果、等电聚焦及双向电泳图谱的分辨率。TCA/丙酮法、BPP酚抽法是2种常用的蛋白质提取方蛋白点7经质谱鉴定,未鉴定成功(蛋白得分小于49分)。匹配肽段数括号内数值代表总匹配肽段数中可信值大于95%的肽段数。
法。TCA/丙酮法可有效沉淀蛋白[14],能够抑制蛋白酶活性,消除蛋白质水解作用和其他蛋白酶的修饰作用,有效降低蛋白样品中盐、糖、脂类、核酸等杂质对试验的干预[15]。BPP酚抽提法虽然被广泛应用于植物组织蛋白质提取,但对于广藿香叶片材料并不适用。在影响等电聚焦的因素中,等电聚焦强度对获得理想的2-DE图谱至关重要[16]。不同植物甚至同一植物不同组织的蛋白样品分离所需的等电聚焦强度不同,同一样品不同胶条长度所需的等电聚焦强度也有差别。本研究使用的胶条长24 cm,承载的蛋白量多,聚焦充分,蛋白点分离效果好,便于进行蛋白质组学的研究。比较不同聚焦强度下的广藿香叶片蛋白的2-DE图谱后,发现在10万Vhs聚焦强度下,蛋白点最多,可达613个蛋白点,且分离效果好。从2-DE凝胶选取的10个蛋白点中鉴定出9个蛋白点,这些蛋白质参与光合反应、代谢及能量代谢,表明使用TCA/丙酮法提取广藿香叶片总蛋白,聚焦强度为10万Vhs时,不仅能得到理想的2-DE图谱,而且分离的蛋白点具有良好的质谱兼容性。本研究为广藿香叶片蛋白质组学研究奠定了坚实基础,也为其他中药材的叶片总蛋白提取提供了依据。
参考文献:
[1]国家药典委员会.中华人民共和国药典[M]. 北京:化学工业出版社,2009.
[2]吴友根,郭巧生,郑焕强. 广藿香本草及引种历史考证的研究[J]. 中国中药杂志,2007,32(20):2114-2117,2181.
[3]李玲梅,李 明. 广藿香根系分泌物的化感自毒作用研究[J]. 湖北农业科学,2011,50(24):5168-5171.
[4]吴友根,郭巧生,郑焕强. 广藿香种植土壤和药材中有机氯农药及重金属残留分析[J]. 中国中药杂志,2008,33(13):1528-1532.
[5]Wang W,Scali M,Vignani R,et al. Protein extraction for two-dimensional electrophoresis from olive leaf,a plant tissue containing high levels of interfering compounds[J]. Electrophoresis,2003,24(14):2369-2375.
[6]Saravanan R S,Rose J K. A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J]. Proteomics,2004,4(9):2522-2532.
[7]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[8]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680-685.
[9]Wang X C,Wang D Y,Wang D,et al. Systematic comparison of technical details in CBB methods and development of a sensitive GAP stain for comparative proteomic analysis[J]. Electrophoresis,2012,33(2):296-306.
[10]王旭初,范鹏祥,李银心. 一种适用于质谱分析的简化胶内酶解方法[J]. 植物生理与分子生物学学报,2007,33(5):449-455.
[11]Wu Y G,Guo Q S,He J C,et al. Genetic diversity analysis among and within populations of Pogostemon cablin from China with ISSR and SRAP markers[J]. Biochemical Systematics and Ecology,2010,38(1):63-72.
[12]Wu Y G,Li C G,Li X C,et al. Comparison of the essential oil compositions between pogostemon cablin and agatache rugosa used as herbs[J]. Journal of Essential Oil Bearing Plants,2013,16(6):705-713.
[13]Wu L H,Wu Y G,Guo Q S,et al. Comparison of genetic diversity in Pogostemon cablin from China revealed by RAPD,morphological and chemical analyses[J]. Journal of Medicinal Plants Research,2011,5(18):4549-4559.
[14]Damerval C,De Vienne D,Zivy M,et al. Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J]. Electrophoresis,1986,7(7):52-54.
[15]Tsugita A,Kamo M. 2-D electrophoresis of plant proteins[J]. Meth Mol Biol,1999,112:95-97.
[16]王凤茹. 双向电泳应该注意的几个关键问题[J]. 生物技术通报,2005(6):62-64.
