棉花角斑病菌遗传驯化体系的建立
2016-05-03王清梁鹏李响刘文波林春花郑服丛
王清+梁鹏+李响+刘文波+林春花+郑服丛+缪卫国


摘要: Xanthmonas citri subsp. malvacearum (Xcm)是棉花角斑病的病原,由于缺乏适合的遗传驯化体系,难于对其特定的基因进行研究,所以建立高效的基因缺失突变系统,是迫切需要解决的问题。采用去甲基化氮胞苷(5-AZA)驯化野生菌株Xcm 8号小种菌株V8和V8无细胞胞外物(CFEs)驯化重组质粒pK18mobsacB::N1012及pK18mobsacB::m762这2种驯化方法,以来自V8的hpaXmN和hpaXm为靶基因验证其有效性。结果表明,成功获得了△hpaXmN和△hpaXm突变体;虽然2种驯化方式都能获得转化子,但驯化菌株的电转化效率是驯化质粒的10~100倍。遗传驯化体系的建立消除了Xcm V8由于限制修饰系统引起的转化障碍,实现了特定基因的定点突变,为后续获得Xcm V8其他基因缺失突变体奠定了基础。
关键词: 棉花角斑病菌Xcm V8;遗传体系;驯化;定点突变
中图分类号: S435.621.2+5 文献标志码: A 文章编号:1002-1302(2016)03-0153-05
黄单胞菌属(Xanthomonas)是植物病原菌中较大的类群[1],随着细菌基因组学的发展,几种主要致病菌[2-3]在 NCBI 里已经得到测序,包括34种Xanthomonas campestris、1种Xanthomonas oryzae、1种Xanthomonas axonopodis。这使得T3SS效应分子[4]、相关效应蛋白[5-6]及hrp基因功能[7]等的研究更加深入。
电转化技术是自1982年发展起来的,虽然广泛应用于细菌遗传转化的研究,但目前向原核细胞导入外源DNA仍很困难[8]。研究证实,以革兰氏阴性细菌为代表的Haemophilus parasuis SH0165共有33个限制内切酶和甲基转移酶基因,限制酶通常和它相伴的修饰酶组合成限制修饰系统,Jansen等于1995年发现限制修饰系统是导致不同菌株转化效率差异的重要因素[9]。R-M系统由Hha 1 endonuclease和Hha 1 methylase基因构成,有报道认为其能抑制细菌基因组外来的DNA交换引起的变化,降解异源DNA,进而保护细菌[10]。
目前,对存在限制性修饰系统的细菌驯化方法主要有:(1)去甲基化氮胞苷(5-AZA)驯化野生菌株,得到R-M系统突变菌用于遗传转化[10];(2)采用CFEs体外甲基化后的质粒转化Haemophilus parasuis,转化效率由0提高到100~1 000 CFU/μg DNA[9];(3)通过基因敲除构建运动发酵单胞菌的限制修饰系统突变菌以提高电转效率 [11] 。目前,已经用5-AZA成功驯化的R-M系统突变的黄单胞菌水稻白叶枯病菌有国际通用的PXO99A和中国水稻白叶枯病菌的KS6-6A、OS198A和YN2A[10]。
油菜黄单胞菌锦葵致病变种Xanthmonas citri subsp. malvacearum(Xcm) 是棉花角斑病的致病菌,该病在全世界棉花种植区都会发生,但研究大多集中在棉花角斑病的危害、发病条件及致病小种分化等[12-13]。本研究分别采用驯化方法1和2,以Xcm 的8号小种 V8(简称V8)的hpaXmN和hpaXm基因为例[14],成功获得△hpaXmN和△hpaXm突变菌,实现特定基因的定点突变,为后续获得Xcm其他基因缺失突变体奠定了基础。
1 材料与方法
1.1 菌株和试剂
大肠杆菌感受态DH5α,购自全式金公司;棉花角斑病菌Xanthmonas citri subsp. malvacearum(Xcm)V8菌株(8号小种),由笔者所在实验室从棉花上分离;质粒pK18mobsacB,南京农业大学董汉松教授惠赠。
卡那霉素(Km,50 mg/mL)、去甲基化氮胞苷(5-AZA)、Tris-base、乙酸钾、二硫苏糖醇、Na2EDTA、冰乙酸、S-腺苷甲硫氨酸溶液(SAM)、异丙醇、苯酚、氯仿等(solarbio);核酸内切酶BamHⅠ、XbaⅠ、T4 DNA Ligase酶、Primer STAR GXL聚合酶(TaKaRa);质粒提取试剂盒(南京捷贝斯)、胶回收试剂盒购、纯化试剂盒(TaKaRa)、细菌基因组DNA提取试剂盒(天根)。
1.2 主要溶液的配制
参照吴东方的方法[9]配制。
1.3 重组质粒pK18mobsacB::N1012和pK18mobsacB::m762的驯化
1.3.1 重组质粒的构建 以V8菌株基因组DNA为模板,利用引物hpaXmN-U-F/hpaXmN-U-R,hpaXmN-D-F/hpaXmN-D-R分别PCR获得hpaXmN-L 503 bp和hpaXmN-R 525 bp的片段(表1)。再利用hpaXmN-U-F和hpaXmN-D-R将上述2个片段通过overlap PCR[15]融合成1 020 bp的片段。接着对融合片段 BamHⅠ和 XbaⅠ 双酶切获得1 012 bp的片段,经T4 DNA Ligase连在经相同酶切的pK18mobsacB上,得重组质粒pK18mobsacB::N1012。同理引物hpaXm-U-F/hpaXm-U-R,hpaXm-D-F/hpaXm-D-R 分别PCR得hpaXm-L 305 bp和hpaXm-R 473 bp的片段,经上述操作,得重组质粒pK18mobsacB::m762。所用酶切、连接等方法参照文献[16]。
1.3.2 重组质粒的驯化 提取V8菌株的CFEs和CFEs体外甲基化质粒的反应体系参照吴东方的方法[9]。
1.4 V8菌株的驯化
挑取活化的V8菌株单菌落接种于浓度为0.1 μmol/L的去甲基化氮胞苷(azacytidine,5-AZA) NA平板,长出单菌落后,挑取单克隆接种于1 μmol/L 5-AZA的NA平板继续筛选,直至得到适合做遗传转化且抗150 μmol/L 5-AZA的V8菌株[10]。
1.5 △hpaXmN和△hpaXm突变体的获得
通过电转化(1.8 kV,4 ms,BioRad),将“1.3”节获得的质粒导入V8菌株感受态细胞中[10],在NA+Km平板上,28 ℃ 培养3~5 d,筛选抗性菌落,用于后续验证。
2 结果与分析
2.1 重组质粒驯化成功
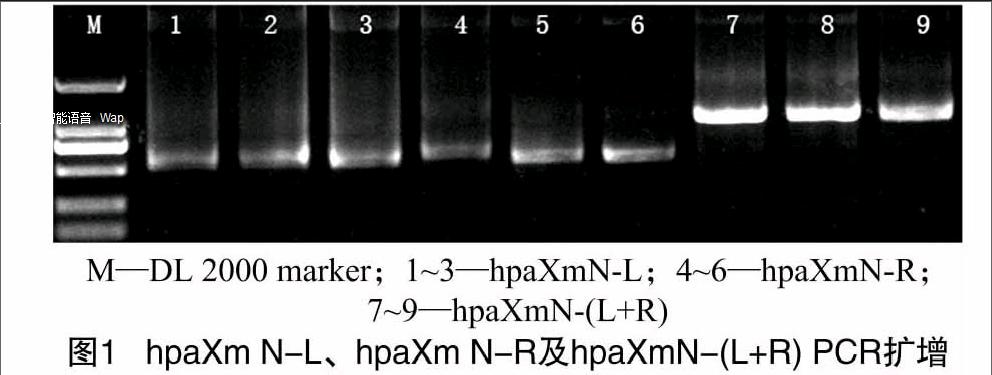
2.1.1 重组质粒构建成功 hpaXmN-U-F/hpaXmN-U-R和hpaXmN-D-F/hpaXmN-D-R通过PCR得 hpaXmN-L(图1泳道1~3)和hpaXmN-R(图1泳道4~6),利用引物hpaXmN-U-F/hpaXmN-D-R通过overlap PCR,融合成hpaXmN-(L+R) 1 028 bp的片段(图1泳道7~9)。hpaXm-U-F/hpaXm-U-R和hpaXm-D-F/hpaXm-D-R通过PCR扩增hpaXm-L(图2泳道1)和hpaXm-R(图2泳道3),利用hpaXm-U-F/hpaXm-D-R,同上处理得hpaXm-(L+R)778 bp的片段(图2泳道2)。
将 hpaXmN-(L+R)和pK18mobsacB经 BamHⅠ和XbaⅠ 双酶切后连接,将重组质粒pK18mobsacB::N1012转化DH5α,挑取阳性克隆PCR验证,1、3、4质粒扩增出1 028 bp片段(图3-A);提取1、3、4质粒酶切, 均酶切出1 012 bp的片段(图4-A),测序比对与hpaXmN-(L+R)序列一致,说明pK18mobsacB::N1012构建成功。同理将pK18mobsacB::m762 的单克隆1、2、3、5扩增出778 bp片段(图3-B);提取这4个单克隆质粒酶切,1、2质粒酶切出762 bp的片段(图4-B),测序比对后与hpaXm-(L+R)序列一致,说明pK18mobsacB::m762构建成功。
2.1.2 重组质粒驯化成功 将未经CFEs驯化的重组质粒电转菌株V8得不到转化子(图5-A),用CFEs驯化pK18mobsacB::N1012和pK18mobsacB::m762 后分别电转菌株V8均能得到转化子(图5-B、图5-C)。
2.2 菌株V8驯化成功
将重组质粒电转未经5-AZA驯化的菌株V8得不到转化子(图6-A),将pK18mobsacB::N1012和pK18mobsacB::m762分别电转经过5-AZA驯化的菌株V8也都能得到转化子(图6-B、图6-C)。
2.3 △hpaXmN和△hpaXm突变体验证成功
经同源重组得到的转化子依次在Km和10%蔗糖平板上完成2次同源单交换,故进行分单交换子和双交换子的验证。
2.3.1 突变体单交换子验证 引物hpaXmN-U-F/hpaXmN-D-R验证△hpaXmN,但缺失片段长仅45 bp,通过PCR无法判断该片段是否缺失(图7)。hpaXm-U-F/hpaXm-D-R验证△hpaXm,通过PCR可知单交换子1、8、11发生单交换(图8-A);引物hpaXmF/R验证△hpaXm时,3、8、11质粒能扩增出长为402 bp的片段(图8-B),确定8、11质粒发生单交换。
2.3.2 转化子双交换验证 通过hpaXmN-U-F/hpaXmN-D-R对双交换子基因组DNA进行PCR扩增无法辨别是否突变(图9),故挑取双交换子3~9送测。因为hpaXm基因组数据未知,但1.3已扩增出495 bp的hpaXmN-L和 465 bp 的hpaXm-R,与已知序列长度402 bp的hpaXm,组成长度1 362 bp的片段,hpaXmN位于其中496~540号碱基,测序结果该序列缺失(图10),即获得△hpaXmN突变体。
利用引物hpaXm-U-F/hpaXm-D-R验证△hpaXm,显示双交换子4~9能扩增出762 bp的条带,与阳性对照2相比,说明4~9的基因缺失了1段(图11-A)。hpaXmF/R验证△hpaXm时,4~9无法扩增出长度402 bp的hpaXm基因(图11-B),即获得△hpaXm突变体。
3 讨论
基因敲除载体pK18mobsacB是Sehgfer等 1994 年在pK18基础上导入蔗糖果聚糖酶反向筛选基因sacB改造而成的[17]。该质粒转化进入宿主细胞后,由于其携带的突变基因与宿主菌基因组上的基因同源,经2次同源单交换,即可获得不含有任何抗性标记基因的突变菌株,符合生物安全性要求,并且筛选效率高,已成功应用于多种黄单胞菌的遗传转化[4-5]。
本研究尝试分别采用CFEs驯化质粒和5-AZA驯化菌株的方法,突破了野生菌株V8限制系统带来的转化障碍,获得△hpaXmN和△hpaXm突变体。目前,CFEs体外甲基化重组质粒的驯化方法仅适用存在R-M修饰系统或者提取条件不适用存在其他限制修饰系统的细菌[9],且在黄单胞菌中暂时未见报道。本研究用CFEs驯化质粒后电转黄单胞菌株V8成功,但转化效率很低,每1×108个感受态细胞仅获得1~5个转化子,电转化频率为1.0×10-8~1.0×10-7。5-AZA驯化菌株的方法已在黄单胞菌PXO99A上应用成功[10],V8菌株经过驯化后,每1×108个感受态细胞获得3~20个转化子,电转化频率为1.0×10-7~1.0×10-6,转化效率是前者的 10~100倍。关于2种驯化方法同时进行时转化效率如何,还未展开研究。
虽然黄单胞中存在严格的修饰系统,但据报道合适的外源载体如pBluescript KS、pCR2.1-TOPO和pKNG101,已成功实现水稻白叶枯病菌Xoo和细菌性条斑病菌Xoc的基因突变[18-19]。目前,菌株V8转化效率依然较低,未来仍要寻找稳定的转化载体。
致谢:感谢南京农业大学董汉松教授、宋从凤教授、龙菊英老师、沈丹老师、纪洪涛博士、李萍硕士等给予的帮助。
参考文献:
[1]Xu B,Zhang Z,Ge Q,et al. A study on classification of Xanthomonas by isoelectric focusing[J]. Acta Microbiologica Sinica,1993,33(1):7-12.
[2]董会娟,余永红,王海洪,等. 野油菜黄单胞菌中长链3-酮脂酰 ACP 合成酶的鉴定[J]. 华南农业大学学报,2015,36(2):49-54.
[3]Chan J W,Goodwin P H. The molecular genetics of virulence of Xanthomonas campestris[J]. Biotechnology Advances,1999,17(6):489-508.
[4]邹丽芳. 水稻黄单胞菌遗传操作体系的建立及hrP基因和avrBs3/PthA家族基因的功能研究[D]. 南京:南京农业大学,2007:21-34.
[5]冯 锋. 黄单胞菌效应蛋白AvrAC调节植物先天免疫的分子机制[D]. 北京:清华大学,2012:9-17.
[6]易杰祥,景晓辉,吴伦英. 黄单胞菌Ⅲ型分泌系统效应蛋白的研究进展[J]. 热带农业科学,2014(8):74-79.
[7]张鼎鼎,邹丽芳,赵梅勤,等. hrcQ基因决定水稻条斑病菌在非寄主烟草上的过敏性反应和在寄主水稻上的致病性[J]. 中国水稻科学,2011,25(1):11-18.
[8]Kubicka P,Kramaric G. Electroporation of cosmid DNA into bacterial cells[J]. Trends in Genetics,1994,10(1):5.
[9]吴东方. 副猪嗜血杆菌突变系统的初步研究[D]. 武汉:华中农业大学,2010:23-25.
[10]李 岗. 中国水稻白叶枯菌致病多样性和遗传多样性分析与家族新成员介导的表型研究[D]. 南京:南京农业大学,2008:122-123.
[11]吴 波,何明雄,冯 红,等. 运动发酵单胞菌限制-修饰系统缺失突变株的构建及其性质分析[J]. 应用与环境生物学报,2013,19(2):189-197.
[12]Pkania K C,Venneman J,Audenaert K A,et al. Present status of bacterial blight in cotton genotypes evaluated at Busia and Siaya counties of Western Kenya[J]. European Journal of Plant Pathology,2014,139(4):863-874.
[13]Ajene I J,Shenge K C,Akpa A D. Races of Xanthomonas citri subsp. malvacearum,the causal organism of bacterial blight of cotton in northern Nigeria[J]. Archives of Phytopathology and Plant Protection,2014,47(7):2263-2269.
[14]缪卫国. 转hpa1Xoo基因棉花抗病虫防卫反应与全基因组转录谱分析及棉花角斑病菌hpaXm基因的功能[D]. 南京:南京农业大学,2009:164-167.
[15]Baptista J C,Machado M A,Homem R A,et al. Mutation in the xpsD gene of Xanthomonas axonopodis pv. citri affects cellulose degradation and virulence[J]. Genetics and Molecular Biology,2010,33(1):146-153.
[16]Sambrook J,Fritsch E F,Maniatis T. Molecular cloning:a laboratory manual[M]. Cold Spring Harbor Laboratory,1982:895-909.
[17]李 爽. D-乳酸产生菌株的基因敲除[D]. 天津:天津大学,2010:13-14.
[18]Mongkolsuk S,Rabibhadana S,Sukchavalit R,et al. Construction and physiological analysis of a Xanthomonas oryzae pv. oryzae recA mutant[J]. FEMS Microbiology Letters,1998,169(2):269-275.
[19]Sugio A,Yang B,White F F. Characterization of the hrpF pathogenicity peninsula of Xanthomonas oryzae pv. oryzae[J]. Molecular Plant-Microbe Interactions,2005,18(6):546-554.
