H2O2与生长素对山黧豆初生根发育的影响
2016-05-03蒋景龙
蒋景龙
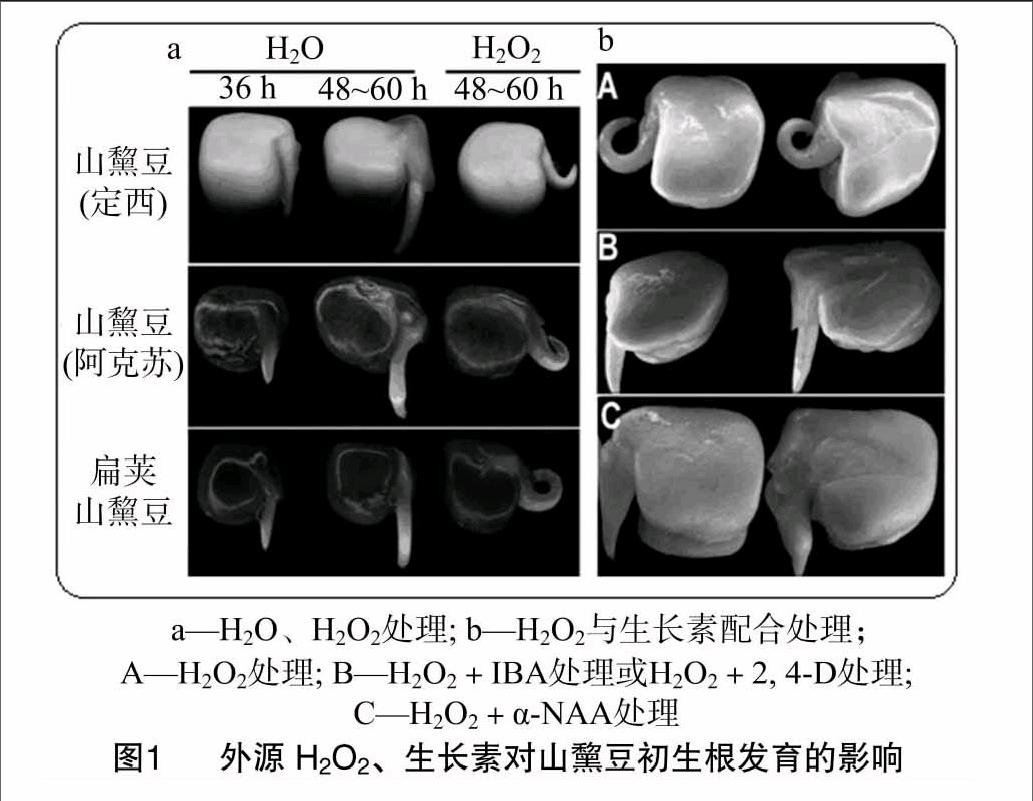
摘要: 为揭示H2O2和生长素在山黧豆[Lathyrus quinquenervius (Miq.) Litv.]初生根发育中的作用,外源性施加H2O2或生长素处理山黧豆初生根,并分析初生根的形态变化,检测内源H2O2和生长素水平变化。结果显示:施加H2O2阻止了初生根向地性生长而诱导其发生水平方向弯曲;施加吲哚-3-丁酸(IBA)、2,4-二氯苯氧乙酸(2,4-D)和α-萘乙酸(α-NAA)能够完全抑制由外源H2O2引起的初生根水平弯曲;在施加外源H2O2条件下,添加生长素的极性运输抑制剂2,3,5-三碘苯甲酸(TIBA)与1-萘氨甲酰苯甲酸(NPA),不能抑制初生根水平弯曲;外源H2O2处理降低了初生根内源的吲哚乙酸(IAA)和H2O2水平。研究结果表明,外源H2O2影响内源H2O2与IAA水平,导致初生根的水平弯曲。
关键词: 过氧化氢(H2O2);初生根;弯曲;生长素;山黧豆
中图分类号: Q945.78 文献标志码: A 文章编号:1002-1302(2016)03-0121-03
过氧化氢(H2O2)作为一种信号分子在植物的生长发育过程中参与了许多生理活动,如气孔的运动、细胞壁的木质化、根的向地性生长、侧根的发育、细胞程序化死亡与花粉和柱头的相互作用等[1]。此外,当遭受轻度生物或非生物胁迫时,植物体内产生的H2O2能够通过参与各种信号转导,调节植物的代谢(如光合作用、呼吸作用、蒸腾作用)和防卫系统(如抗氧化胁迫的酶系统与非酶系统),使植物获得生物或非生物胁迫的抗性[2-3]。因此,H2O2成为当今细胞与分子生物学研究领域的热点,但大多数研究主要集中在内源H2O2参与植物的生长发育及对各种环境刺激的应答方面,而外源H2O2如何影响植物生长发育方面的研究却鲜有报道[4]。前期研究发现,外源H2O2处理山黧豆[Lathyrus quinquenervius (Miq.) Litv.]种子能够抑制初生根向地性生长并诱导发生水平方向弯曲。在胚根突破种皮后,面对的外部环境比较复杂,种子萌发的后期,其生长发育会受到一些环境因子如重力、水分、营养及其他化学物质刺激的影响而发生根形态的变化。很多研究表明,初生根的向地性弯曲生长与生长素的不对称性分布、水平变化和极性运输有关[5]。当植物根被水平放置时,根尖会感受到重力的刺激,然后将这种信号进行转化与传递,从而影响生长素的极性运输,最终在伸长区表现出上侧的细胞中生长素浓度较低,而下侧细胞内的生长素浓度较高,出现了生长素的局部不对称性分布,最终表现出在伸长区发生向重力性的弯曲生长[6-7]。生长素存在独特的运输机制,只能在细胞与细胞之间进行极性运输。而这一极性运输的过程又可被其极性运输抑制剂2,3,5-三碘苯甲酸(TIBA)和1-萘氨甲酰苯甲酸(NPA)所抑制。本研究同时用外源的生长素、H2O2与生长素的极性运输抑制剂组合处理,检测H2O2与生长素含量变化来研究H2O2诱导的初生根水平弯曲与生长素之间的关系。
1 材料与方法
1.1 试验材料
山黧豆种子均由兰州大学细胞活动与逆境适应教育部重点实验室的细胞研究所302实验室提供。挑选籽粒饱满、无损坏的定西山黧豆、阿克苏山黧豆和扁荚山黧豆种子,用自来水冲洗3次,然后将洗净的山黧豆种子分别用不同浓度的H2O2处理60 h。H2O2的浓度分别为10、20、40 mmol/L。只加蒸馏水而没有加H2O2的设为对照组,H2O2处理了60 h后重新放入到水中培养24 h的为恢复组。以上所有的山黧豆种子均水平放置在培养皿的底部,即胚根的方向与培养皿的底面相平行。
1.2 试验方法
采用H2O2与生长素、H2O2与生长素极性运输抑制剂的组合处理。
吲哚乙酸(IAA)在空气中容易氧化,选择吲哚-3-丁酸(IBA)代替IAA。另外,2,4-二氯苯氧乙酸(2,4-D)和α-萘乙酸(α-NAA)均是生长素的类似物。TIBA、NPA均为生长素的极性运输抑制剂,其中只加外源H2O2的组作为对照。
1.3 H2O2与IAA的含量检测方法
H2O2与IAA的含量检测分别参照Jiao等的方法[8]和Dobrev等的方法[9]。
1.4 数据处理
试验数据采用Origin 7.5 SR1和SPSS 16.0软件进行制图和统计分析。
2 结果与分析
2.1 外源H2O2抑制向地性生长并诱导初生根的水平弯曲
由图1-a所示,将定西山黧豆、阿克苏山黧豆和扁荚山黧豆种子水平放置在盛有少许蒸馏水的培养皿中萌发,36 h后胚根突破种皮,由于重力的作用,48~60 h初生根开始沿着重力的方向发生向地性弯曲。将这些种子同样水平放置在盛有不同浓度H2O2的培养皿中,它们的初生根则不会发生正常的向地性弯曲,而沿着水平方向发生弯曲(图1-a)。这种弯曲的方式不同于向地性弯曲,其弯曲的方向与向地性弯曲相互垂直,因此称为水平弯曲。仅施加H2O2的初生根会发生水平弯曲(图1-b-A);当同时施加IBA和H2O2或2,4-D和H2O2时,初生根既没有发生水平弯曲也没有发生向地性弯曲(图1-b-B);当同时施加α-NAA和H2O2时,水平弯曲生长被完全逆转且在胚轴的部位与对照组相比还明显地发生了加粗生长(图1-b-C)。
2.2 H2O2与生长素、H2O2与生长素抑制剂处理对根水平弯曲的影响
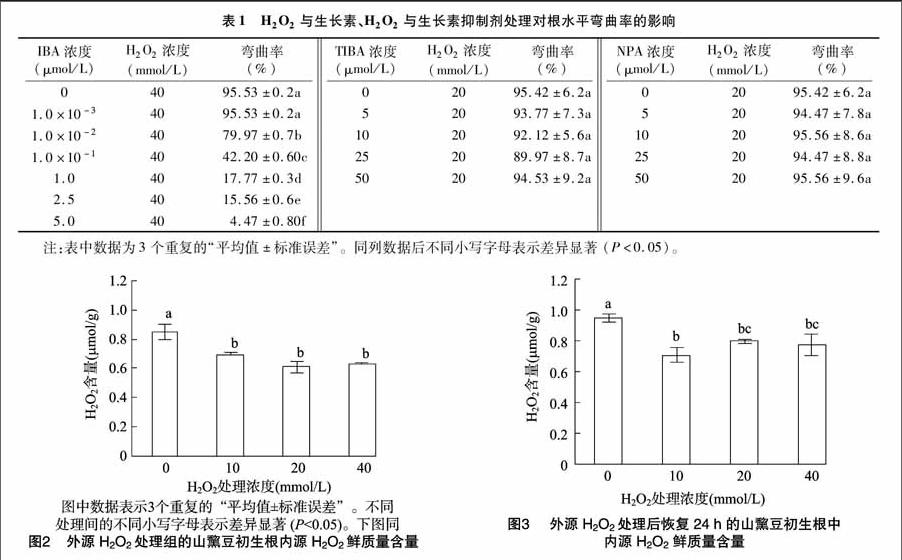
IBA抑制初生根水平弯曲存在着剂量关系,即IBA的浓度越高,抑制水平弯曲的作用就越明显,低于最低浓度阈值,IBA不能抑制初生根的水平弯曲(表1)。当IBA的浓度为 1.0×10-3~1.0×10-2 μmol/L时,初生根的弯曲率达 79.97% 以上,表明低浓度的IBA对初生根的水平弯曲率的抑制效果不明显;但当IBA的浓度超过1.0 μmol/L时,初生根的水平弯曲率仅为17.77%。这些数据表明,施加的IBA浓度越高,抑制作用越明显。在一些有生长素参与的植物生长发育中,如果用生长素的特异性极性运输抑制剂如TIBA、NPA处理,会抑制一些正常的生长发育,例如植物根的向地
性生长。在本试验中,同时施加2种生长素的极性运输抑制剂TIBA或NPA与H2O2进行处理,结果发现用5~50 μmol/L TIBA 或NPA处理,均不能抑制由H2O2诱导的初生根的水平弯曲。
2.3 外源H2O2处理影响了初生根内源H2O2和生长素水平
通过双酶法对初生根内的H2O2含量进行检测,结果如图2所示。对照组初生根内的H2O2含量为0.85 μmol/g,而经H2O2处理后初生根内的H2O2含量明显低于对照组,但10、20、40 mmol/L H2O2处理组之间并没有显著性的差异。将处理了60 h的山黧豆幼苗重新放回水中恢复24 h后,内源H2O2水平再次升高,但仍低于对照组中的H2O2含量(图3),这表明外源施加H2O2处理降低了内源的H2O2积累。
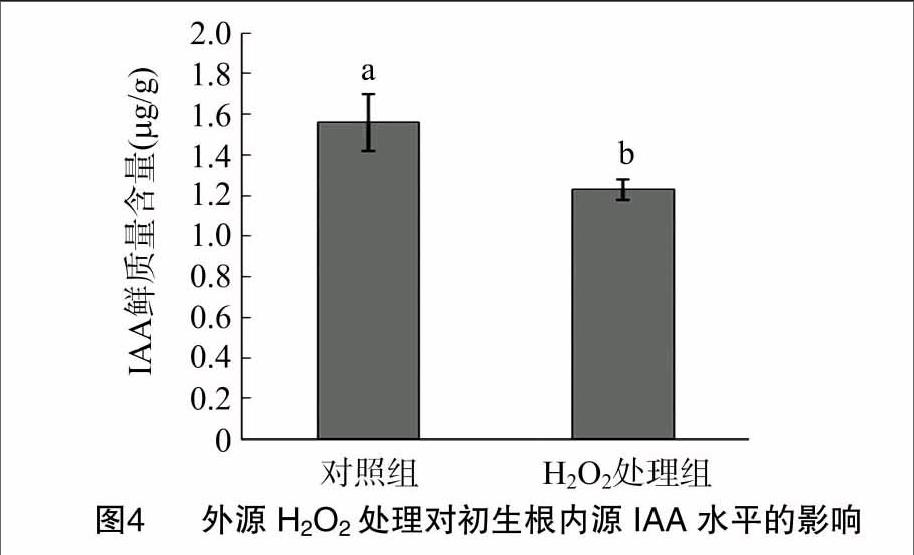
同时通过高效液相色谱方法检测初生根内的IAA水平。结果显示,对照组初生根的生长素鲜质量含量达到了 1.6 μg/g,而20 mmol/L H2O2处理60 h的初生根中的生长素含量不足1.2 μg/g,降低了大约25%(图4),这表明施加外源H2O2后,初生根内源的生长素水平显著降低。
3 结论与讨论
过氧化氢作为一种信号分子在植物体内发挥了许多重要作用,近几年越来越多的研究者开始选择通过施加外源性的H2O2处理植物的方法来研究其对植物生长发育的影响[10-11]。外源H2O2能够促进大麦、百日草、菠菜、豌豆、樟脑等种子的萌发[12]。外部环境因子能影响植物根的形态和结构,而植物的根也能在最初感受刺激后作出相应的应答[13]。在面对各种环境刺激后,植物的根系能够表现出一种不对称的生长模式,例如卷曲、弯曲、螺旋、波浪、倾斜等[14]。Li等的研究表明,施加外源H2O2能与生长素相互作用诱导黄瓜、绿豆的不定根生长[15-16]。Joo 等在玉米初生根的向地性生长研究中发现,活性氧(主要是H2O2)在生长素的下游参与了向地性应答的信号转导[17]。本研究结果显示,外源性施加H2O2不仅阻止了山黧豆初生根的向地性生长,还引起了初生根在水平方向上发生形态学的弯曲现象。初生根的弯曲一般由根两侧的细胞伸长速率差异引起,而这种差异又往往与生长素的分布和极性运输有关。当同时施加一定浓度的H2O2、生长素的类似物如IBA,2,4-D或α-NAA时,这种水平弯曲明显地被抑制,而且随着生长素类似物浓度的提高,几乎可以完全抑制这种由H2O2引起的水平弯曲。外源的H2O2降低了内源生长素的水平,而这可能更有利于植物根细胞两侧形成不对称的生长素分布,从而导致水平弯曲的发生。至于是否促进了生长素的不对称性分布,如何促进根两侧细胞形成生长素的不对称性分布等问题,还需要通过对初生根局部区域生长素进行定位研究。
参考文献:
[1]Jiang J L,Su M,Wang L Y,et al. Exogenous Hydrogen peroxide reversibly inhibits root gravitropism and induces horizontal curvature of primary root during grass pea germination[J]. Plant Physiology and Biochemistry,2012,53(4):84-93.
[2]李师翁,薛林贵,冯虎元,等. 植物中的H2O2信号及其功能[J]. 中国生物化学与分子生物学报,2007,23(10):804-810.
[3]林植芳,刘 楠. 活性氧调控植物生长发育的研究进展[J]. 植物学报,2012,47(1):74-86.
[4]刘会杰,李 胜,马绍英,等. H2O2胁迫下豌豆初生根及抗氧化酶系统对外源 Ca2+的响应[J]. 草业学报,2014,23(6):189-197.
[5]Santisree P,Nongmaithem S,Vasuki H,et al. Tomato root penetration in soil requires a coaction between ethylene and auxin signaling[J]. Plant Physiology,2011,156(3):1424-1438.
[6]李俊华,种 康. 植物生长素极性运输调控机理的研究进展[J]. 植物学通报,2006,23(5):466-477.
[7]翟开恩,潘伟槐,叶晓帆,等. 高等植物局部生长素合成的生物学功能及其调控机制[J]. 植物学报,2015,50(2):149-158.
[8]Jiao C J,Jiang J L,Li C,et al. β-ODAP accumulation could be related to low levels of superoxide anion and hydrogen peroxide in lathyrus sativus L[J]. Food and Chemical Toxicology,2011,49(3):556-562.
[9]Dobrev P I,Kamínek M. Fast and efficient separation of cytokinins from auxin and abscisic acid and their purification using mixed-mode solid-phase extraction[J]. Journal of Chromatography A,2002,950(1/2):21-29.
[10]Ishibashi Y,Yamaguchi H,Yuasa T A,et al. Hydrogen peroxide spraying alleviates drought stress in soybean plants[J]. Journal of Plant Physiology,2011,168(13):1562-1567.
[11]Zhang X L,Jia X F,Yu B,et al. Exogenous hydrogen peroxide influences antioxidant enzyme activity and lipid peroxidation in cucumber leaves at low light[J]. Scientia Horticulturae,2011,129(4):656-662.
[12]Barba-Espin G,Diaz-Vivancos P,Clemente-Moreno M J,et al. Interaction between hydrogen peroxide and plant hormones during germination and the early growth of pea seedlings[J]. Plant,Cell & Environment,2010,33(6):981-994.
[13]Malamy J E. Intrinsic and environmental response pathways that regulate root system architecture[J]. Plant,Cell & Environment,2005,28(1):67-77.
[14]Noriega A,Cervantes E,Tocino A. Ethylene responses in Arabidopsis seedlings include the reduction of curvature values in the root cap[J]. Journal of Plant Physiology,2008,165(9):960-966.
[15]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide involvement in formation and development of adventitious roots in cucumber[J]. Plant Growth Regulation,2007,52(2):173-180.
[16]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings[J]. Environmental and Experimental Botany,2009,65(1):63-71.
[17]Joo J H,Bae Y S,Lee J S. Role of auxin-induced reactive oxygen species in root gravitropism[J]. Plant Physiology,2001,126(3):1055-1060.
