菊花叶片总RNA提取方法的比较研究
2016-05-03董璐贾红梅刘迪毛洪玉
董璐+贾红梅+刘迪+毛洪玉
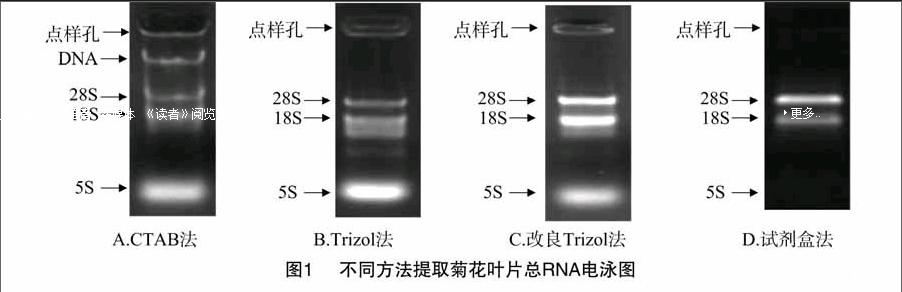

摘要: 以菊花C008的叶片为试材,分别采用CTAB法、Trizol法、改良Trizol法和试剂盒法等进行总RNA提取试验,并对提取质量进行分析比较。结果表明:CTAB法提取的总RNA存在DNA污染。Trizol法提取的总RNA条带复杂,有蛋白等杂质污染。改良Trizol法提取的总RNA条带清晰,但RNA存在降解。试剂盒法提取的总RNA条带清晰,纯度更高,D260 nm/D280 nm为1.889,浓度为144.000 μg/mL,是适于菊花叶片总RNA提取的简单、高效的方法。
关键词: 菊花;总RNA;提取方法
中图分类号: S682.1+10.1 文献标志码: A
文章编号:1002-1302(2016)03-0067-02
菊花(Chrysanthemum morifolium)是中国十大传统名花和世界四大切花之一,也是园林绿化中的重要观赏植物之一,在现代花卉生产中占有重要地位,具有很高的观赏和经济价值。菊花白色锈病是菊花首要病害之一,在多个国家被列为检疫性病害[1]。寻找菊花中的抗病基因,对于防治该病具有重要作用。获得纯度高、完整性好的RNA是后期进行转录组测序、RT-PCR、基因克隆等分子生物学研究的基础。菊花的组织器官中含有大量的多糖、酚类、蛋白质等次生代谢物质,严重干扰了菊花总RNA 的提取质量[2]。目前,针对菊花叶片总RNA的提取有一些报道[2-5],但仍不能提取出质量好的总RNA。本试验对4种常用的总RNA提取方法进行系统分析比较,发现试剂盒法对于菊花叶片总RNA的提取是一种简单、高效的方法。
1 材料与方法
1.1 试验材料
以沈阳农业大学花卉基地的菊花C008的叶片为试材,采后立即用锡箔纸包好,用液氮速冻后,在-80 ℃的超低温冰箱中保存备用。
主要试剂:CTAB缓冲液、10%β-巯基乙醇、氯仿 ∶异戊醇(CI,V ∶V=24 ∶1)、Trizol试剂、异丙醇、无水乙醇、DECP水、RNA prep Pure Kit试剂盒等。
试验所需的移液枪枪头、枪头盒均用0.1%DEPC水浸泡24 h,然后121 ℃高压灭菌30 min,50 ℃烘干备用。三角瓶、玻璃棒、量筒、研钵、研棒、钥匙用双蒸馏水清洗后180 ℃烘烤过夜。研钵、研棒、药匙在使用前需放入-20 ℃冰箱预冷。
1.2 试验方法
1.2.1 CTAB法 ①取0.2 g菊花叶片于液氮中迅速冷却充分研磨,将磨好的叶片迅速装入无RNase的2 mL离心管中,加入65 ℃预热的CTAB缓冲液(含10%的β-巯基乙醇) 1 mL,立即在振荡器上剧烈振荡30 s,65 ℃水浴锅中孵育 10 min,每3~5 min颠倒混匀1次,动作不要太剧烈。②加入等体积的氯仿 ∶异戊醇(CI,V ∶V=24 ∶1),用力颠倒混匀,4 ℃ 下12 000 r/min离心10 min。③取上清液于新的离心管中,加入等体积的CI,轻轻颠倒混匀,4 ℃下,12 000 r/min离心10 min。④取上清液于新离心管中,加入二倍体积的异丙醇,轻轻颠倒混匀,-20 ℃沉淀30 min以上,4 ℃下12 000 r/min 离心20 min,去上清。⑤用提前预冷的75%乙醇洗涤沉淀1次,去上清,在超净工作台中吹干沉淀,加入 40 μL ddH2O水溶解沉淀。
1.2.2 Trizol法 参照吕晋慧等的方法[2]。
1.2.3 改良Trizol法 ①向1.5 mL离心管中加入1 mL Trizol 和20 μL β-巯基乙醇,混匀。称取0.2 g菊花叶片液氮研磨成粉末,转移至离心管中,混匀后,静置10 min,4 ℃下 12 000 r/min 离心5 min。②取上清,加入等体积的CI,混匀,4 ℃下12 000 r/min离心5 min。③重复步骤②2次。④取上清,加入等体积异丙醇,混匀,静置10 min,4 ℃下 12 000 r/min 离心10 min。⑤弃上清,用75%乙醇洗涤沉淀2次,4 ℃下12 000 r/min离心10 min;弃上清,超净工作台吹干,加入40 μL ddH2O溶解沉淀。
1.2.4 试剂盒法 参照RNA prep Pure Kit试剂盒(天根生化科技有限公司,北京)说明书。
1.2.5 总RNA完整性和纯度检测 取4 μL总RNA样品在1%的琼脂糖凝胶上进行电泳,电压150 V电泳10~15 min,电泳后用凝胶成像系统拍照记录。取1 μL总RNA样品,用紫外分光光度计测定波长在260 nm和280 nm下的吸光度(以试验中溶解总RNA的ddH2O作为空白对照进行调零),计算总RNA样品浓度及RNA产量。
2 结果与分析
2.1 菊花叶片总RNA的完整性分析
琼脂糖凝胶电泳是检测RNA质量的一种重要方法。用1%的琼脂糖凝胶对4种不同方法提取的RNA进行电泳检测,结果(图1)表明,采用CTAB法提取的RNA条带弥散且亮度低,伴有DNA污染,说明提取的RNA质量不好。Trizol法提取的RNA条带复杂并且带有轻微拖尾现象,5S条带荧光亮度很大,说明RNA严重降解;点样孔有亮斑,说明RNA样品中含有多糖或蛋白质污染。改良Trizol法相较于Trizol法,条带少,拖尾现象不明显,点样孔杂质少,但该方法还是未能完全去除多糖和酚类物质,8S比28S亮度大,说明28S有部分降解。试剂盒法提取的RNA,28S和18S条带清晰,其荧光亮度接近2 ∶1,条带没有拖尾现象,点样孔无亮斑,说明RNA提取效果好。该方法最适用于菊花总RNA的提取,并用于后续反转录、PCR等试验。
2.2 菊花叶片总RNA的纯度分析
利用紫外分光光度计对4种方法提取的菊花叶片总RNA的纯度进行检测。260 nm和280 nm下的吸光度代表了核酸和蛋白质等有机物含量,D260 nm/D280 nm的值直接反映出RNA中蛋白质等有机物的污染程度。由表1可知,Trizol法的D260 nm/D280 nm值为2.147,产量为39.224 μg/g,改良Trizol法的D260 nm/D280 nm为2.171,产量为57.499 μg/g,说明RNA中有少量蛋白质等有机物污染,质量较好,对于RNA质量要求不高的试验,不影响后续使用。虽然CTAB法提取的RNA浓度高产量大,但不排除是因为其有DNA污染的影响。高纯度RNA的D260 nm/D280 nm值应介于1.8~2.0之间,试剂盒法中D260 nm/D280 nm为1.889,浓度和产量分别为144.000 μg/mL、28.080 μg/g。就试验所需时间来看,CTAB法所需要的时间最长,后期还需要去除DNA。Trizol法和改良Trizol法所需的时间适中,分别为60 min和70 min。试剂盒法所需时间最短,仅为45 min。综上,试剂盒法是菊花C008叶片总RNA提取质量最好、效率最高的方法。
3 结论与讨论
获得高质量无污染的RNA是进行基因表达分析等后续分子试验的关键环节,但是从植物组织中提取出高质量的RNA是有一定难度的。由于植物组织中含有多糖、多酚、蛋白质和其他次生代谢物质,给高纯度RNA的提取带来一定难度。并且RNase广泛存在且稳定,使RNA的提取相较于DNA变得更加困难。不同植物采用的提取方法不同,同种植物的不同组织或相同组织在不同生长阶段所用的提取方法也不同[6-12]。所以,合适的总RNA提取方法的选择,是转录组测序、RT-PCR、基因克隆等分子生物学方面研究的根本保证。
菊花为多年生草本植物,其组织或器官中含有大量的多糖和酚类物质,较多的次生代谢物质经常会对总RNA的产量和纯度造成影响[2]。多糖的理化性质和RNA相似,容易与RNA形成难溶的胶状物[13-14],然而在去除多糖干扰的过程中,也会去除一些RNA,使RNA产量减少。酚类物质在材料匀浆时释放出来被氧化,使其与RNA产生不可逆的褐化反应,导致匀浆呈褐色[15-16]。CTAB法、改良Trizol法和试剂盒法均使用β-巯基乙醇作为强还原剂,目的是防止酚类物质被氧化[17]。CTAB法是一种传统的总RNA提取方法,但其提取的总RNA中有DNA污染,需要进一步用DNase Ⅰ消除,由于DNase Ⅰ价格较贵,不适用于大量提取RNA。本试验Trizol法和改良Trizol法所提取的总RNA条带均不只有5S、18S和28S这3条带,在5S和18S之间还有条带,可能是叶绿体RNA。改良Trizol法相较于Trizol法,用氯仿-异戊醇(V ∶V=24 ∶1)代替氯仿并进行多次抽提,更加充分地沉淀多糖、酚类物质等,这与王舒藜等的结论[18]相一致。试剂盒法所提取的总RNA虽然由于洗脱柱和过滤柱的作用导致浓度及产量不高[7],但还是能够满足试验需要,而且试剂盒法所提取的总RNA完整性好、操作简单、所用时间短。综上,试剂盒法是一种简单、高效的提取菊花叶片总RNA的方法。
对于植物总RNA的提取还应该注意以下几个方面:(1)试验材料尽量采用新鲜样品,长时间冷冻的样品对植物总RNA的提取有一定影响。(2)采集新鲜样品后应立即用液氮速冻,如采集地距离实验室较远,应在采集后立即放入冰盒,防止离体组织的RNA降解。(3)试验前将研钵和研棒于 -20 ℃ 冰箱内预冷。如天气炎热,应在磨样前向研钵中先加入液氮再一次快速预冷。药匙在液氮中快速预冷后可防止药匙上有样品残留,减少样品损失。(4)在抽提吸取上清液过程中,采用小量程多次吸取的方法,缓慢吸取上清,可减少多糖、酚类物质等大分子与RNA作用一起沉淀。
参考文献:
[1]Whipps I M. A review of white rust(Puccinia horiana Henn.)disease on chrysanthemum and the potential for its biological control with Verticillium lecanii (Zimm.)Viégas[J]. Ann Appl Boil,1993,122:173-187.
[2]吕晋慧,陈 阳,康红梅. 一种有效的菊花总RNA提取方法[J]. 中国农学通报,2011,27(25):113-116.
[3]张志想,葛蓓孛,潘 嵩,等. 菊花矮化类病毒的分子检测与序列分析[J]. 园艺学报,2011,38(12):2349-2356.
[4]黄 河,王顺利,曹华雯,等. 甘菊cDNA-AFLP反应体系的优化[J]. 生物技术通报,2009(11):108-113.
[5]温立柱. 菊花开花抑制基因CmEMF基因的克隆及其表达分析[D]. 泰安:山东农业大学,2013.
[6]李 霞,王 欣,后 猛,等. 紫肉甘薯块根总RNA提取方法的评价[J]. 分子植物育种,2015,13(1):165-170.
[7]罗 江,杨丽娟,崔浩然,等. 刺山柑总RNA提取方法的比较研究[J]. 北方园艺,2014(5):91-95.
[8]刘 洁,江静怡,徐吉臣. 一种改良的云杉针叶总RNA提取方法[J]. 分子植物育种,2014,12(3):554-561.
[9]李红熙,徐美隆,杨 智. 一种适合葡萄多种组织的总RNA提取方法[J]. 中国农学通报,2012,28(7):155-159.
[10]王梦娜,武 艳,程国山,等. 茶树叶片总RNA提取方法的比较研究[J]. 植物生理学报,2013,01(1):95-99.
[11]崔素萍,康振生,赵 杰,等. 一种快速提取小麦叶片总RNA的方法[J]. 西北植物学报,2006,26(2):314-318.
[12]李小婷,戴国礼,李彦龙,等. 沙棘叶片总RNA提取方法的比较研究[J]. 江苏农业科学,2014,42(3):33-34,137.
[13]Fang G,Hammar S,Grumet R. A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J]. BioTechniques,1992,13(1):52-54,56.
[14]谭丽丽,燕正民,徐亚英,等. 番茄叶片总RNA提取方法的比较[J]. 东北农业大学学报,2010,41(4):29-32.
[15]Schneiderbauer A,Sandermann H,Ernst D. Isolation of functional RNA from plant tissues rich in phenolic compounds[J]. Analytical Biochemistry,1991,197(1):91-95.
[16]曾文丹,罗兴录,袁圣勇,等. 不同方法提取木薯茎总RNA效果的比较研究[J]. 北方园艺,2013(8):103-106.
[17]夏海武,吕柳新,陈桂信. 羊蹄甲果荚中总RNA提取的新方法[J]. 分子植物育种,2006,4(1):147-149.
[18]王舒藜,吴沙沙,吕英民. 改良Trizol法快速高效提取香石竹总RNA[J]. 分子植物育种,2010,8(5):987-990.
