红掌佛焰苞数字基因表达谱及关键基因表达水平分析
2016-05-03彭佳佳刘克林刘丽娅吕学华杨哲李
彭佳佳+刘克林+刘丽娅+吕学华+杨哲+李佩愉+刘春+明军+袁素霞+平吉成+张黎


摘要: 以红掌佛焰苞S5(盛花期:红色)、S8(衰老期:绿色)时期为试验材料进行数字基因表达谱(digital gene expression profiling,DGE)测序,分别得到12 766 374条(1.28 G)、18 583 390条(1.86 G)可分析序列(clean reads),被成功注释有差异表达的基因序列2 316条。为探究红掌佛焰苞颜色变化过程中关键基因的表达水平,将差异基因定位在花青素生物合成途径11条表达量变化的序列上,并通过实时荧光定量PCR对其中的4条序列进行检验,验证了DGE测序结果的准确性。同时研究这4个序列在红掌佛焰苞生长过程中的表达水平,结果表明:在佛焰苞发育初期,3条序列相对表达量逐渐增高,1条在S2时期降低,但均在S3时期达到最高或较高值;在S4、S5、S6、S7、S8时期,随着佛焰苞的成熟,4条序列表达量大体上均逐渐下降,在S8衰老期表达量最低。研究结果证明了这4条基因序列是红掌佛焰苞花色形成中的关键基因,S3时期是花青素生物合成的高峰期。
关键词: 数字基因表达谱;红掌佛焰苞;花青素;基因表达水平;基因序列;关键基因;花色变化;关键酶
中图分类号: S682.03 文献标志码: A 文章编号:1002-1302(2016)03-0048-05
红掌(Anthurium andraeanum)为天南星科花烛属多年生常绿草本植物,原产于中美洲、南美洲热带地区[1],以其花色丰富艳丽的心形佛焰苞片和持久的花期广受消费者喜爱。花色是花卉重要的观赏性状,花色的形成主要是由不同类型花色素在花瓣中的积累决定的[2]。Iwata等研究表明,红掌花青素主要有花色苷、花葵苷2种,并且花色与这2种色素苷的比例有关[3]。花青素在花瓣的生长发育过程中会发生一系列变化,其合成也受相关合成酶基因的转录水平所控制[4-6]。
数字基因表达谱(DGE)是利用新一代高通量测序技术对某物种的特定组织在特定状态下基因的表达量变化情况进行检测的结果,现已被广泛应用于基础科学研究、医学研究和药物研发等领。通过DGE可以筛选出有差异表达的基因序列信息,研究基因表达量的变化是调控细胞生命活动过程的核心机制[7]。
红掌佛焰苞在生长发育过程中会由红色逐渐变为绿色,这与其花青素生物代谢合成过程中关键基因的表达量存在一定的关系。本试验通过对红掌佛焰苞S5、S8时期进行DGE测序,得到在红掌颜色变化过程中存在差异表达的基因序列,并选择有关基因探究其在红掌佛焰苞生长发育过程中的表达水平,为红掌花色基因全长克隆、分子标记,及改良育种等奠定基础。
1 材料与方法
1.1 试验材料
试验材料来自北京大兴苗圃2年生火焰(Dakota)2个生长期:S5(盛花期),佛焰苞全部展开,肉穗上部黄色,下部白色(此时为商品最佳观赏期);S8(衰老期),佛焰苞全部转为绿色,肉穗变为深绿色(图1)。采取健康佛焰苞于-80°C贮存备用。
1.2 试剂与仪器
总RNA提取采用植物RNA提取试剂盒Esayspin,购自北京艾德莱生物科技有限公司;反转录试剂盒:SuperScript III First-Strand Synthesis System for RT-PCR,购自invetrogen公司;荧光定量试剂盒:FastStart Universal SYBR Green Master (ROX),购自Roche公司;Taq DNA聚合酶,由天根生化科技(北京)有限公司提供。试验用到的主要仪器有PCR仪、ABI7900HT荧光定量PCR仪、台式离心机、超低温高速离心机、恒温水浴锅、制冰机、电泳仪、凝胶成像系统及超净工作台等。引物由深圳华大基因科技服务有限公司合成。试验对红掌的S5(盛花期:红色)、S8(衰老期:绿色)进行的DGE测序,由北京诺禾致源科技有限公司完成。
1.3 植物总RNA提取
植物总RNA提取方法按照Esayspin试剂盒说明书进行,提取结果用1.5%琼脂糖凝胶电泳检测。条带28 S ∶ 18 S亮度比约为2 ∶ 1,说明RNA无降解;用Biodrop超微量蛋白核酸分析仪测得D260 nm/280 nm在1.8~2.2之间,则说明RNA质量合格,可进行后续测序试验。
1.4 红掌佛焰苞DGE测序
样品检测合格后,用带有Oligo(dT)的磁珠富集mRNA后加入fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用6碱基随机引物(random hexamers)合成1链 cDNA;然后加入缓冲液、dNTPs和DNA polymerase I合成2链cDNA;随后用AMPure XP beads试剂盒纯化双链cDNA。将纯化的双链cDNA进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,最后进行PCR富集得到最终的cDNA文库。测序工作由北京诺禾致源生物信息科技有限公司利用Illunima HiSeqTM2000/MiseqTM平台完成。
1.5 DGE测序结果分析
测序得到原始测序序列(raw reads),为保证信息分析质量,必须对原始测序序列过滤去除里面含有带接头的、低质量的reads(质量值sQ≤5的碱基数占整个reads 50%以上的reads),得到clean reads(指过滤去除里面含有带接头的、低质量的reads后,可以进行后续分析的可用序列),后续分析基于clean reads进行。以红掌转录组测序结果为参考序列,基因表达水平以RPKM(reads per kilo bases per million mapped reads)[8]为评估方法。以Audic等方法[9]对2个时期的样本进行差异基因筛选,后续对样本间差异基因功能上的基因本体论(gene ontology,GO)富集分析[10]和这些基因参与的最主要生化代谢途径和信号转导途径的KEGG(Kyoto encyclopedia of genes and genomes)富集分析[11]都基于差异基因。筛选出与红掌佛焰苞颜色变化有关的差异基因,验证DGE测序结果并探究这些差异基因在红掌佛焰苞整个发育过程中的表达水平。
1.6 实时荧光定量PCR 验证
根据测序结果得到红掌佛焰苞颜色变化的关键差异基因序列,用Primer 5.0设计特异引物。分别提取红掌佛焰苞S1至S8整个发育时期(图1)的总RNA,反转成cDNA进行荧光定量试验,PCR反应条件:95℃ 10 min,95℃ 15 s,55°C 60 s,72℃ 20 s,40个循环。用RQ manager 软件进行CT值分析,用2-ΔΔCT法计算基因的表达水平。以S5(盛花期:红色)作为对照时期、红掌CYP(登陆号:JN602201,CYP-F:5′-TTCGACATGRMRRTCGGCGGC-3′;CYP-R:5′-CGACRTGCTTSCCRTCRAGCC-3′)作为内参基因[12]。
2 结果与分析
2.1 DGE测序结果分析
通过DGE测序,样本S5、S8分别得到12 766 374条(128 G)、18 583 390条(1.86 G)clean reads,分别占原始数据的98.2%、98.1%,碱基错误率均为0.04%,GC含量分别为50.1%、52.1%。在S5、S8时期被成功注释有差异表达的基因序列2 316条,其中在S8时期中表达量下调的基因序列有925条(39.9%),上调的有1 392条(60.1%)。
2.2 差异表达基因的GO富集分析
差异基因GO富集分析中共有1 656条差异基因,以生物学过程(biological process,BP;图2)、细胞组分(cellular component,CC;图3)及分子功能(molecular function,MF;图4)三大类的60个亚类(各20个亚类)进行功能注释,共得到2 626个GO注释结果,以富集程度最高的60个GO注释作图。其中生物学过程中,代谢过程(metabolic process GO:0008152)被注释到的差异基因序列最多,达1 082条(67.87%);其次是单细胞代谢过程(single-organism metabolic process GO:0044710),有501条(32.72%)有表达量变化。在细胞组分功能分类中的差异基因数量相对较少,质体(plastid GO:0009536)、叶绿体(chloroplast GO:0009507)、类囊体(thylakoid GO:0042651)及光合作用膜上(photosynthetic membrane GO:0034357)的差异基因数量在该功能分类中相对较多。在分子功能的分类中,催化活性(catalytic activity GO:0003824)和氧化还原酶活力(oxidoreductase activity GO:0016491)注释到的差异基因数量最多,分别为927条(56.9%)、252条(15.2%)。
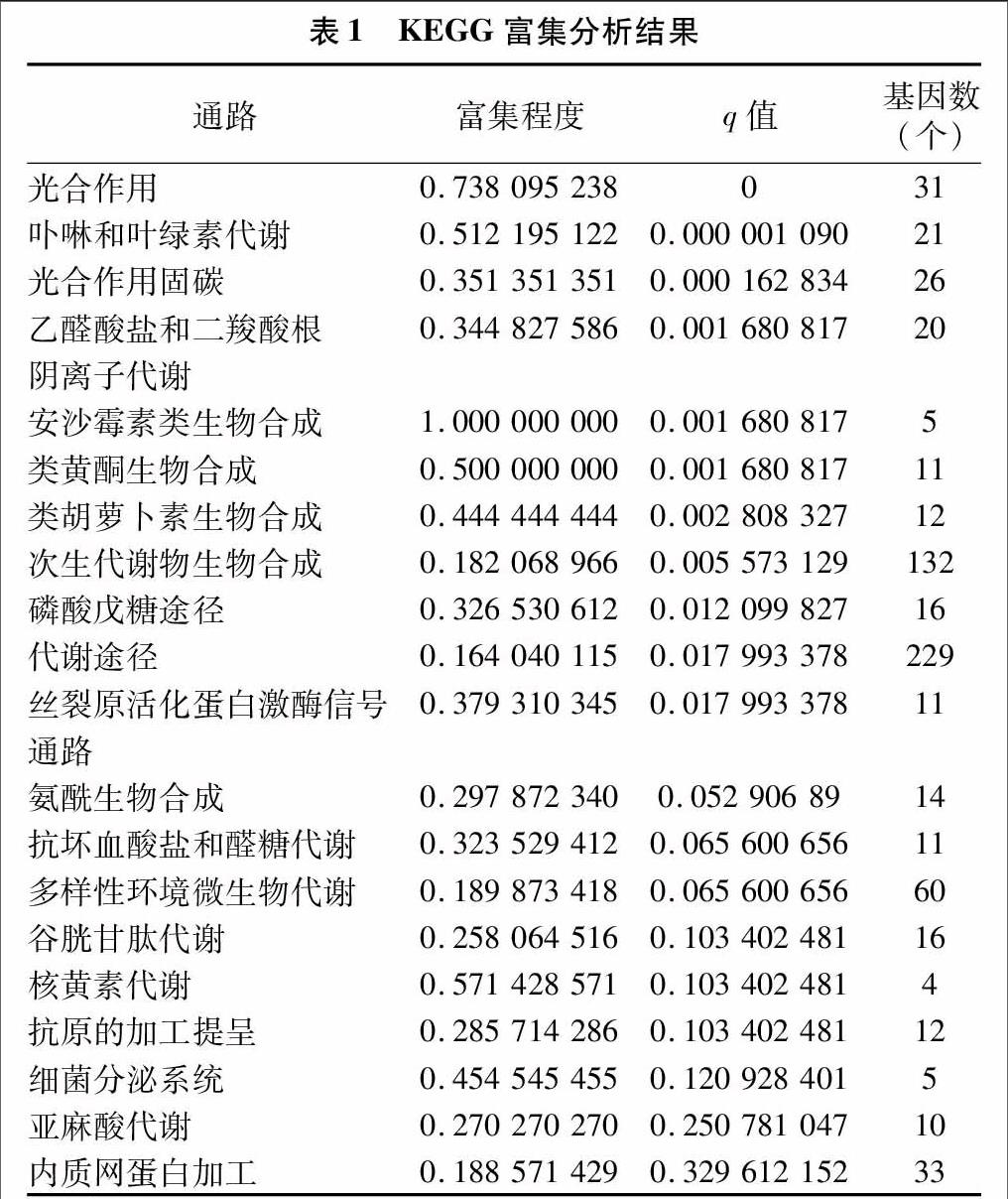
2.3 差异表达基因的KEGG富集分析
对差异基因进行KEGG富集分析,得到差异基因所参与的主要代谢途径有170条,主要富集在次生代谢产物生物合成(biosynthesis of secondary metabolites)、不同环境微生物代谢(microbial metabolism in diverse environments)、内质网蛋白加工(protein processing in endoplasmic reticulum)等途径(表1),本研究主要研究在红掌佛焰苞颜色变化过程中关键基因的表达情况,注释得到在类黄酮生物合成途径(flavonoid biosynthesis)中差异表达的基因数量有11条,通过代谢路径分析,该11条基因序列参与花青素生物合成途径,与S5时期(盛花期)相比,S8时期(衰老期)均表现为表达量下调。预测该11条基因序列为控制红掌佛焰苞颜色变化的关键基因,通过NCBI序列比对,被注释为8种基因,分别为C4H(肉桂酸-4-羟化酶)、CHS、CHI、DFR、F3′H、F3H、ANS、LAR。选其中感兴趣的4个基因序列,同时设计其特异扩增引物进行后续分析(表2)。
2.4 实时定量PCR验证结果
对筛选出的4个关键基因,在红掌佛焰苞的S5、S8时期进行实时定量PCR验证其基因表达水平。图5结果表明,comp52649_c2(C4H)、comp46425_c0(CHI)、comp53291_c0(DFR)、comp41735_c0(F3H)这4条基因在S8时期中表达量均有不同程度下调,每条序列表达量下调倍数都高于DGE测序结果,其中comp41735_c0下调倍数较多。分析原因可能是因为荧光定量扩增的是特异片段且具有较高的灵敏性,同时也与材料的选择时期偏差有关。荧光定量结果与DGE测序结果趋势基本一致,说明测序结果有较好的准确性。
2.5 花青素代谢途径中关键基因在红掌佛焰苞各时期表达水平分析
通过实时荧光定量PCR检测4个关键基因在红掌佛焰苞发育时期的表达水平。图6结果表明:CHI在佛焰苞发育初期表达量规律不稳定,在S3时期中表达量最高,其次是S1时期,在S2时期中表达量下降明显,在S5、S6、S7、S8时期中,随着佛焰苞的衰老,其表达量逐渐降低;C4H、F3H、DFR基因在佛焰苞初期相对表达量随着佛焰苞的生长逐渐增高,其中C4H、F3H在S3时期达到最高,DFR在S4时期中表达量最高;S4时期之后,4个基因均随着佛焰苞的成熟,表达量逐渐下降;在S8衰老期,相对表达量均达到最低水平。由结果可知,S3时期是红掌花青素合成的高峰期,随着佛焰苞生长,花青素含量下降是导致佛焰苞颜色变绿的原因。
3 讨论与结论
类黄酮类物质具有生物功能多样性,包括抗植物病原体、参与植物激素调节反应等[13-14];同时使植物花瓣呈现出红色、蓝色、紫色和橙色,这种进化可以吸引传粉者并利于种子的传播,也可以对自身进行保护[15]。黄酮类物质中的花青素是红掌佛焰苞呈色的主要物质。目前,花青素生物合成途径在其他花卉中研究的较为清楚,经过该途径合成的天竺葵色素苷、矢车菊色素苷和飞燕草色素苷是形成有色花的主要色素物质[16]。
本研究中得到在红掌佛焰苞花青素生物合成途径中表达量变化的11条基因序列,通过NCBI数据库比对注释为8种基因,分别为C4H、CHS、CHI、DFR、F3H、F3′H、ANS和LAR,总结出这8种基因是控制该途径的关键基因。选出重要的4条基因序列comp52649_c2(C4H)、comp46425_c0(CHI)、comp41735_c0(F3H)和comp53291_c0(DFR),探究其在红掌佛焰苞发育过程中基因表达水平。其中C4H是催化花青素生物合成途径第1阶段第2步反应的关键酶[17-18];Millar等研究表明,C4H的表达丰度对黄酮类化合物的生物合成量有一定影响[19]。本研究表明,随着红掌佛焰苞的生长,C4H先升高再降低,表明红掌黄酮类物质在此过程中的含量变化是导致红掌颜色变化的主要原因之一。CHI是查尔酮生成4′,5,7-三羟基黄烷酮过程的催化酶,可将该反应效率提高 7~10倍[20],CHI与黄酮类物质合成密切相关,通过调节CHI表达量可进行花色改良,如利用RNA干扰技术抑制烟草的CHI合成,得到黄色花瓣;在康乃馨中的CHI、DFR插入转座子得到黄色品种。在本研究中红掌佛焰苞由红色变为绿色过程中,CHI表达量下降明显,表明该基因的表达丰度下降与佛焰苞颜色变化有关,而在佛焰苞前期发育时期表达量变化不稳定,具体原因有待进一步验证。F3H属氧化戊二酸依赖型加氧酶,具有底物特异性,反应需依赖Fe2+、O2-、2-酮戊二酸等作为辅助因子,在植物类黄酮生物合成调控中起着关键的作用[21]。在本试验中,F3H在佛焰苞S3时期高表达,说明S3时期是红掌花青素合成的旺盛时期;DFR是ADPH依赖性短链还原酶家族成员[22],Collette等对红掌的研究中发现,DFR的转录水平在不同的发育阶段有显著差异,在佛焰苞发育过程中DFR是一个关键基因[23]。在本试验中,DFR基因表达量在红掌佛焰苞发育初期逐渐升高,在S3时期达到最高值,随着佛焰苞的成熟和衰老,表达量逐渐降低,S8时期达到最低值,这与Collette等研究结果[23]一致,说明DFR是红掌佛焰苞发育过程中花色变化的关键酶。
本研究利用DGE测序技术得到红掌在S5、S8时期的差异基因信息,为后续研究红掌佛焰苞花色基因功能等奠定基础;测序结果结合实时荧光定量PCR试验,得到控制红掌佛焰苞花青素生物合成途径中的11条关键基因序列,并对其中的4条基因进行表达量分析,得到C4H、CHI、DFR、F3H是控制红掌佛焰苞颜色变化的关键基因,S3时期是红掌花青素合成的高峰期,为红掌佛焰苞花色基因定位、全长克隆及相关基因转录因子的研究打下基础。
参考文献:
[1]Gantait S,Mandal N,Bhattacharyya S,et al. In vitro mass multiplication with pure genetic identity in Anthurium andreanum Lind[J]. Plant Tissue Cult Biotech,2008,18(2):113-122.
[2]戴思兰. 园林植物遗传学[M]. 北京:中国林业出版社,2005:179-186.
[3]Iwata R Y,Tang C S,Kamemoto H. Concentration of anthocyanins affecting spathe colour in Anthuriums[J]. J Am Soc Hort Sci,1985,110(3):383-385.
[4]Martin C,Gerats T. Control of pigment biosynthesis genes during petal development[J]. The Plant Cell,1993,5(10):1253-1264.
[5]Martin C,Jin H,Schwinn K. Regulation of phytochemicals by molecular techniques[M]//Romeo J T,Saunders J A,Matthews B F. Beltsville,Maryland,USA:Pergamon,2001:155-169.
[6]Holton T A,Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. The Plant Cell,1995,7(7):1071-1083.
[7]Liang P,Pardee A B. Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J]. Science,1992,257(572):967-971.
[8]Li B,Dewey C N. RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics,2011,12:323.
[9]Audic S,Claverie J M. The significance of digital gene expression profiles[J]. Genome Research,1997,7(10):986-995.
[10]Young M D,Wakefield M J,Smyth G K. Gene ontology analysis for RNA-seq:accounting for selection bias[J]. Genome Biology,2010,11(2):r14.
[11]Kanehisa M,Araki M,Goto S,et al. KEGG for linking genomes to life and the environment[J]. Nucleic Acids Research,2008,36(Database issue):D480-D484.
[12]Gopaulchan D,Lennon A M,Umaharan P. Identification of reference genes for expression studies using quantitative RT-PCR in spathe tissue of Anthurium andraeanum (Hort.)[J]. Scientia Horticulturae,2013,153:1-7.
[13]Mol J,Grotewold E,Koes R. How genes paint flowers and seeds[J]. Trends Plant Sci,1998,3:212-217.
[14]Winkel-Shirley B. Biosynthesis of favonoids and effects of stress[J]. Current Opinion in Plant Biology,2002,5(3):218-223.
[15]To K Y,Wang C K. Floriculture,ornamental and plant biotechnology advances and tropical issues[M]. Isleworth,UK:Global Science Books,2006:300-310.
[16]韩科厅,胡 可,戴思兰. 观赏植物花色的分子设计[J]. 分子植物育种,2008,6(1):16-24.
[17]Barber M S,Mitchell H J. Regulation of phenylpropanoid metabolism in relation to lignin biosynthesis in plants[J]. Int Rev Cytol,1997,172:243-293.
[18]李 波,梁 颖,柴友荣. 植物肉桂酰辅酶A还原酶(CCR)基因的研究进展[J]. 分子植物育种,2006,4(增刊1):55-65.
[19]Millar D J,Long M,Donovan G,et al. Introduction of sense constructs of cinnamate 4-hydroxylase (CYP73A24) in transgenic tomato plants shows opposite effects on flux into stem lignin and fruit flavonoids[J]. Phytochemistry,2007,68(11):1497-1509.
[20]Li F,Jin Z,Qu W,et al. Cloning of a cDNA encoding the Saussurea medusa chalone isomerase and its expression in transgenic tobacco[J]. Plant Physiology and Biochemistry,2006,44(7/8/9):455-461.
[21]Owens D K,Mclntosh C A. Biosynthesis and function of Citrus glycosylated flavonoids[M]. New York:Springer,2011:67-95.
[22]Martens S,Teeri T,Forkmann G. Heterologous expression of dihydronavonol 4-reductases from various plant[J]. Febs Letters,2002,531(3):453-458.
[23]Collette V E,Jameson P E,Schwinn K E,et al. Temporal and spatial expression of flavonoid biosynthetic genes in flowers of Anthurium andraeanum[J]. Physiologia Plantarum,2004,122(3):297-304.
