一种用于监控葡萄糖浓度的嵌入式光学生物传感器
2016-04-25丁涛,王芳
丁 涛,王 芳
(1.延安大学 陕西省化学反应工程重点实验室,陕西 延安 716000;2.延安大学石油学院,陕西 延安 716000)
一种用于监控葡萄糖浓度的嵌入式光学生物传感器
丁涛1,王芳2
(1.延安大学 陕西省化学反应工程重点实验室,陕西 延安 716000;2.延安大学石油学院,陕西 延安 716000)
摘要:由于在持续流动条件下连续监测血糖浓度较为困难,提出了2种硅橡胶(聚二甲基硅氧烷)光子生物传感器设计方法,分别是内部固定光子生物传感器和对内部固定光子生物传感器进行改进,将微珠腔与玻璃粉填充渠道综合的外部固定光子生物传感器。结果显示,前者内部固定光子生物传感器可检测浓度为0.26~5.00 mg·L(-1)的葡萄糖,R2=0.9905;后者通过外部固定联合方法固定大量的酶于玻璃粉上,加快了传感器腔内化学反应的速率,在连续流动情况下,可检测浓度为0.7~10.0 mg·L(-1)的葡萄糖,R2=0.9845。外部固定光子生物传感器在光子芯片实验室的在线分析方面具有广阔的应用前景。
关键词:葡萄糖;酶;玻璃粉(微珠);生物传感器
采用微系统技术的微流体设备在生命科学和生物医学领域有着独特的应用。目前,面向于一台集成在一个芯片上的微型化实验室装置或设备引起了许多研究人员的兴趣,陆续出现了很多微型设备(如泵、加气机、生物传感器等)[1-2]。在这些设备中,微生物传感器因对细胞、抗体、DNA和酶作用物(如葡萄糖、乙醇、过氧化氢等)的检测效果极佳而对于芯片实验室系统的发展影响重大[3]。
1962年,Clark和Lyons提出了葡萄糖酶电极[4]。自此,基于良好的经济前景预测,出现了很多葡萄糖生物传感器的设计和检测原理[5]。
第一代葡萄糖生物传感器为葡萄糖氧化酶(GOX)传感器[6]。GOX固定在聚丙烯酰胺凝胶上形成气体渗透膜覆盖电极[7],用电化学方法检测到氧气浓度降低,以此作为葡萄糖浓度降低的指示器。
由于检测的含氧量有波动,这种方法被电化学法检测氧化产物过氧化氢所取代[8]。但是在较高的阳极电位下检测过氧化氢或氧气时,容易氧化相邻的分子,导致这种生物传感器无法完全准确地用于葡萄糖浓度的检测。
为了解决这一难题,第二代传感器应运而生,这种传感器用其它浓度易控的氧化性介质取代氧气[9]。它们可以使酶的活性部分与电极表面发生反应,并且以电子的形式穿梭于酶与电极之间。电化学信号的检测取决于介质的氧化。这种系统使得传感不依靠于氧气,即如果系统中的氧不充分,葡萄糖浓度的检测可以独立于氧气。
光学微芯片生物传感器常用来与固定的葡萄糖氧化酶-辣根过氧化物酶(GOX-HRP)、醇氧化酶-辣根过氧化物酶(AOX-HRP)联合检测产生于蔗糖与固定酵母细胞的动态的葡萄糖和乙醇。即连续不断地监测流过传感器的固定联合酶,这种酶可以催化一系列的反应,以HRP催化发光氨的氧化产生化学荧光结束。同时发现,GOX-HRP生物传感器可以在正常情况下使用5d,而AOX-HRP传感器需要不断地校正以防止它随着时间的推移而失去活性。
另一方面,已成功生产出在硅橡胶基片上使用硅橡胶导波管制造的完整的光学葡萄糖传感器,并且得到测试。许多导波管用热的方法制造成表面被处理过的PDM单块集成电路导波管系统,并焊接在硅胶基片上[10]。然后它们被连接到一个发光二极管(LED)上,这个LED将波长小于450nm的光注入到导波管。在这个波段氧敏钌极易吸收染色并且发射波长小于610nm的光。这个传感系统使氧敏染色三异丙基乙磺酰和葡萄糖酶相结合。这个染色/酶系统使用逐层自组装的方法固定在导波管表面。染色/酶系统会与周围环境发生反应产生变化,使用的监控方法是检测端面与被注入到导波管中的光发生的反应。这种传感器整体灵敏度过低。传感器的低灵敏度和荧光强度有关,原因是叶片脱模故障和大多数分光仪的灵敏度较低。
最近的研究表明,微型生物传感器(如迷你/微米设备)具有快速分析、并行化、低成本、可移植性和微量的试剂消耗等优点。这种技术基于内外部联合固定的GOX和HRP在光激性葡萄糖生物传感器上得以实现。内部的固定联合是在内部传感器腔的硅橡胶表面,而外部的固定联合是在功能化硅胶的微小颗粒上[11]。外部的微小颗粒固定有很多优点,例如大的比表面积可以提高酶的活性。此外,大量的颗粒可以被固定,适用于多种芯片。与每个测试硅橡胶芯片直接固定技术相比,这种技术可以降低成本、缩短实验时间。
1原理
酶是具有生物催化功能的特殊蛋白质,可通过降低活化能加速生物化学反应,具有在不改变结构配置的情况下可以存活数反应周期的优点。检测葡萄糖使用了很多的组分酶,如GOX或葡萄糖脱氢酶。
GOX催化一系列的反应,使得基质被氧气氧化产生过氧化氢。在富氧条件下,GOX催化氧化葡萄糖生成葡萄糖酸和过氧化氢[4]。因此,通过检测氧气的消耗或者过氧化氢的生成,可以直接测定葡萄糖浓度。

在该研究中过氧化氢和HRP被看作是葡萄糖浓度测定的指示剂。HRP被广泛应用在生物化学领域,通常催化过氧化氢与基底反应发生显色或发光。反应式如下:

在所有实验中,3,3′,5,5′-四甲基联苯胺(TMB)被当作一个基底。借助于光学测定TMB的氧化形式分析浓度。
2实验
2.1材料与试剂
光阻SU-8 5和SU-8 50以及它们的甲基丙二醇溶液或醋酸酯(PGMEA)溶液,Micro Chem Corporation。弹性为184的硅橡胶硅酮树脂,Dow Corning公司。
葡萄糖氧化酶(GOX,G7141-50KU产品)、3,3′,5,5′-四甲基联苯胺(TMB)、醋酸盐缓冲溶液(pH=4.6)、辣根过氧化物酶(HRP,型号4)、醋酸钠缓冲溶液、磷酸盐缓冲溶液(PBS)、戊二醛,Sigma-Aldrich有限公司。
2.2传感器的制备
光子葡萄糖生物传感器采用紫外线(UV)光刻技术,使用SU-8光刻胶作为背面主体对硅橡胶模型进行软光刻处理。主体在厚度700 μm的钠石灰玻璃衬底上进行双面光刻处理。制备过程是:先把基底放在120 ℃电烤炉中加热1 h以清洁和脱水,然后在一个桶状的蚀刻器中进行氧等离子体活化。
光刻工艺的第一步是在衬底上将SU-8 5以3 000 r·min-1旋涂30 s,在95 ℃下干燥10 min。之后SU-8层溢出暴露在紫外光下,在95 ℃下烤10 min,得到一层厚度约5 μm的膜,可充当一个粘附促进剂和种子层结构。在结构的旋转涂布层之前, 种子层在氧等离子体中激活。
传感器主体使用SU-8 50光刻胶处理雕刻2次,每次用4 mL光刻胶以1 200 r·min-1瞄准平面板捻成丝状,然后在95 ℃下干燥,获得一层总厚度为230 μm的基底,暴露在紫外光下100 s并且在95 ℃下烤20 min。暴露的主体静置一夜后放入丙二醇甲醚醋酸酯(PGMEA)中。
这个主体的复制品是用硅橡胶加工成型的,硅橡胶预聚合物是用体积比为1∶10的固化剂与弹性基础混合。混合物除去气泡后灌入主体内部,在80 ℃下加热30 min,最终从主体上剥落。硅橡胶生物传感器模具固定在玻璃片上,然后连上进口和出口。
2.3固定联合方法
酶(HRP,GOX)的固定联合是直接影响葡萄糖传感器性能的一个关键因素。很多固定联合方法,如:简单吸附法、共价键结合法[聚乙二醇(PEG),在硅橡胶腔的内表面,酶与外部的功能硅微粒以共价键结合],都被检查使用过。固定联合方法直接影响到后续的操作。
2.3.1在硅橡胶上进行内部的固定联合
GOX和HRP直接共价固定在传感器腔硅橡胶的内表面。为了检查硅橡胶表面有效酶的固定,有2个检查程序:简单的化学吸附法和聚乙二醇(PEG)/11-三乙氧基硅基十一醛(11-TESU)共价捆绑法。
化学吸附法是最简单和快速的方法。在此过程中,0.001 mg HRP与0.001 mg GOX溶解在聚丁二酸丁二醇酯中,室温下在传感器腔中简单培养1 h。
使用PEG实现其它程序的目的是表面处理中避免酶盲目地绑定在硅橡胶上,同时改善固定联合的效果。PEG是一个线型高分子,结构简单,化学性质稳定,是一种惰性的具有生物相容性的物质。由于空间效应, PEG 表面排斥其它分子[12]。进入的分子不能被吸附,如静电力和不能穿透含水的PEG层,导致惰性亲水表面缺少“粘性”。PEG作为洗涤剂可防止非特异性酶(如HRP)与其表面结合[13]。
固定联合过程首先要用乙醇和蒸馏水仔细清洗传感器内腔。之后,将1 mg的PEG/聚乙烯醇(PVA)溶解到1 mL蒸馏水中。PEG在水中可直接溶解,但PVA要溶解到热水中。溶液在常温下放到洗过的传感器腔内培养1 h。冲洗PEG/PVA,用2%三乙胺和2%11-TESU溶液进行盐化作用。首先分别溶解1 mL三乙胺到45 mL蒸馏水中、溶解1.1 mL 11-TESU到48.9 mL乙醇中。然后将这2种溶液按1∶1充分混合,室温下在系统中培养1 h。此前,系统用乙醇清洗过,并在电炉中80 ℃下加热2 h。在此期间,将1 mg HRP、1 mg GOX和1 mg硼氢化钠溶解在10 mL的聚丁二酸丁二醇酯中。最后将准备好的溶液在系统中培养1 h。
2.3.2在微珠上进行外部的固定联合
外部固定联合方法是将HRP和GOX共价固定在功能化的二氧化硅微珠表面。HRP和GOX首先被固定,然后微珠注入到微珠充填腔。
外部固定联合首先将1.5 g二氧化硅微珠与10 mL 2.5%的戊二醛溶液混合并在室温下振荡90 min,然后加入2 倍的水混合充分。再用离心机全速分离10 min。丢弃悬浮层,重复进行3次。同时制备酶溶液,溶解10个单位的HRP和10个单位的GOX到0.1 mol·L-1的聚丁二酸丁二醇酯中。外部的固定联合通过将酶溶液加到预先制备好的微珠并且在室温下培养1 h完成。溶液4 ℃下保存,备用。
微珠表面的外部固定联合比内部固定联合方法更有优势。相对体积来说,比表面积的高增长使得大量的酶在微珠表面固定联合,尤其是在酶与被分析物的交互区固定联合。这样能使腔室内的化学反应在数量和比率上具有很好的效果。除此之外,由于使用了戊二醛的解决方案,外部的固定联合可提供强大的附着在微珠表面的共价酶。
2.4传感器的设计
光学生物传感器通过硅橡胶软印法进行微制备,由玻璃基底和生物传感器主体组成。
内部生物传感器主体由传感器腔、流体入口、出口、分配以及光纤通道组成(图1)。传感器主体包括入口和出口通道,作用是使流体在传感器内部流动。流体分流通道的设计目的是使流体能够均匀分布于传感器腔室。光纤通道垂直布置在传感器腔室,这些通道设计成扣件的形式,目的是在通道上更好地固定光纤,这些通道末端是两面凹的镜头,借此光可以被集中,然后通过感受神经纤维输送结果。
外部生物传感器主体是由传感器腔、微珠腔、流体入口、出口和光纤通道组成(图2)。微珠腔设计在入口侧面,传感器室和狭窄的网格接壤。固定化的微珠通过一个单独的微珠充填通道连接到微珠腔,直接插入固定化的微珠。光纤通道垂直布置在传感器腔的两侧,末端是两面凹的微透镜。扣件型设计可以使光纤更平稳地进入通道,两面凹的微透镜可以调整光纤的数值孔径。

图1 内部生物传感器的结构
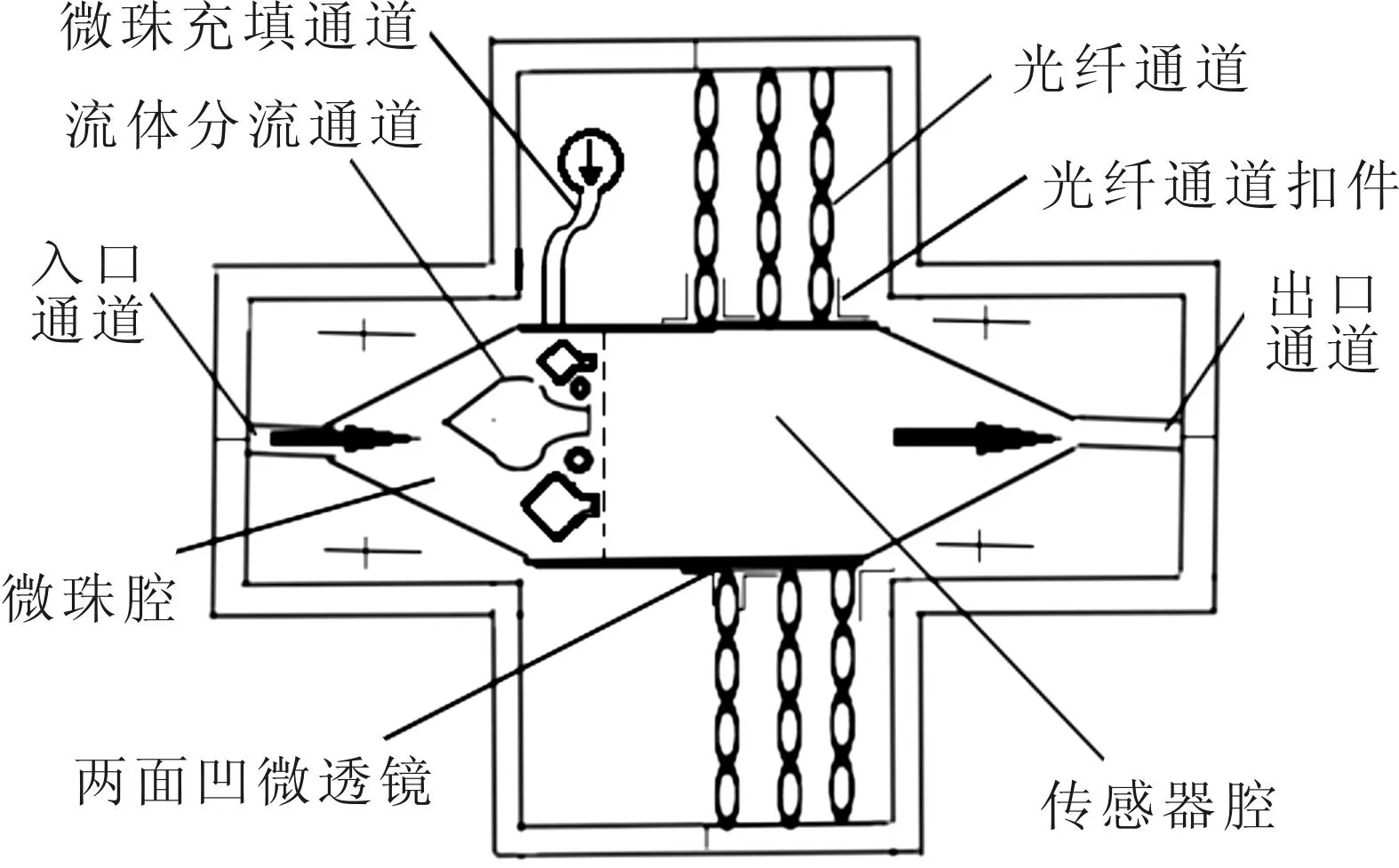
图2 外部生物传感器的结构
3结果与讨论
3.1测量装置
光子生物传感器表征实验通过2个直径为230 μm的多模光纤(光学元件,达豪,德国)、一个单色光源(S1FC635,光学元件)、一个分光仪进行。2个光纤首次插入到硅橡胶自调整光纤通道,一个连接光源,另一个连接分光器。因此,光-被分析物交互作用的光程与反应堆的宽度相同。如果被分析物在介质中被稀释并且没有二次发射的光子,这个光子生物传感器的性能遵循比尔-朗伯定律——吸光度与光程、浓度和摩尔吸收率成正比。
3.2测试结果
在研究中,内部和外部固定传感器设计已经通过测试。对于内部固定设计,检查程序:简单的化学吸附法和PEG/PVA。
直接固定酶在硅橡胶表面,并用聚丁二酸丁二醇酯清洗系统,检测简单的化学吸附法。吸光度的测量以TMB作为媒介,在过氧化氢减少的情况下,该媒介变为绿色。颜色的变化程度取决于光吸收,因此可提供关于葡萄糖浓度的信息。实验中,葡萄糖以33 μL·h-1流速不断被注入,在固定时间间隔内记录结果。结果表明,光学吸收测量结果波动很大,并且未获得有效的测量值。这可能与缺少表面预处理而导致的表面酶绑定不确定有关。
因此,第二个方法先使用盐化作用,然后采用PEG进行检测。执行与之前相同的检测程序。绘制吸光度与葡萄糖浓度的关系曲线(图3),结果发现吸光度和葡萄糖浓度线性拟合良好,传感器能够检测浓度为0.26~5.00 mg·L-1的葡萄糖,R2=0.9905。即表面修正和盐化步骤是有效的,提高了传感器的性能。

图3 葡萄糖吸光度校准曲线(15 min)
然而大量固定的酶是受限的,影响生物传感器检测范围。为了解决这一问题,改进了光子生物传感器,并对玻璃粉腔进行测试。首先,充填通道玻璃粉腔被固定的微珠颗粒填满,然后开始通道封闭检测过程,使用同样的测量方法。绘制吸光度与葡萄糖浓度的关系曲线(图4),结果发现吸光度与葡萄糖浓度线性拟合良好,传感器能够检测浓度为0.7~10.0 mg·L-1的葡萄糖,R2=0.9845。

图4 葡萄糖吸光度校准曲线(10 min)
外部固定传感器与内部设计相比提供了一个较宽的浓度测量范围,平均能获得多于一个的光谱。这个和高增长的固定比表面积有关,增加了固定在玻璃粉上的酶与被反应物之间的反应区域。表明,外部固定设计使用简单,是一种有效的固定方法。此外,外部固定方法可以简单地使不止一种酶固定在玻璃粉表面,不同的基底都可以被检测。从获得的光子结果推断,使用戊二醛作为外部固定酶到玻璃粉的交联剂,可以提高捆绑酶到玻璃粉的强度,对于增强基底的活性与特异性有着积极的影响。这与构造的维护保养、酶的活性部位和酶在固定步骤中非常细微的改变有关。
在传感器的设计过程中,使用固化方法对生物传感器的敏感性和性能都会产生较大的影响。
4结论
提出了2种在持续流动条件下基于内部与外部固定联合的葡萄糖氧化酶(GOX)和辣根过氧化物酶(HRP)的光子葡萄糖生物传感器设计。结果表明,内部光子生物传感器设计可检测浓度为0.26~5.00 mg·L-1的葡萄糖,相关系数为0.9905;通过外部固定联合方法能够固定大量的酶共价于玻璃粉,加快了传感器腔内化学反应的速率,在连续流动情况下,可检测浓度为0.7~10.0 mg·L-1的葡萄糖,相关系数为0.9845。该传感器在光子芯片实验室系统的在线分析方面具有广阔的应用前景。
参考文献:
[1]BUTTGENBACH S,BALCK A,DEMMING S,et al.Development of on chip devices life science applications[J].Int J Eng,2009,3(2):148-158.
[2] AL-HALHOULI A T,KILANI M I,BUTTGENBACH S.Development of a novel electromagnetic pump for biomedical applications[J].Sens Actuators A Phys,2010,162(2):172-176.
[3]CADAREO V J,FERNANDEZ-SANCHEZ C,LIOBERA A,et al.Optical biosensor based on hollow integrated waveguides[J].Anal Chem,2008,80(9):3498-3501.
[4] CLARK L C,LYONS C.Electrode systems for continuous monitoring in cardiovascular surgery[J].Annals of the New York Academy of Sciences,1962,102(1):29-45.
[5]WANG J.Glucose biosensors:40 Years of advances and challenges[J].Sensors Update,2002,10(1):107-119.
[6]UPDIKE S,HICKS G.The enzyme electrode[J].Nature,1967,214(5092):986-988.
[7]EGGIN B.Biosensors:An Introduction[M].Hoboken,NJ,USA:John Wiley & Sons Ltd,1996.
[8]FREIRE R S,PESSOA C,MELLO L,et al.Direct electron transfer:An approach for electrochemical biosensors with higher selectivity and sensitivity[J].J Braz Chem Soc,2003,14(2):230-243.
[9]DAVIDSSONG R,JOHANSSON B,PASSOTH V,et al.Microfluidic biosensing systems Part Ⅱ.Monitoring the dynamic production of glucose and ethanol from microchip-immobilised yeast cells using enzymatic chemiluminescrentμ-biosensor[J].Lab Chip,2004,4(5):488-494.
[10]CHANG-YEN D A,GALE B K.An integrated optical glucose sensor fabricated using PDMS waveguides on a PDMS substrate[C]//Micromachining and Microfabrication.International Society for Optics and Photonics,2004:98-107.
[11]CASIDAY R,FREY R.Drug strategies to target HIV:Enzyme kinetics and enzyme inhibitors,chemical kinetic experiment[Z].Washington University;St.Louis,MO,USA,2001.
[12]ZAREIE H M,BOYER C,BULMUS V,et al.Temperature-responsive self-assembled monolayers of oligo:Control of biomolecular recognition[J].ACS Nano,2008,2(4):757-765.
[13]SPERLING A,PARAK W J.Surface modification,functionlization and bioconjugation of colloidal inoganic nanoparticles[J].Phil Trans R Soc A,2010,368(1915):1333-1383.
A Kind of Embedded Optical Biosensor Used to Monitor Glucose Concentration
DING Tao1,WANG Fang2
(1.ShaanxiKeyLaboratoryofChemicalReactionEngineering,Yan′anUniversity,Yan′an716000,China;2.SchoolofPetroleum,Yan′anUniversity,Yan′an716000,China)
Abstract:Since it is difficult for continuously monitoring blood sugar in a steady flow,two silicon rubber (PDMS) photonic biosensors were proposed in this paper.One is an internal fixed sensor and the other is a modified version of this sensor,i.e.,the beads cavity with glass powder filling composite in the sensor channels.Results showed that,the internal fixed sensor could detect glucose in the concentrations region of 0.26~5.00 mg·L(-1) with R2 of 0.9905.The external immobilization method offered the possibility of covalently immobilizing huge amount of enzymes to micro-beads,which promoted the rate of chemical reaction taking place inside the biosensor cavity.External fixed sensor could detect glucose in the concentrations region of 0.7~10.0 mg·L(-1) with R2 of 0.9845 under a continuous flow.The results have a good application prospect in photon system online analysis.
Keywords:glucose;enzyme;micro-bead;biosensor
中图分类号:O 657.3
文献标识码:A
文章编号:1672-5425(2016)03-0063-05
doi:10.3969/j.issn.1672-5425.2016.03.017
收稿日期:2015-11-07
作者简介:丁涛(1982-),男,陕西渭南人,讲师,研究方向:微传感器设计,E-mail:dtguokong2013@163.com。
基金项目:陕西省教育厅自然科学专项(15JK1808)
