不同蛋白质糖比对草鱼幼鱼脂肪代谢及应激机能的影响
2016-04-25蒋阳阳李海洋何吉祥吴明林
蒋阳阳,李海洋,何吉祥,吴明林,任 君,李 智
(安徽省农业科学院水产研究所,安徽合肥 230031)
文献著录格式:蒋阳阳,李海洋,何吉祥,等.不同蛋白质糖比对草鱼幼鱼脂肪代谢及应激机能的影响[J].浙江农业科学,2016,57 (3):435-439.
不同蛋白质糖比对草鱼幼鱼脂肪代谢及应激机能的影响
蒋阳阳,李海洋,何吉祥*,吴明林,任 君,李 智
(安徽省农业科学院水产研究所,安徽合肥 230031)
文献著录格式:蒋阳阳,李海洋,何吉祥,等.不同蛋白质糖比对草鱼幼鱼脂肪代谢及应激机能的影响[J].浙江农业科学,2016,57 (3):435-439.
摘 要:试验研究了不同蛋白质糖比(P∶CHO)对草鱼幼鱼脂肪代谢及应激机能的影响。试验采用单因素设计,以饲料蛋糖比为影响因素,共配制了6组等脂等能饲料,对应的蛋糖比分别为2.00,1.50,1.14,0.88,0.67和0.50。试验鱼饲养于室内循环养殖系统中,日投喂3次,试验期为8周。结果表明,草鱼幼鱼血浆总胆固醇和甘油三酯含量随着饲料P∶CHO的下降显著升高。肝脏脂蛋白脂酶、肝脂酶、总脂酶、葡萄糖-6-磷酸脱氢酶和苹果酸酶活性均随着饲料P∶CHO的下降显著升高。肝脏总超氧化物歧化酶、过氧化氢酶和谷胱甘肽还原酶活性及丙二醛含量随着饲料P∶CHO的降低均呈先降低后升高趋势。血浆皮质醇含量随着饲料P∶CHO的降低呈先降后升的趋势,溶菌酶活性变化趋势与之相反。当饲料P∶CHO为0.88时,草鱼幼鱼血浆总蛋白及球蛋白含量均显著高于P∶CHO最低组,但与其他4组之间无显著性差异。试验表明,随着饲料糖水平的升高,过多的糖类可转化为脂类,最终导致血液中血脂含量的升高。此外,较高的蛋白质及糖水平均会引起草鱼应激反应,造成其免疫机能受损伤。
关键词:草鱼;蛋糖比;脂肪代谢;抗氧化;免疫
糖类是鱼类重要的非蛋白能量来源,在饲料中添加适量糖不但可节约蛋白质用量,还可在一定程度上促进鱼类生长。由于糖类的来源较为广泛,相对其他原料价格也更低廉,因此,在饲料中添加适量的糖可有效降低饲料成本[1]。不过,鱼类对糖类的利用率相对较低,过高含量的糖会抑制鱼类生长,引发其肝糖原和肝脂肪的大量蓄积,以及持续的高血糖症状[2],造成鱼类代谢负担过重,并最终降低其免疫力和对疾病的抵抗力[3]。
草鱼(Ctenopharyngodon idellus)属鲤科雅罗鱼亚科草鱼属,是我国大宗淡水养殖的重要品种之一。2013年全国草鱼养殖总产量达506万t,为淡水养殖品种产量之首[4]。草鱼养殖中为了追求经济效益会降低饲料成本,也会在饲料中添加较高水平的非蛋白能源物质来节约蛋白质用量,这部分非蛋白能源物质主要指脂肪和糖。目前,有关草鱼非蛋白能源物质替代蛋白质的研究已有相关报道,但主要是针对蛋能比[5]或糖脂比[6],而对蛋白质和糖配比的研究较少。鉴于此,本试验旨在通过研究饲料中不同蛋白质、糖配比对草鱼幼鱼血液和肝脏生化指标的影响,探讨糖替代蛋白质对草鱼幼鱼脂质代谢及健康机能的影响,为糖类物质在草鱼饲料中的合理运用提供相关理论依据。
1 材料与方法
1.1试验设计与试验饲料
试验设6组等脂等能饲料,脂肪水平固定为6%,蛋糖比(P∶CHO)分别为2.00,1.50,1.14,0.88,0.67与0.50,对应的蛋白质水平分别为40%,36%,32%,28%,24%和20%,糖水平为20%,24%,28%,32%,36%和40%。试验饲料以鱼粉、豆粕、菜粕和棉粕为蛋白源,以豆油和鱼油等比例添加为脂肪源,以糊精调节糖水平,以纤维素为填充物,配方及营养成分含量见表1。

表1 不同蛋糖比下试验饲料配方及营养成分含量 %
试验饲料的制作过程。将各种原料粉碎后按比例混合后,加入一定量的混合油和水,待充分混匀后制粒,饲料制成后自然晾干,并保存于-20℃冰箱中备用。
1.2试验用鱼及饲养管理
试验在安徽省农业科学院水产研究所岗集试验基地的循环养殖系统中进行,所用草鱼幼鱼由岗集试验基地培育。驯化1周后,将均重(7.02± 0.02)g的432尾体格健壮规格整齐的鱼随机分入18个圆柱形玻璃纤维缸(直径0.8 m)中,每缸24尾,即6组3重复。试验期间,每天定时投饵3次(7:30,12:00和16:30),每次投喂持续30 m in,投饵后1 h清除残饵。日投饵量为鱼体重的3%~6%,具体投饵量视摄食情况而定。根据鱼的生长和摄食情况,每周调整1次投饵量,养殖期为8周,每天定时(8:00和17:00)测定水缸内水体的温度、溶氧和pH值。每5 d给循环桶更换1/3的新鲜水,并定期测定氨氮和亚硝酸盐含量以确保水质清新。试验期间水温为24~30℃,溶氧>5.0 mg·L-1,pH值为7.0~7.5,氨氮含量<0.2 mg·L-1,亚硝酸盐<0.05 mg·L-1。
1.3样品的采集与分析
养殖试验结束时,将鱼禁食24 h。每缸随机选取8尾鱼用浓度为100 mg·L-1的MS-222麻醉,置冰盘上,尾静脉采血后解剖,分理出肝脏。采集的血液置于预先制好的肝素抗凝管中,于4℃下3 700 r·min-1离心10 min,收集上清液,标号后分装于-70℃冰箱保存备测。肝脏采集后用4℃预冷的生理盐水冲洗干净,然后用滤纸吸干,-70℃冷藏备用。
肝脏组织匀浆液制备方法。将肝脏从冰箱取出后准确称重,按质量体积比加入9倍体积的浓度为0.86%的生理盐水(经4℃预冷)后立即进行冰浴匀浆。匀浆结束后,将匀浆液于4℃下2 000 r· min-1离心10 min,收集上清液。
1.4数据统计与分析
原始数据经Exce1初步整理后,用SPSS 17.0对数据进行单因素方差分析,用Duncan氏多重比较分析组间的差异显著性,显著水平定为P<0.05。
试验数据用平均值±标准误表示。
2 结果与分析
2.1饲料蛋糖比对草鱼幼鱼脂肪代谢的影响
由表2可知,草鱼幼鱼血浆总胆固醇(TCHO)和甘油三酯(TG)含量随着饲料P∶CHO的下降显著升高。其中,P∶CHO为0.50组的TCHO含量显著高于2.00和1.50组;而P∶CHO 为0.50和0.67组的TG含量显著高于其他4组。草鱼幼鱼肝脏脂蛋白脂酶(LPL)、肝脂酶(HL)和总脂酶(TL)活性均随着饲料P∶CHO的下降显著升高。其中,P∶CHO为0.50组的LPL活性显著高于2.00和1.50组;P∶CHO为0.50和0.67组的HL活性显著高于2.00组;P∶CHO为0.50和0.67组的TL活性显著高于除0.88组外的其他3组。草鱼幼鱼肝脏葡萄糖-6-磷酸脱氢酶(G6PDH)和苹果酸酶(ME)活性随着饲料P∶CHO的下降均显著升高。其中,P∶CHO为0.50和0.67组的G6PDH活性显著高于除0.88组外的其他3组;P∶CHO为0.50和0.67组的ME活性显著高于2.00 和1.50组。
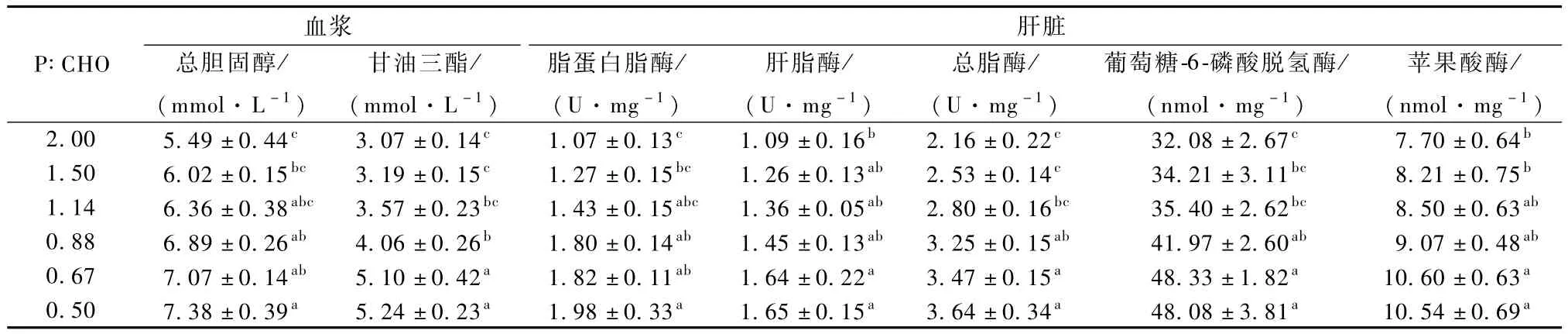
表2 饲料不同蛋糖比对草鱼幼鱼脂肪代谢的影响
2.2饲料蛋糖比对草鱼幼鱼肝脏抗氧化机能的影响
由表3可知,随着饲料P∶CHO的降低,草鱼幼鱼肝脏总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和谷胱甘肽还原酶(GPX)活性呈先降后升的趋势。其中,P∶CHO为0.50组的T-SOD和CAT活性显著高于除0.67组外的其他4组;P∶CHO为0.50组的GPX活性显著高于除0.67和2.00组外的其他3组。草鱼幼鱼肝脏丙二醛(MDA)含量变化趋势与3种抗氧化酶活性变化趋势相似,P∶CHO为0.50组的MDA含量显著高于除0.67组外的其他4组。
2.3饲料蛋糖比对草鱼幼鱼免疫机能的影响
由表4可知,随着饲料P∶CHO的降低,草鱼幼鱼血浆皮质醇含量呈先降后升的趋势,P∶CHO 为1.14组显著低于0.67和0.50组,与另3组无显著性差异。血浆溶菌酶活性随饲料P∶CHO的降低呈先升后降的趋势,P∶CHO为1.14组显著高于除1.50和0.88组外的其他3组。当饲料P∶CHO 为0.88时,草鱼幼鱼血浆总蛋白及球蛋白含量最高,二者均显著高于P∶CHO最低组,但和其他4组之间无显著性差异。
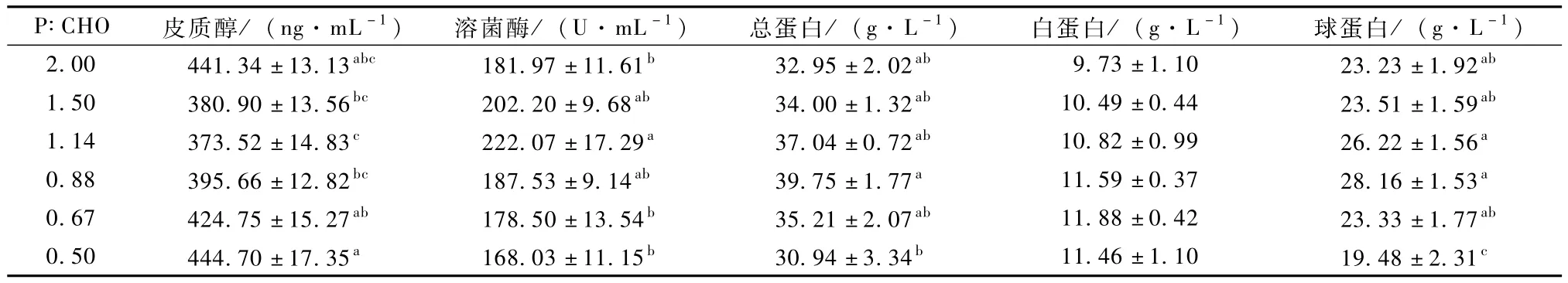
表4 饲料蛋糖比对草鱼幼鱼免疫机能的影响
3 讨论
3.1饲料蛋糖比对草鱼幼鱼脂肪代谢的影响
鱼类血液指标被广泛运用于评价鱼体健康状况、营养状况及对环境的适应状况,是一种良好的生理、病理和毒理学指标[7]。血浆中的脂类可间接反映鱼体脂肪代谢的状态,因为鱼类吸收外源性食物中的脂类运输到肝脏组织、肝脏组织中合成的内源性脂肪运出到肝外及脂肪组织的动员都是通过血液来完成的[8]。本试验中,随着饲料糖水平的升高,草鱼幼鱼血浆TCHO和TG含量呈升高趋势,说明鱼体摄入过多糖会使体内的脂肪转运变得更为活跃[9]。原因可能是饲料糖水平的升高造成草鱼幼鱼脂肪代谢负担,为了降低其对机体健康机能的损伤,肝脏反射性地对脂肪代谢进行一定的调整,并最终表现为对脂肪的分解和转运速度加快[10]。此外,TCHO和TG含量随饲料糖水平的升高呈现升高趋势,表明鱼体内过量的糖类可转化为脂类,最终导致血液中血脂含量的升高[11]。
LPL和HL在机体的脂肪吸收过程中发挥着重要作用。二者的结构虽然高度相似,但在脂肪代谢过程中发挥的作用却不同[12]。LPL合成后被释放到肝外组织毛细血管细胞内皮表面,在这里催化血浆中乳糜微粒和极低密度脂蛋白中的甘油三酯水解,释放出的游离脂肪酸会被其他脂肪组织吸收储存或被肌肉组织分解供能[13]。而HL则存在于肝内皮细胞表面,主要参与中密度脂蛋白和高密度脂蛋白代谢[14]。本试验中,肝脏LPL活性随饲料P∶CHO的下降显著升高,说明适当降低饲料中蛋白质水平可促进草鱼幼鱼对甘油三酯的分解供能,从另一侧面反映出脂肪对蛋白质的节约作用。HL活性随饲料P∶CHO的下降显著升高,表明当饲料蛋白质水平较低时草鱼幼鱼对脂肪的分解利用得到增强,机体内脂肪转运可能加快。
鱼类脂肪酸的合成主要在肝脏中进行。NADPH是合成脂肪酸所必需的原料,主要由G6PDH通过磷酸戊糖途径产生,或由ME催化苹果酸氧化脱羧生成丙酮酸的过程中产生。因此,G6PDH和ME是参与脂肪合成的重要酶,其活性高低可反应葡糖糖转化为脂肪的程度强弱[15]。试验发现,增加饲料中的碳水化合物水平草鱼肝脏组织中G6PDH和ME的酶活性有显著性的升高。由此可推断,在饲料能量一致的前提下,随着饲料中糖比例的增加及蛋白比例的降低,脂肪合成作用明显增强,从而导致鱼体脂肪蓄积量的增加,说明糖类比蛋白质更易引起鱼体内脂肪的蓄积。同样的结果在其他学者的研究中也呈现[16]。
3.2饲料蛋糖比对草鱼幼鱼肝脏抗氧化机能的影响
细胞在正常的新陈代谢过程中会产生一定数量的活性氧,而同时机体中也存在一套清除活性氧的机制。正常情况下,二者保持着动态平衡。然而,当机体受到负面因素的影响时,就会产生大量的活性氧。若此时活性氧的产生量大于机体对其的清除能力,就会对机体造成氧化损伤[17]。T-SOD,CAT 和GPX是机体抗氧化机制的重要组成部分,在自由基的清除过程中扮演着重要作用。当机体中的活性氧含量增加时,3种抗氧化酶活性会随之增加以促进活性氧的分解,并降低对机体的损伤,因此,其活性的变化可以反映机体抗氧化反应能力的强弱[18]。本试验中,随着饲料P∶CHO的降低,草鱼幼鱼肝脏T-SOD,CAT和GPX均呈现先降低后升高趋势,表明高蛋白质及高糖均会使机体的氧化反应程度增强,对鱼体造成氧化损伤。
此外,脂质过氧化物MDA的含量可以说明细胞或组织脂质过氧化的情况。本试验中P∶CHO为0.50组草鱼幼鱼MDA含量显著高于除0.67组外的其他4组,说明较高糖水平会导致其组织中不饱和脂肪酸的氧化程度加重,此时肝脏可能受到氧化损伤[19]。
3.3饲料蛋糖比对草鱼幼鱼免疫机能的影响
皮质醇被认为是应激反应的良好指标,当机体处于应激反应时,血浆中皮质醇的含量会显著升高[20]。本试验中,草鱼幼鱼血浆皮质醇含量随着饲料P∶CHO的降低呈先降低后升高趋势,说明饲料中高蛋白质及高糖水平均可诱导皮质醇分泌,高蛋白及高糖饲料可能对鱼体产生了一定的应激。
有报道指出,长期的应激反应会伤害机体的免疫器官,在所有评价免疫性能的指标中,溶菌酶活性及球蛋白含量尤其重要。溶菌酶是一种碱性蛋白酶,由嗜中性粒细胞和巨噬细胞分泌,后被释放到血液及黏液中发挥溶菌效应,对革兰氏阳性菌具有较强的杀灭作用[21],而血浆总蛋白由白蛋白和球蛋白组成,二者在鱼类的免疫应答中起重要作用[3]。一般情况下,当鱼体的免疫机能增强时,其体内的溶菌酶活性、血浆总蛋白和球蛋白的含量升高[22]。本试验中,血浆溶菌酶活性、总蛋白及球蛋白含量随饲料P∶CHO的降低均呈先升高后降低趋势,说明饲料中过高的蛋白质及糖水平均会使草鱼幼鱼的非特异性免疫处于较弱的状态,会损伤其免疫机能。
参考文献:
[1]罗毅平,谢小军.鱼类利用碳水化合物的研究进展[J].中国水产科学,2010,17(2):381-390.
[2]HEMRE G I,MOMMSEN T P,KROGDAHL A.Carbohydrates in fish nutrition:effects on growth,g1ucose metabo1ism and hepatic enzymes[J].Aquacu1ture Nutrition,2002,8(3):175-194.
[3]ALEXANDER C,SAHU N P,PAL A K,et a1.Haematoimmuno1ogica1and stress responses of Labeo rohita(Hami1ton)finger1ings:effect of rearing temperature and dietary ge1atinized carbohydrate[J].Journa1 of Anima1 Physio1ogy and Anima1 Nutrition,2011,95(5):653-663.
[4]农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2014.
[5]DU Z Y,TIAN L X,LIANG G Y,et a1.Effect of dietary energy to protein ratios on growth performance and feed efficiency of juveni1e grass carp(Ctenopharyngodon idella)[J].Open Fish Science Journa1,2009,2(1):25-31.
[6]GAO W,LIU Y J,TIAN L X,et a1.Effect of dietary carbohydrate-to-1ipid ratios on growth performance,body composition,nutrient uti1ization and hepatic enzymes activities of herbivorous grass carp(Ctenopharyngodon idella)[J].Aquacu1ture Nutrition,2010,16(3):327-333.
[7]周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海海洋大学学报,2001,2(2):163-165.
[8]向枭,陈建,周兴华,等.5种脂肪源对齐口裂腹鱼生长性能及血清生化指标的影响[J].动物营养学报,2010,2 (2):498-504.
[9]DU Z Y,LIU Y J,TIAN L X,et a1.Effect of dietary 1ipid 1eve1 on growth,feed uti1ization and body composition by juveni1e grass carp(Ctenopharyngodon idella)[J].Aquacu1ture Nutrition,2005,11(2):139-146.
[10]SHEIKHZADEH N,TAYEFI-NASRABADI H,OUSHANI A K,et a1.Effects of Haematococcus pluvialis supp1ementation on antioxidant system and metabo1ism in rainbow trout (Oncorhynchusmykiss)[J].Fish Physio1ogy and Biochemistry,2012,38(2):413-419.
[11]宋理平,韩勃,王爱英,等.碳水化合物水平对厚唇弱棘鯻生长和血液指标的影响[J].大连海洋大学学报,2010,4(4):293-297.
[12]NILSSON-EHLE P,GARFINKEL A S,SCHOTZ M C.Lipo1ytic enzymes and p1asma 1ipoprotein metabo1ism[J].Annua1Review of Biochemistry,1980,49:667-693.
[13]Santamarina-Fojo S,Haudenschi1d C,Amar M.The ro1e of hepatic 1ipase in 1ipoprotein metabo1ism and atherosc1erosis[J].Current Opinion in Lipido1ogy,1998,9(3):211-219.
[14]LINDBERG A,OLIVECRONA G.Lipase evo1ution:trout,Xenopus and chicken have 1ipoprotein 1ipase and apo1ipoprotein C-II-1ike activity but 1ack hepatic 1ipase-1ike activity[J].Biochimica Et Biophysica Acta,1995,1255(2):205-211.
[15]梁洪,钱云霞.食物对养殖鱼类脂肪代谢的影响[J].水产科学,2007,26(9):521-524.
[16]HEMRE G I,SHIAU S Y,DENG D F,et a1.Uti1ization of hydro1ysed potato starch by juveni1e At1antic sa1mon Salmo salar L.,when using a restricted feeding regime[J].Aquacu1ture Research,2000,31(2):207-212.
[17]TOCHER D R,MOURENTE G,VAN D E A,et a1.Effects of dietary vitamin E on antioxidant defence mechanisms of juveni1e turbot(Scophthalmus maximus L.),ha1ibut (Hippoglossus hippoglossus L.)and sea bream(Sparus aurata L.)[J].Aquacu1ture Nutrition,2002,8(3):195-207.
[18]AGRAHARI S,PANDEY K C,GOPAL K,et a1.Biochemica1 a1teration induced by monocrotophos in the b1ood p1asma of fish,Channa punctatus(B1och)[J].Pesticide Biochemistry and Physio1ogy,2007,88(3):268-272.
[19]ST ÉPHAN G,GUILLAUME J,LAMOUR F.Lipid peroxidation in turbot(Scophthalmusmaximus)tissue:effect of dietary vitamin E and dietary n-6 or n-3 po1yunsaturated fatty acids[J].Aquacu1ture,1995,130:251-268.
[20]MOMMSEN T P,VIJAYAN M M,MOON T W.Cortiso1 in te1eosts:dynamics,mechanisms of action,and metabo1ic regu1ation[J].Reviews in Fish Bio1ogy and Fisheries,1999,9(3):211-268.
[21]MÖCK A,PETERS G.Lysozyme activity in rainbow trout,Oncorhynchus mykiss(Wa1baum),stressed by hand1ing,transport and water po11ution[J].Journa1 of Fish Bio1ogy,1990,37(6):873-885.
[22]WIEGERTJES G F,STET R J M,PARMENTIER H K,et a1.Immunogenetics of disease resistance in fish:a comparative approach[J].Deve1opmenta1 and Comparative Immuno1ogy,1996,20(6):365-381.
(责任编辑:张瑞麟)
通信作者:何吉祥,E-mai1:1076371193@qq.com。
作者简介:蒋阳阳(1987—),男,安徽天长人,助理研究员,主要从事水产动物营养与饲料研究工作,E-mai1:kyyang1987 @163.com。
基金项目:安徽省农业科学院院长青年创新基金(14B0532,15A0516);科技创新团队(13C0506);现代农业产业技术体系建设专项(CARS-46-34)
收稿日期:2015-11-18
中图分类号:S963.16
文献标志码:A
文章编号:0528-9017(2016)03-0435-05
DOI:10.16178/j.issn.0528-9017.20160346
