蒸汽灭菌柜性能验证方法的建立和应用
2016-04-22李涛易禄荣周于胜冯雨艳唐琳
李涛,易禄荣,周于胜,冯雨艳,唐琳
(1.四川大学,成都,610065;2.成都蓉生药业有限责任公司,成都,610041)
蒸汽灭菌柜性能验证方法的建立和应用
李涛1,2,易禄荣2,周于胜2,冯雨艳2,唐琳1
(1.四川大学,成都,610065;2.成都蓉生药业有限责任公司,成都,610041)
摘要:检查并确认灭菌柜的运行和性能是否符合要求,查看空载情况下灭菌柜不同位置的热分布状况,确定灭菌过程中冷点的位置,设定灭菌程序的有关参数,用试验来证实灭菌运行的可靠性及灭菌程序的重现性,以确保灭菌后产品的污染率低于10(-6)。本文分析了空气泄漏试验、B-D测试、空载热分布、负载热穿透、生物挑战性试验等方法。得到的试验结果均符合要求,芽孢灭活试验结果均为阴性。
关键词:蒸汽灭菌柜;性能验证;空气呼吸器灭菌效果确认;空气泄漏试验;B-D测试;空载热分布;负载热穿透;生物挑战性试验
引言
根据现行GMP[1]要求,药品生产中所使用的灭菌设备,安装、调试结束后,在正式投入使用之前和使用一定时间后必须对其性能进行确认,以证明该设备能够达到去除生物污染的目的。查阅国内外相关资料发现,现有的部分蒸汽灭菌柜验证中未对灭菌结束后通入的洁净压空的无菌性进行验证,导致腔体内已灭菌物品存在一定的被污染风险[2-4]。在本验证方案中,我们增加了对灭菌柜空气呼吸器灭菌效果的确认来保证灭菌结束后通入腔体的的洁净压空的无菌性,防止已灭菌物品受到污染。依据本方案,我们对公司的FEDEGARI蒸汽灭菌柜(型号FOM4/9 ESTRA5)灭菌效果进行了验证。通过该验证试验,建立起一套切实可行的验证方案和试验方法,为今后验证工作的进一步开展打下基础。
1 材料、方法及实验过程
1.1材料
材料包括仪器和指示剂两部分:
仪器有:Kaye validator 2000无线温度记录仪、MILLPORE完整性测试仪;
指示剂包括Pro Chem B-D测试包、灭菌生物指示剂(Bacillus stearothermophilus(ATCC7953)。
1.2方法
方法包含五个步骤:
(1)织物灭菌程序
最低温度121.0℃,控制温度122.0℃,最高温度123.0℃、灭菌时间30分钟、脉动次数3次;
(2)空气呼吸器灭菌效果确认
该蒸汽灭菌柜在灭菌程序结束时,会通过空气呼吸器除菌滤芯通入洁净压缩空气来平衡腔体内压力,以确保腔体内压力与大气压相等,保障操作安全。为保证灭菌腔体内灭菌后物品不受到进入的洁净压空的污染,所以需要对空气呼吸器的灭菌效果进行确认;
(3)空气滤芯完整性测试
将空气除菌滤芯安装入呼吸器内,从呼吸器的进口端加入注射用水将滤芯完全浸没,在进口端留一段空气,连接洁净压缩空气管至滤器进气口,打开完整性测试仪,进行完整性测试,以确认蒸汽灭菌柜空气呼吸器除菌过滤洁净压缩空气所使用滤芯的孔径的完整性。压力恒定在1100mbar下,气体扩散值应0.1ml/min;
(4)空气呼吸器灭菌温度测试
方法:将前完整性合格的空气呼吸器安装至蒸汽灭菌柜进行蒸汽灭菌,并与生物挑战试验同时进行。在蒸汽灭菌柜空载状态下,将Kaye Validator 2000温度验证系统按图1所示的1、2、3点各放置一支测温探头,2号点Kaye Validator 2000测温探头与TE7温控探头放置一致,各点F015min,温度均能达到121.0℃,同时呼吸器内各点温度与各点平均温度相差±1.0℃;

图1 空气呼吸器灭菌试验KayeValidator2000测温探头位置摆放图
(5)空气呼吸器生物挑战性试验
蒸汽灭菌柜空载时,将三支灭菌生物指示剂(Bacillus stearothermophilus(ATCC7953)),芽孢菌含量达到106以上的生物指示剂编号后与Kaye Validator 2000温度探头放置一致置于呼吸器内,与空气呼吸器灭菌温度测试同时进行,以证明蒸汽灭菌柜呼吸器在正常灭菌操作时,该点在达到灭菌温度时灭菌柜呼吸器的灭菌效果。生物指示剂培养后应为阴性。
1.3空气泄漏试验
1.4B-D测试
将ProChem B-D测试包放置于蒸汽灭菌柜设备架子底部前面,排水通道上方。设定BD测试程序参数:脉动3次,真空脉动下限0.2bar,真空脉动上限1.5bar,每次脉动压力上下限增加0.1bar,灭菌温度121.0℃;测试包灭菌时间10分钟;运行程序一次。
1.5空载热分布试验
在空载状态下将Kaye Validator 2000均匀分布于蒸汽灭菌柜内,其中CH2放置于蒸汽灭菌柜的排气口内与灭菌柜T1温度探头一致,CH9与灭菌柜内T2温度探头放置一致,再按灭菌工艺要求参数(织物灭菌程序121.0℃ 30分钟)进行空载试验[5]。当脉动真空灭菌柜温度显示达到121.0℃记录时间,恒温10分钟再次分别记录各测温探头的时间和温度,找出空载热分布温度最低点的位置和灭菌腔室内空载热分布状态。灭菌阶段各点F015min,各点温度均应达到121.0℃,同时脉动真空灭菌柜腔室内各点温度与各点平均温度相差±1.0℃,

图2

图3
1.6负载热分布/热穿透试验/生物挑战试验
在模拟生产条件下的最大负载量状态下(负载中最上层重叠放置套洁净服30套,其他3层每层重叠放置40套洁净服),将Kaye Validator 2000无线温度记录仪均匀分布于蒸汽灭菌柜内被灭菌物品中最难灭菌的位置(其中CH2温控探头放置于蒸汽灭菌柜排气口位置,一支温控探头放置于以上实验确定的冷点位置),再按灭菌工艺要求参数分别进行负载热穿透试验[6]。Kaye温度探头布点时,应至少有一支探头与蒸汽灭菌柜温控探头放置于距离冷点位置。再将十二支灭菌生物指示剂(Bacillus stearothermophilus (ATCC7953)),芽孢菌含量达到106以上的生物指示剂编号后与Kaye温度探头放置一致置于灭菌物品包裹内。完毕后记录各点温度,找被灭菌物品的温度最低点的位置。该试验进行3次以检查其重现性。所有用于负载热分布的Kaye Validator 2000无线温度记录仪记录温度均应121.0℃,F015min,灭菌后生物指示剂培养后均应为阴性。
2 结果测试
2.1空气呼吸器灭菌效果确认
滤芯完整性测试结果如表1所示。空气呼吸器灭菌温度测试结果如表2所示。同时三支灭菌生物指示剂经培养后均为阴性。

表1 滤芯完整性测试结果
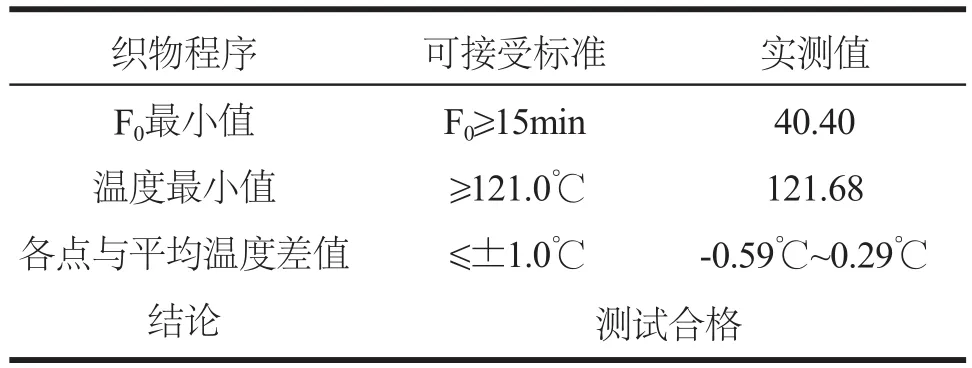
表2 空气呼吸器灭菌温度测试结果
2.2空气泄漏试验结果
在十五分钟内,腔室内压力变化40Pa/min。
2.3B-D试验结果
试纸显示颜色变成黑色,且颜色分布均匀。
2.4空载热分布结果
运行程序进入灭菌阶段后,用于空载热分布的Kaye Validator 2000无线温度记录仪记录温度均121.0℃,F015min,各点与平均温度差值±1.0℃,具体数据见表3。

表3 空载热分布试验结果
2.5负载热分布、热穿透试验及生物挑战试验结果
灭菌过程中,所有用于负载热分布的Kaye Validator 2000无线温度记录仪记录温度均121.0℃,F015min,灭菌后生物指示剂培养后均为阴性,具体数据见表4。
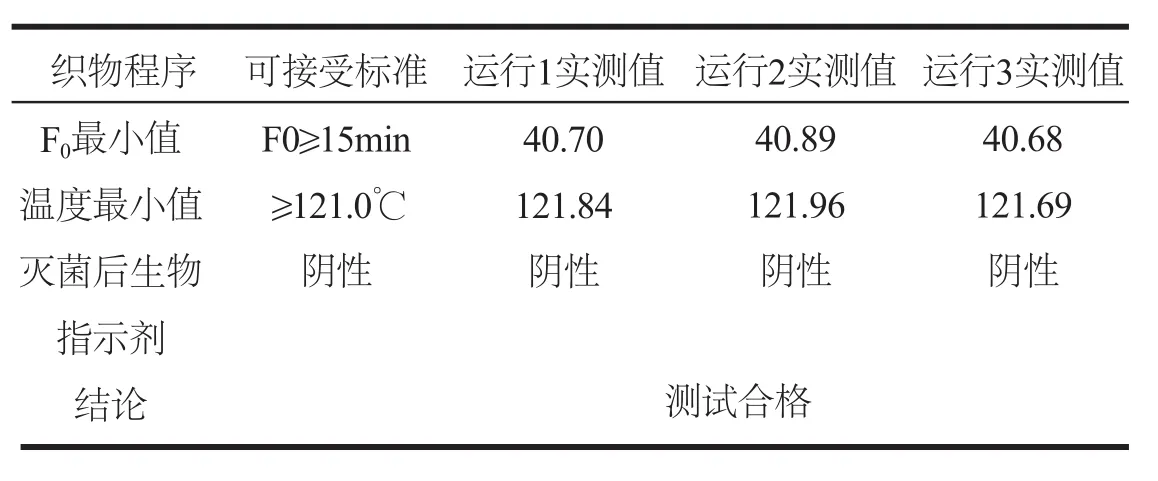
表4 负载热分布试验结果
3 研究与分析
在空气呼吸器灭菌效果确认中,滤芯的完整性测试、灭菌温度测试及灭菌后生物指示剂经培养后均为阴性,证明了空气呼吸器灭菌效果的有效性。
在空气泄漏试验中,腔体在十五分钟内,腔室内压力变化40Pa/min,证明了腔体密闭性能良好。
在B-D试验中,试纸经过灭菌处理后变为均匀的黑色。说明灭菌柜在抽真空脉动阶段已将灭菌腔及BD测试包内原有的空气全部抽出。
由负载热分布穿透试验结果可以看出,程序进入灭菌阶段后,各点温度均121.0℃,各点与平均温度差值±1.0℃,F040min,且灭菌后生物指示剂培养后均为阴性,说明对灭菌物品具备有效的热穿透能力。
4 结论
综上所述,公司的FEDEGARI蒸汽灭菌柜(型号FOM4/9ESTRA5)在整个灭菌过程中,空气呼吸器灭菌效果良好;温度分布均匀;真空度达到要求;在脉动阶段能将灭菌腔及灭菌物品原有空气全部抽出,灭菌物品各部位均被彻底有效灭菌。生物挑战试验进一步证明,各测试点指示菌被完全杀死。蒸汽灭菌柜的各项性能指标均达到生产要求,能投入生产使用,并由此建立起一套适合公司的蒸汽灭菌柜的性能验证方法。
通过这一系列试验确认了该灭菌柜的灭菌有效性,并由此建立起一套适合公司生产的蒸汽灭菌柜的性能验证方法,为今后的相关验证工作及生产车间的正常运转奠定了良好的基础。
参考文献
[1]药品生产验证指南国家食品药品监督管理局药品安全监管司/药品认证管理中心.2003[S]北京:化学工业出版社,2003.
[2]张清升.高压蒸汽灭菌柜验证中需注意的几个问题.齐鲁药事,2007,10.
[3]谢光宇.湿热灭菌柜生命周期各阶段的要点详解[J].机电信息,2013(32).
[4]张四海,彭贤东.湿热蒸汽灭菌柜验证方法的探讨[J].医疗装备,2013(02).
[5]李双民,唐丽萍,杨明,史刚.医用脉动真空蒸汽灭菌柜灭菌效果解决方案及应用研究[J].医疗装备,2015(03).
[6]韩韫,李意.立式自动高压蒸汽灭菌柜3Q验证方案研究.生物技术世界,2014年第08期.
唐琳,通信作者,四川大学生命科学学院植物发育生物学与生物技术博士。主要从事资源植物学与植物生物技术的研究工作。主持过自然科学基金及四川省科技攻关课题的研究工作。作为主研参加过多项“973”、教育部重点科研项目、国家“十一五”科技支撑项目的研究工作。从1999年开始对资源植物麻疯树开展研究,主要负责其资源评价和综合开发利用。
E-mail:tangL66@sina.com
李涛(1986-),现从事于血液制品行业,就职于成都蓉生药业有限责任公司,有7年的生产工作经验。同时为四川大学生命科学学院2012级在职研究生。
E-mail:395502833@qq.com
Establishment and Application of Performance Verification MethodforSteam Sterilizing Cabinet
Tao Li1,2,Lurong Yi2,Yusheng Zhou2,Yuyan Feng2,Lin Tang1
(1.Sichuan University,Chengdu,610065,China;2.Chengdu Rongsheng Pharmaceuticals Co.Ltd,Chengdu,610041,China)
Abstract:To check and confirm the performance of sterilization cabinet confirmed to meet the requirements,the view under the condition of no load sterilization cabinet in different position of heat distribution and determine the position of the sterilization process cold and set the relevant parameters of the sterilization process,test to confirm the reproducibility of the sterilization operation reliability and sterilization procedures,to ensure that the sterilized product contamination rate of less than 10(-6).Methods:air leak test,B-D test,no-load heat distribution,load heat penetration,biological challenge test method.Results:all the test results were in accordance with the requirements,and the inactivation test results were negative.Conclusion:the performance indexes of steam sterilization cabinet meet the production requirements,can be put into production and use,and thus establish a set of suitable for the company's steam sterilization cabinet performance validation method.
Key words:Steam sterilizing cabinet;Performance verification;Air respirator sterilization effect validation;Air leakage test;B-D test;No-load heat distribution;Load heat penetration;Biological challenge test
作者简介:
DOI:工业技术创新 URL:http//www.china-iti.com10.14103/j.issn.2095-8412.2016.01.008
中图分类号:R187
文献标识码:A
文章编号:2095-8412(2016)01-644-05
