α-酮酸酯类衍生物的合成研究进展
2016-04-22王文慧蒋筱莹刘吉伟谢媛媛浙江工业大学药学院浙江杭州3004浙江工业大学长三角绿色制药协同创新中心浙江杭州3004
王文慧,蒋筱莹,刘吉伟,谢媛媛,*(.浙江工业大学药学院,浙江 杭州3004;.浙江工业大学长三角绿色制药协同创新中心,浙江 杭州3004)
α-酮酸酯类衍生物的合成研究进展
王文慧1,蒋筱莹2,刘吉伟1,谢媛媛1,2*
(1.浙江工业大学药学院,浙江杭州310014;
2.浙江工业大学长三角绿色制药协同创新中心,浙江杭州310014)
摘要:α-酮酸酯及其衍生物是一种结构特殊的双官能团化合物,具有广泛的生物学活性,在食品、化妆品、有机合成及药物研发中具有重要意义。综述了α-酮酸酯及其衍生物的合成方法,并具体阐述了近年来研究报道的合成该类物质的新方法。
关键词:α-酮酸;α-酮酸酯;α-酮酰胺;有机合成
0 前言
α-酮酸酯及其衍生物是一类同时含有羰基和羧羰基的双官能团化合物,具有结构特殊,性质活泼,稳定性较差,易脱羧,较少在自然界存在等特点。由于其结构使得它比一般化合物显示出更为特殊的化学性质和生物学活性,广泛应用于食品、化妆品、药品及有机合成当中。特别是在药物研发中,α-酮酸酯及其衍生物具有各种酶抑制活性,从而表现出广泛的药理活性,如抗高血压[1]、抗肿瘤[2]、抗炎[3]、抗病毒[4]等等。由于该类物质具有较好的生物学活性和广泛的应用价值,已成为近年来生物化学和有机化学领域的研究热点之一,其合成方法更是层出不穷,在有机合成及药物研发中具有重要的意义。
1 合成路线
α-酮酸酯及其衍生物的合成方法主要有格氏试剂法、Friedel-Crafts酰基化法、双羰基化法、重排法、水解法、氧化法等,而近年来的合成研究主要以不同体系的氧化法为主,下面分别介绍合成α-酮酸酯及其衍生物的各种方法,并对其进行评价。
1.1格氏试剂法
1988年,Ramband[5]等人以烯基格氏试剂和草酸二乙酯为原料,一步合成了含烯基的α-酮酸酯类化合物(Scheme 1),其最高收率可达97%,产品纯度也较高。另外,也可以烷氧羰基酰基咪唑啉为原料,与格氏试剂反应生成相应的α-酮酸酯。
但该方法反应条件苛刻,需低温-80℃,较难控制,并且制备格氏试剂的反应条件也较严格,需无水无氧,高纯度氮气或氩气保护,操作困难,不适合大量生产,也会增加生产成本。

Scheme 1
1.2Friedel-Crafts酰基化法
Friedel-Crafts酰基化法是一种直接在芳环上引入羰基的有效方法。芳基α-酮酸酯类化合物的合成即可采用该方法,众多文献报道,合成芳基α-酮酸酯类化合物可采用草酰氯乙酯作为酰化试剂。
Xiang等人曾分别采用有溶剂作介质[6]及无溶剂研磨法[7]进行Friedel-Crafts酰基化反应(Scheme 2),得到了一系列芳基α-酮酸酯类化合物,其收率可达91%,之后再进行水解可得到一系列芳基α-酮酸。
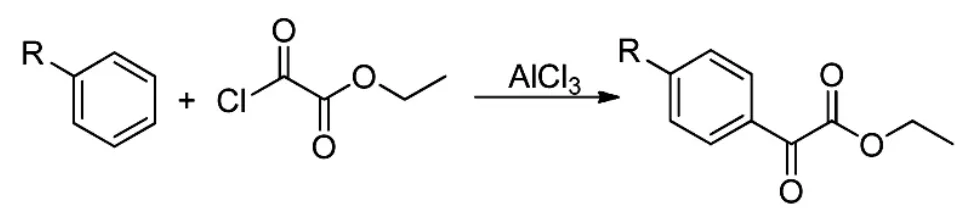
Scheme 2
2010年,Moon[8]等人在研究合成一类PGE2抑制剂-1H-呋喃-2,5-二酮和1H-吡咯-2,5-二酮衍生物的过程当中,也采用了Friedel-Crafts酰基化法合成中间体芳基α-酮酸酯(Scheme 3 I)。
同样的,Kim[9]等人在合成类似结构的选择性COX-2抑制剂过程中也采用了相同的方法来合成中间体芳基α-酮酸酯(Scheme 3 II)。
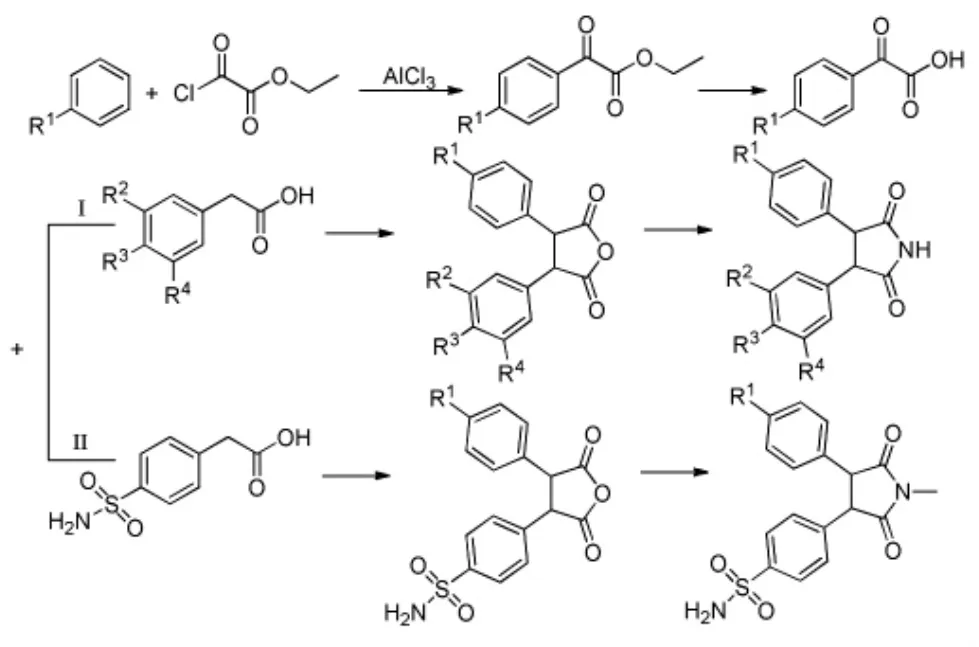
Scheme 3
Friedel-Crafts酰基化法具有反应步骤少,操作简便、收率较高、成本低等优点,是合成芳基α-酮酸酯类化合物的好方法。然而当苯环上含有强吸电子基(如-NO2、-SO3H)时,不能发生Friedel-Crafts反应,使得该方法的应用受到一定的限制。
1.3双羰基化法
1975年,Perron[10]首次报道了双羰基化合成α-酮酸酯类化合物的方法。该方法以苄氯和CO为原料,以Co2(CO)8作催化剂,在氢氧化钙存在下,反应得到了双羰基化的产物(Scheme 4),产率71.7%。该方法一步合成了α-酮酸酯,操作简便,产物易得。
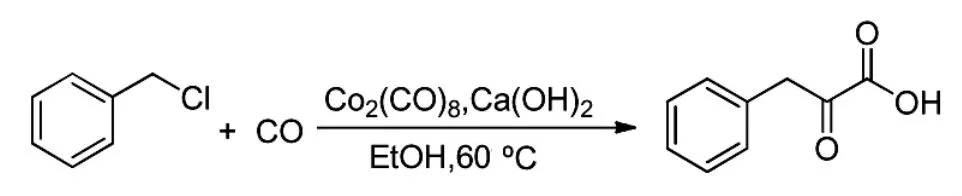
Scheme 4
该方法所用催化剂大多是八羰基二钴和钯的络合物,镧系和锕系元素络合物,或者是氯化钴等钴盐,其原料可以是芳基卤化物、苄基卤化物和乙烯基卤化物。其中钯催化的双羰基化法一般适用于芳基卤化物。Wang[11]等曾合成了钯的水溶性和非水溶性复合物,并用它们催化碘苯、一氧化碳和二乙胺在碱性条件下的双羰基化反应合成α-酮酰胺(Scheme 5)。
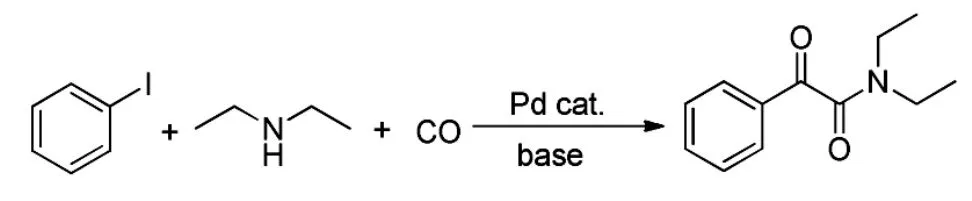
Scheme 5
而钴催化的双羰基化法适用范围更广,可催化芳基卤化物、苄基卤化物等。Li[12]等研究发现,用CoCl2作催化剂,在氢氧化钙和吡啶-2-甲酸钾的作用下,苄氯和一氧化碳可以发生双羰基化反应生成α-酮酸-苯丙酮尿酸(Scheme 6),此反应条件温和,产率高。
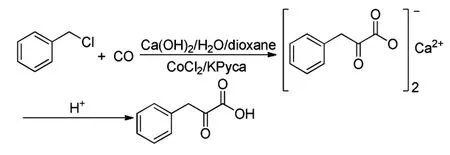
Scheme 6
双羰基化法虽然简便、高效,但使用的金属催化剂或需要配体、或价格昂贵,不符合绿色化学要求,其催化剂的利用率还有待提高。
1.4重排法
重排反应也是有机合成中的一类重要反应,通常涉及取代基由一个原子转移到同分子中另一个原子上的过程,其原子利用率较高。
早在1990年,Bable[13]等人研究了低温下碱促进的氰醇羧酸酯重排形成α-酮酸酯的反应(Scheme 7)。该方法需要较低温度,操作并不简便,收率也不高,普遍都在50%以上。
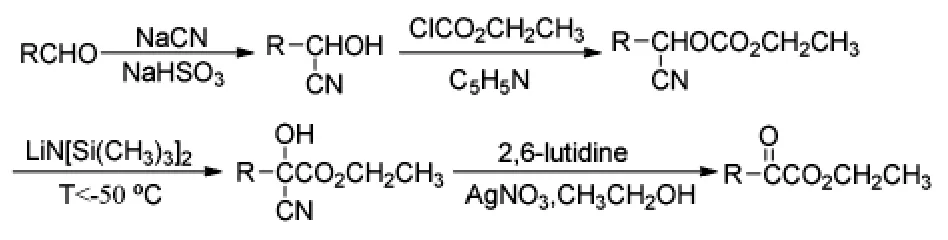
Scheme 7
2003年,Thasana[14]等采用了类似的底物芳基氰醇碳酸酯,以LDA为催化剂,经重排得到α-酮酸酯类化合物(Scheme 8),重排机理如Scheme 9所示。当取代苯基为吡啶基团时,也可采用同样的方法得到相应的α-酮酸酯。该反应条件苛刻,也需要低温,收率不高,在63%~76%之间。
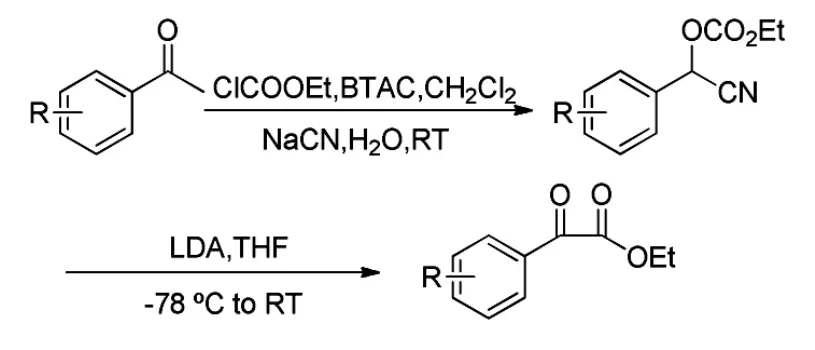
Scheme 8
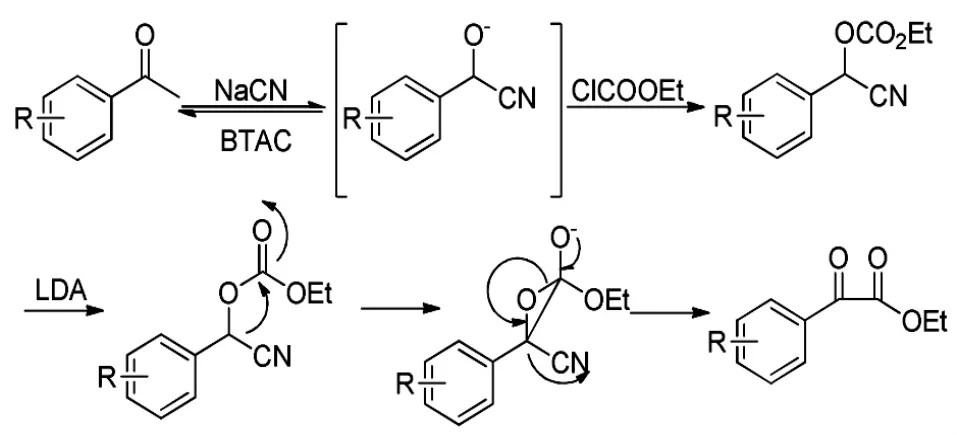
Scheme 9
1.5水解法
多种化合物都可以通过水解反应得到α-酮酸酯类衍生物,其中主要以羧酸酯或酮的α-衍生化为主。然而,其水解的底物往往需要通过其他的反应生成。
Nopporn[15]等报道了采用酰基氰化物水解的方法(Scheme 10)。但该方法使用了剧毒的无机氰化物,不符合绿色化学要求。
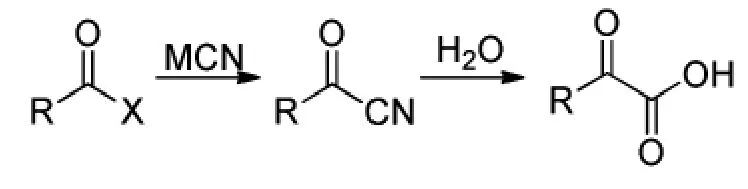
Scheme 10
此外,还可以通过水解芳基乙酮、α-酮酸肟、α-酮酸肟酯、α-羟亚胺酸酯、α-亚胺酸酯等底物来合成相应的α-酮酸酯,但是这些底物都需要通过其他较困难的方法来合成。水解法所需的原料不易得,单纯的使用该方法并不能普遍适用于α-酮酸酯类衍生物的合成,可以将该方法与其他合成方法相结合,在恰当的时机运用会达到更好的效果。
1.6氧化法
氧化法是最为普遍的合成方法,近年来,合成α-酮酸酯类化合物主要以氧化法为主,不同类型的氧化底物及氧化体系都发展得较为成熟。
α-羟基酸酯可以在氧化剂作用下较容易地氧化成α-酮酸酯。
2010年,Alamsetti[16]等用手性钴氧化α-羟基酸酯得到了α-酮酸酯和带有手性的α-羟基酸酯,但以手性产物为主(Scheme 11)。
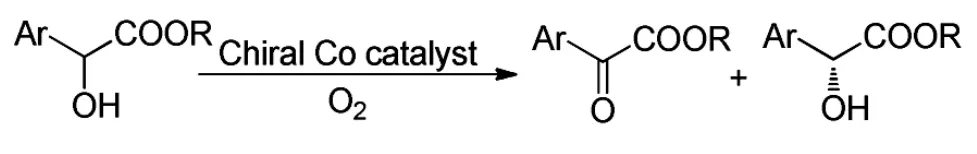
Scheme 11
2012年,Reddy[17]等用TEMPO和次氯酸钙氧化α-羟基酯得到相应的α-酮酸酯,产率高达99%。该反应未使用任何金属催化剂,未加入酸和碱,次氯酸钙的加入增强了TEMPO的氧化效果,使反应体系呈中性,反应条件温和(Scheme 12)。
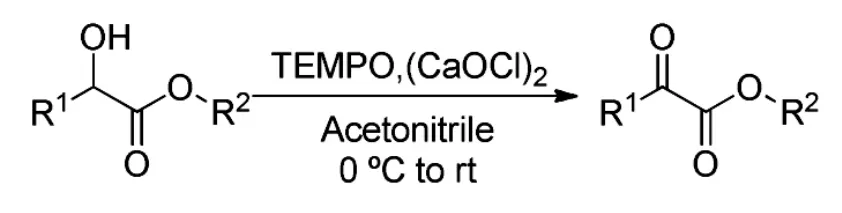
Scheme 12
含不饱和键的化合物如炔烃、端烯等也可在氧化剂存在的条件下氧化成α-酮酸酯类衍生物。
2011年,Nobuta[18]等在乙醚溴化镁作用下,用氧气和光照体系将炔烃氧化成1,2-二酮化合物(Scheme 13)。
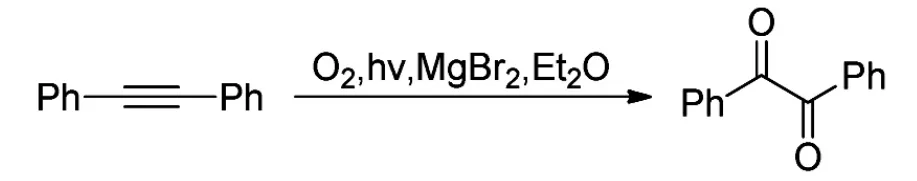
Scheme 13
2015年,Deshidi[19]等分别采用了有溶剂I2/ DMSO体系和无溶剂I2/TBHP体系对端烯进行氧化,均以较高的产率得到了α-酮酰胺类化合物,反应条件温和(Scheme 14)。
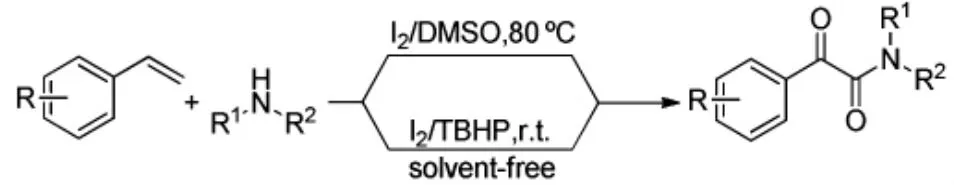
Scheme 14
含有活泼亚甲基的化合物也可以作为底物被氧化成α-酮酸酯类衍生物,比如1,3-二羰基类物质。2013年,Stergion[20]等采用过硫酸氢钾和三氯化铝体系将β-酮酸酯氧化成α-酮酸酯,该反应相比于传统的金属催化反应其反应条件更加温和,反应时间短,基本无副产物,产率可达98%(Scheme 15)。
此外,还有一些结构比较特殊的底物,也可以催化氧化成α-酮酸酯类衍生物。
2001年,Wong[21]等以二甲基二环氧乙烷为氧化剂,含腈基的一种Wittig试剂为原料,合成α-酮酸酯和α-酮酰胺,其反应时间短(少于5 min),操作简便,产率可达89%(Scheme 16)。
2007年,Shimizu[22]等以氰基甲酸乙酯和芳基硼酸为底物,在铑催化下合成α-酮酸酯,硼酸的加入提高了该反应的产率,其中铑可与芳基硼酸进行循环使用,产率可达87%(Scheme 17)。
2015年,Xu[23]等以铜盐为催化剂,催化取代苯乙酮与醇的反应得到相应的α-酮酸酯,铜盐可以进行循环使用,底物适用性较好,产率可达86%(Scheme 18)。
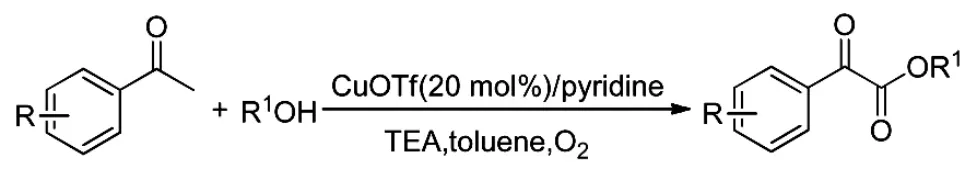
Scheme 18
2 小结
α-酮酸酯类衍生物具有广泛的生物学活性,同时也是一类重要的有机合成中间体,其在医药、食品、化妆品等领域都有较好的应用前景。α-酮酸酯类衍生物的合成方法主要有格氏试剂法、Friedel-Crafts酰基化法、双羰基化法、重排法、水解法、氧化法等,其中研究较多并且运用较普遍的方法是氧化法,底物适用性较广,氧化体系多样,反应收率良好。寻找高效、价廉易得、绿色无污染的催化剂和原料,研发出高效便捷、环境友好的α-酮酸酯类衍生物的合成方法,开发更适用于工业化的路线,具有十分重要的意义。
参考文献:
[1] Patel D V, Katherine R G, Ryono D E, et al. Activated ketone based inhibitors of human renin[J]. J. Med. Chem. , 1993, 36(17): 2431-2447.
[2] Strojan P, Budihna M, Smid L, et al. Cathepsin B and L and stefin A and B levels as serum tumor markers in squa mous cell carcinoma of the head and neck[J]. Neoplasma., 2001, 48(1): 66-71.
[3] Peet N P, Burkhart J P, Angelastro M R, et al. Synthesis of peptidyl fluoromethyl ketones and peptidyl α-keto esters as inhibitors of porcine pancreatic elastase, human neutrophil elastase, and rat and human neutrophil cathepsin G [J]. J. Med. Chem. , 1990, 33(1): 394-405.
[4] Nizi E, Koch U, Ponzi S, et al. Capped dipeptide α-ketoacid inhibitors of the HCV NS3 protease[J]. Bioorg. Med. Chem. Lett., 2002, 12(22): 3325-3328.
[5] Rambaud M, Bakasse M, Duguay G, et al. A One-step synthesis of alkyl 2-oxo-3-alkenoates from alkenyl grignard reagents and dialkyl oxalates[J]. Communications, 1988, 7: 564-566.
[6]向纪明,李宝林.芳基乙酮酸乙酯的合成新方法[J].有机化学, 2009, 29(3): 392- 395.
[7] Xiang J M, Li B L. Solvent-free synthesis of ethyl arylgly oxylates at room temperature[J]. Chin. Chem. Lett., 2009,20(1): 55-57.
[8] Moon J T, Jeon J Y, Park H A, et al. Synthesis and PGE2 production inhibition of 1H-furan-2,5-dione and 1H-pyrrole-2,5-dione derivatives[J]. Bioorg. Med. Chem. Lett., 2010, 20: 734-737.
[9] Kim K J, Choi, M J, Shin J S, et al. Synthesis, biological evaluation, and docking analysis of a novel family of 1-methyl-1H-pyrrole-2,5-diones as highly potent and selective cyclooxygenase-2(COX-2)inhibitors[J]. Bioorg. Med. Chem. Lett., 2014, 24: 1958-1962.
[10] Waters K L. The α- keto acids[J]. Chem. Revs., 1947, 41: 585-598.
[11] Wang Y, Yang X, Zhang C, et al. Phosphine-free, efficient double carbonylation of aryl iodides with amines catalyzed by water-insoluble and water-soluble n-heterocyclic car bene-amine palladium complexes[J]. Adv. Synth. Catal., 2014, 356(11-12): 2539-2546.
[12] Li G X, Li L, Huang H M, et al. One pot formation of catalyst and double carbonylation of benzyl chloride[J]. J. Mol. Catal. A. Chem., 2003, 193(1): 97-102.
[13] Babler J H, Marcuccilli C J, Oblong J E. Base promoted rearrangement of carbonate esters derived from aldehyde cyanohydrins: application to the synthesis of α-keto esters [J]. Synth. Commu., 1990, 20(12): 1831-1836.
[14] Thasana N, Prachyawarakorn V, Tontoolarugb S,et al. Synthesis of aryl α-keto esters via the rearrangement of aryl cyanohydrin carbonate esters[J]. Tetrahedron Lett., 2003, 44: 1019-1021.
[15] Nopporn T, Vilailak P, Sopchok T, et al. Synthesis of aryl α-keto esters via the rearrangement of aryl cyanohydrin carbonate esters[J]. Tetrahedron Lett., 2003, 44(5): 1019-1021.
[16] Alamsetti, S. K.; Sekar, G. Chiral cobalt-catalyzed enantioselective aerobic oxidation of α-hydroxy esters[J]. Chem. Commun., 2010, 46(38): 7235-7237.
[17] Reddy S R, Stella S, Chadha A. Simplified procedure for TEMPO-catalyzed oxidation: selective oxidation of alcohols,α-hydroxy esters and amides using TEMPO and cal cium hypochlorite[J]. Synth. Commun., 2012, 42: 3493-3503.
[18] Nobuta T, Tada N, Hattori K, et al. Facile aerobic photooxidative synthesis of α-diketones from alkynes[J]. Tetrahedron Lett., 2011, 52(8): 875-877.
[19] Deshidi R, Devari S, Shah B l A. Iodine-promoted oxidative amidation of terminal alkenes --synthesis of α-ketoamides, benzothiazoles, and quinazolines[J]. Eur. J. Org. Chem. ,2015: 1428-1432.
[20] Stergiou A, Bariotaki A, Kalaitzakis D,et al. Oxone-mediated oxidative cleavage of β keto esters and 1,3-diketones to α keto esters and 1,2-diketones in aqueous medium[J]. J. Org. Chem., 2013, 78: 7268-7273.
[21] Wong M K, Yu C W, Yuen W H, et al. Synthesis of α-keto esters and amides via oxidative cleavage of cyanoketophosphoranes by dimethyldioxirane[J]. J. Org. Chem., 2001, 66: 3606-3609.
[22] Shimizu H, Murakami M. Synthesis of α-keto esters by the rhodium -catalysed reaction of cyanoformate with arylboronic acids[J]. Chem. Commun., 2007: 2855-2857.
医药化工
[23] Xu X Z, Ding W, Lin Y G, et al. Cu-catalyzed aerobic oxidative esterification of acetophenones with alcohols to α ketoesters[J]. Org. Lett., 2015, 17: 516-519.
The Synthesis Development of α-Keto Esters
WANG Wen-hui1,JIANG Xiao-ying2,LIU Ji-wei1,XIE Yuan-yuan1,2*
(1.College of Pharmaceutical Sciences, Zhejiang University of Technology, Hangzhou, Zhejiang 310014,
China; 2.Collaborative Innovation Center of Yangtze River Delta Region Green Pharmaceutical,
Zhejiang University of Technology, Hangzhou, Zhejiang 310014, China)
Abstract:α-Keto esters and their derivatives are double functional compounds, they have special structure, which exhibit a broad range of biological activities including antiparasitic, anticancer and antiviral activities. Thus, they have great significance in food, cosmetic, organic synthesis and drug development. This article summarized several new synthetic methods of α-keto esters and their derivatives which have been reported in recent years.
Keywords:α-keto acids;α-keto esters;α-keto amines; synthesis
*通讯作者:谢媛媛(1976-)。E-mail:xyycz@zjut.edu.cn
作者简介:王文慧(1993-),男,汉族,本科在读,研究方向:药物中间体合成。
收稿日期:2015-11-01
文章编号:1006-4184(2016)3-0013-05
