DHAP胁迫对天山云杉幼苗生长过程中抗氧化酶活性的影响
2016-04-20刘润杨丽阮晓潘存德王强
刘润 杨丽 阮晓 潘存德 王强


摘 要:天山云杉(Picea schrenkiana)是新疆森林生态系统中的特有种,自然更新过程出现了阻碍,3,4-二羟基苯乙酮(3,4-dihydroxy-acetophenone,DHAP )已被确证是引起这一生态过程的主要自毒物质。为了揭示天山云杉天然更新障碍的内在生理机制,本文选择5个浓度梯度(0,1.0,2.0,3.0,5.0 mmol·L-1)DHAP处理天山云杉幼苗,以胚根长、胚芽长和鲜质量作为幼苗生长参数,测定天山云杉幼苗根尖细胞活力和6种抗氧化酶活力(SOD、POD、CAT、APX、GPX、GR)。结果显示,2.0 mmol·L-1 DHAP能显著促进天山云杉幼苗的胚根、胚芽和鲜质量生长,5.0 mmol·L-1 DHAP 显著抑制天山云杉幼苗的生长;天山云杉在DHAP浓度(c≤2.0 mmol·L-1)处理下,抗氧化酶SOD、CAT、APX、GPX、GR的活性随着DHAP浓度的升高而升高,POD的活性随着浓度的升高而下降,6种抗氧化酶协同作用以维持抗氧化酶防御系统的稳定; DHAP浓度(2.0 mmol·L-1 < c ≤5.0 mmol·L-1)处理后的前3 d,抗氧化酶SOD、CAT、APX、GPX、GR的活性随着DHAP浓度的升高而降低,POD的活性随着浓度的升高而升高,处理3 d后6种抗氧化酶活性与对照相比差异性显著但无规律,在此浓度范围内DHAP胁迫导致天山云杉生理机制紊乱,打破了正常的生长发育机制致使细胞加速死亡。DHAP通过影响天山云杉幼苗根尖细胞活力和抗氧酶活性,进而干扰天山云杉幼苗的正常生长,成为引发天山云杉天然更新障碍的一种因素。
关键词:3,4-二羟基苯乙酮;幼苗生长;抗氧化酶;根尖细胞活性
中图分类号:S718 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.04.001
Abstract: Schrenk spruce (Picea schrenkiana) is a major tree species in the forest ecosystems of Xinjiang , China. But the natural regeneration of P. Schrenkiana has been disturbed. 3,4-dihydroxy-acetophenone (DHAP) , a major autotoxic substance which separated from P. Schrenkiana needles, has effect on the growth. This experiment was to study the physiological mechanism of antioxidant enzyme defense system and to elucidate the underling regulation on natural regeneration barrier of P. Schrenkiana. The growth radical, plumule and fresh weight of the seedings that treated with DHAP were measured, the activity of antioxidant enzyme measured too. The results showed that 2.0 mmol·L-1 DHAP treatment had significant effect on the growth radicle, plumule, fresh weight and root cell viability, which significantly promote the seeding growth. But 5.0 mmol·L-1 DHAP treatment had significant inhibition on growth of P. Schrenkiana. 1.0 mmol·L-1 and 3.0 mmol·L-1 DHAP treatment could promote or inhibit the seedings growth, but there had no significant. The other result showed that DHAP could change the activity of antioxidant enzyme, such as super oxidedismutase (SOD), guaiacol peroxidase (POD), glutathione reductase (GR) and so on. It seems that at higher concentration, DHAP showed significantly effects on the activity of antioxidant enzyme except for POD, however the effects were not significantly at lower concentration.
Key words: 3,4-dihydroxy acetophenone (DHAP); seeding growth; antioxidant enzymes; root cell activity
植物化感作用是指植物通过向环境中释放一种或多种具有生物活性的化学物质,对周围植物(包括微生物)产生直接或间接的有害或有利的作用[1]。化感作用通常发生在种间[2-3],但同种植物间也存在化感作用,这种现象被称为自毒[4]。自毒作用广泛存在于植物森林生态系统中[5],已有研究发现赤松(P. densiflora)、白松(P. halepensis)、马尾松(P. massoniana)、红松(P. koraiensis)等分泌或分解的自身物质有干扰自身种子萌发、幼苗生长以及幼苗建成的现象[6],同时自毒作用也是引起森林天然更新障碍的重要原因[7]。
天山云杉(Picea schrenkiana)是亚洲中部针叶林中特有的云杉属植物种,主要分布在天山及昆仑山西北坡,是构成天山以及新疆森林生态系统的物质主体,对新疆山地水源涵养、水土保持,以及林区生态系统的形成与维护有着至关重要的作用[8]。全球气候变化和经济建设对森林物质产品需求的增长,以及人类活动对森林生态系统干扰强度的增加,导致天山云杉生产力下降、地力衰减及天然更新问题日益突出[9]。在无火干扰的有限时间森林自然恢复中,自毒作用可能是导致天山云杉更新障碍的主要因素[10]。Ruan等曾提出“天山云杉天然更新障碍的自毒作用”假说,并且证实了从天山云杉针叶和凋落物中分离纯化出的3,4-二羟基苯乙酮(DHAP)是引起天山云杉自毒作用的主要化学物质之一。那么,DHAP是如何从生理途径上影响天山云杉自然更新过程的呢?对DHAP是如何从生理学的途径影响天山云杉更新过程的探讨,将有助于进一步揭示自毒作用发生的内在规律。
越来越多的研究已经把化感物质看作一种生物胁迫,植物中存在的抗氧化酶系统对环境胁迫下植物体内活性氧清除起到极其重要的作用[11]。目前有关化感物质胁迫条件下对抗氧化酶活性变化的报道较少。从云杉凋落物水浸提取液有机层中分离出来的以云杉特定代谢物命名的对羟基苯乙酮(p-hydroxyacetophenone)能够影响其幼苗根系的生长[12],且表明自毒物质能够抑制幼苗的生长或者延迟其发芽和限制后代的繁殖[13]。 此外,从黄瓜根系中分离提取的化感物质(苯甲酸、肉桂酸)能显著激活POD、SOD、CAT等的活性[14],从而影响植株生长。有研究者对苜蓿幼苗不同器官的SOD、APX、CAT等抗氧化酶在干旱、盐渍等逆境胁迫下进行研究,结果表明,在逆境胁迫中抗氧化酶系统在苜蓿成苗过程中起着重要的保护作用。上述研究表明,化感物质能够响应自毒物质对植物幼苗的胁迫作用。但化感物质对植物幼苗生长过程中抗氧化酶调控作用的研究尚未见报道。本研究以胚芽长、胚根长和鲜质量的变化为参数,用4个浓度处理天山云杉幼苗,分时间段测定6种酶的活性变化,探讨天山云杉发生自毒作用的生理机制。
1材料和方法
1.1 材 料
天山云杉种子于2014年10月采自于新疆农业大学实习林场2林班(桦树沟N43°23′19″~N43°23′25″、E86°49′14″~E86°49′19″,海拔1 730~1 745 m)。3,4-二羟基苯乙酮(DHAP)购于上海百灵威科技有限公司,其他试剂均购于宁波杭景生物科技有限公司。
1.2 方 法
1.2.1 DHAP处理对种子萌发和幼苗生长的影响 选择籽粒饱满的天山云杉种子,用去离子水培养至胚根突破种皮,取100粒胚根突破的种子均匀摆放在铺有滤纸的25 cm×25 cm的培养盒内,加入10 mL不同浓度的DHAP处理液(对照组加入去离子水),每个处理设置3个重复。将培养盒放入人工气候培养箱,培养条件:光周期20 ℃,16 h;暗周期15 ℃,8 h;光强40 nmol·m-2·s-1。每3 d统计天山云杉幼苗的胚根长、胚芽长和鲜质量及测定抗氧化酶的活性,第12天结束试验。
1.2.2 根细胞活力测定 伊文斯兰染色法是测定根细胞活性的一种常用的方法[14],随机选择不同浓度DHAP处理的天山云杉幼苗,截取根尖处1.0 cm,用0.25% (w/v) 的伊文斯兰水溶液在30 ℃的暗环境下浸泡1 h;蒸馏水冲洗干净后,用N,N-二甲基酰胺(N,N-dimethylformamide)在30 ℃的暗环境下浸泡24 h,然后利用紫外线分光光度计测其在600 nm处的吸光度(Beckman DUO 640; Beckman Coulter Inc., Fullerton, CA, USA)。
1.2.3 酶活性的测定 参照Bai等[15]和Soares等[16]的提取方法并加以调整:每次从每个处理中随机称取0.1 g种子,加入1.0 mL含有EDTA的磷酸缓冲液研磨,用磷酸缓冲液冲洗研钵定容至10 mL,静置、取上清液于10 000 r·min-1离心20 min,4 ℃保存用于抗氧化酶活性的测定,测定方法参照张玉竹等[17]的抗氧化酶活性测定方法。
1.3 数据分析与处理
相对抑制率=(试验组-对照组)×100%。
采用Excel、SPSS、Sigmaplot软件对数据进行处理分析。利用单因素方差分析和最小显著差数法(Least signnificant difference, LSD)多重比较分析幼苗胚根长、胚芽长和鲜质量的差异。
2 结果与分析
2.1 DHAP处理对天山云杉幼苗胚根长、胚芽长和鲜质量的影响
试验结果如图1所示,DHAP处理对天山云杉胚根、胚芽和鲜质量的影响表现为促进和抑制两种:1.0 mmol·L-1和2.0 mmol·L-1的DHAP处理对天山云杉生长发育具有促进作用,且后者促进作用最为显著;3.0 mmol·L-1和5.0 mmol·L-1 DHAP处理对天山云杉生长发育有抑制作用,且后者抑制作用最显著。试验结果表明:天山云杉在低浓度的DHAP作用下能够更好地生长,但高浓度的DHAP胁迫下其正常生长受到了严重的抑制作用。
2.2 DHAP处理对天山云杉幼苗生长过程中根细胞活力的影响
伊文斯兰是一种细胞活性染料,常用于检测细胞膜的完整性和坏死的细胞[14]。如表1所示,与对照组相比,在3.0 mmol·L-1和5.0 mmol·L-1 DHAP 处理组伊文斯兰的吸收率远远高于其他处理组,且后者更为显著。1.0 mmol·L-1和2.0 mmol·L-1 DHAP处理组伊文斯兰的吸收率低于对照组,且后者更为显著。试验结果表明:5.0 mmol·L-1 DHAP处理组比3.0 mmol·L-1 DHAP处理组更容易诱导天山云杉根细胞死亡。1.0,2.0 mmol·L-1 DHAP处理组能够延缓天山云杉根细胞的死亡,尤其是2.0 mmol·L-1 DHAP处理组最为显著。
2.3 DHAP处理对种子萌发过程中抗氧化酶活性的影响
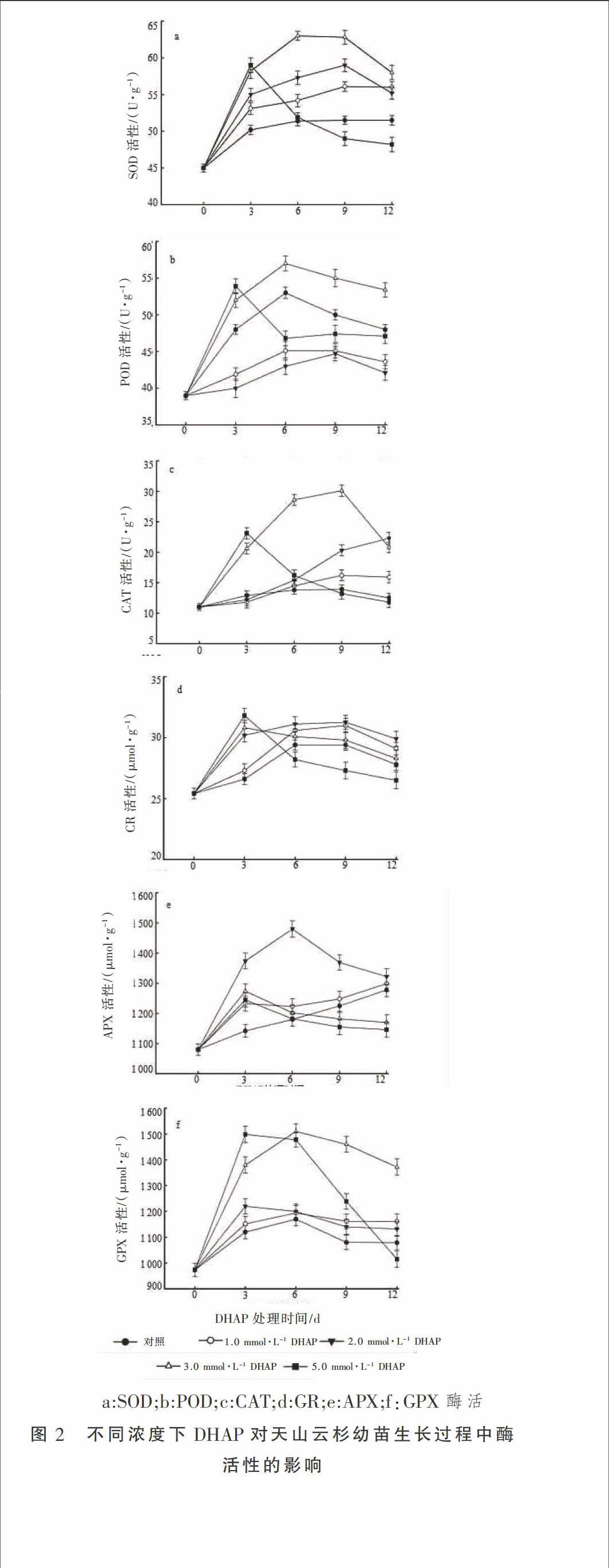
2.3.1 DHAP对天山云杉幼苗生长过程中SOD和CAT活性的影响 SOD在植物抗氧化防御系统中起主导地位,它的主要作用是将细胞内过量的 O2-转化为H2O2,H2O2 再通过CAT等协同作用来降低ROS对其细胞造成的氧化损伤,维持植物细胞正常的生理活动。由图2-a和2-c可以看出,天山云杉幼苗生长过程中对照组SOD和CAT的活性基本不变。与对照相比,在处理后的第3天 SOD和CAT活性随着DHAP浓度的增加而升高。5.0 mmol·L-1 DHAP 处理组SOD、CAT活性在3 d后开始大幅度下降,至第9 天比对照分别降低了4.85%和3.45%,1.0,2.0,3.0 mmol·L-1 DHAP处理组SOD、CAT活性变化如图2显示。由试验结果分析,天山云杉幼苗受到DHAP的胁迫时,植物细胞就会调节自身的代谢机制,升高SOD、CAT的活性消除过量的 O2-、H2O2以抵抗胁迫适应环境。5.0 mmol·L-1 DHAP 处理组的原因可能是高浓度的DHAP促使其代谢产生大量的ROS而得不到及时清除,使细胞发生毒害作用,导致抗氧化系统破坏,致使SOD、CAT活性迅速下降。因此,可以得出一定浓度的DHAP(2.0 mmol·L-1)能够促进SOD、CAT活性的升高,从而能更有效地清除过量的ROS,维持植物细胞正常的生理活动,但是高浓度的DHAP(≥3.0 mmol·L-1)则会引起植物产生大量的ROS,发生氧化损伤。
2.3.2 DHAP对天山云杉幼苗生长过程中POD活性的影响 POD在活性氧的代谢过程中也起着重要作用。由图2-b 可以看出,第3天1.0 mmol·L-1和2.0 mmol·L-1 DHAP处理组POD活性比对照分别降低了12.71%和16.67%,3.0,5.0 mmol·L-1 DHAP处理组POD活性比对照分别增加了8.33% 和12.29%。而5.0 mmol·L-1 DHAP处理组于第6天后POD的活性基本保持不变且低于对照组,原因同5.0 mmol·L-1 DHAP处理组SOD活性变化的原因一致。POD在细胞壁中可催化NADH或NADPH产生O2-,POD与CAT都具有代谢H2O2的功能,但在愈创木酚存在下其主要参与植物细胞的木质化和木栓化过程。POD的活性越高,其抗逆性就会越弱。由试验结果得出:2.0 mmol·L-1 DHAP处理组POD活性最低,最有利于植物细胞的生长发育,而5.0 mmol·L-1 DHAP处理组POD活性最高,说明该浓度能够加快细胞老化,3.0 mmol·L-1次之。
2.3.3 DHAP对天山云杉幼苗生长过程中APX、GPX和GR活性的影响 在植物体中,抗坏血酸-谷胱甘肽循环(AsA-GSH)是一个主要的H2O2清除系统。它由APX、GPX和GR相互调节代谢机制完成其生理功能,其中APX是最主要的清除酶且与H2O2有更好的亲和力。植物细胞中GPX的主要作用不是清除H2O2,而是参与新陈代谢的反应,如木栓化、木质化和IAA的分解。由图2-c可以看出,随着处理时间的增加,1.0 mmol·L-1 DHAP处理组变化趋势与对照相似,2.0 mmol·L-1 DHAP处理组APX的活性均高于其他试验组,3.0 mmol·L-1 和5.0 mmol·L-1 DHAP处理组都是在处理第3天达到最大值后开始下降,最终低于对照组。对此试验现象的解释是,2.0 mmol·L-1 DHAP 处理能够更好地促进APX代谢清除H2O2。3.0 mmol·L-1 DHAP和5.0 mmol·L-1 DHAP处理组为适应胁迫响应,APX活性升高,当植物细胞产生大量的ROS时,其细胞受到氧化损伤致使APX的活性开始大幅度的下降。
GPX和GR主要是完成AsA-GSH循环中GSSG和GSH的相互转化,GPX和GSH是由GR催化NADPH再生的,进而促进APX和CAT对H2O2的清除。由图2-e和2-f可以看出,在DHAP处理第3天,随着浓度的增大,GR和GPX活性变化趋势一致。在图2-e中,1.0 mmol·L-1 和2.0 mmol·L-1 DHAP处理组随着处理时间的延长,其变化趋势与对照基本保持一致且始终是2.0 mmol·L-1 >1.0 mmol·L-1 >对照。而3.0 mmol·L-1 和5.0 mmol·L-1 DHAP处理组随着处理时间的延长出现下降的趋势,可能原因是前期的抗氧化循环中植物细胞发生氧化损伤,致使GR活性下降。由此分析得出,在2.0 mmol·L-1 DHAP处理下,能够有效地调节GR活性,促使植物细胞正常的生长发育。而5.0 mmol·L-1 DHAP处理组能破坏其正常的抗氧化防御系统,致使植物细胞死亡。在图2-f中可以看出,1.0 mmol·L-1 和2.0 mmol·L-1 DHAP处理组GPX的变化趋势和GR一致,由于GPX是通过GR等一系列的生理调控机制生成,所以3.0 mmol·L-1和5.0 mmol·L-1 DHAP处理组的变化趋势与GR相比出现滞后现象,但是最终的结果是一致的。因此可以得出,2.0 mmol·L-1的DHAP处理组能够促进GPX更好地完成其生理活动,促使植物正常生长发育,而5.0 mmol·L-1 DHAP 则会引起植物细胞发生氧化损伤。
3 讨 论
以往研究植物的化感作用时,幼苗的胚根长、胚芽长以及鲜质量都会被看做实生苗的生长参数[18]。不同浓度DHAP作为一种生物活性化合物可以促进或抑制植物的生长,然而,它对浓度的确定取决于植物对化感物质剂量的敏感性[19]。本试验的研究结果与对人参皂苷(ginsenosides)的研究结果一致。低浓度的人生皂苷(12.5 mg·L-1;25 mg·L-1)能够显著促进西洋参的生长,而高浓度(25 mg·L-1;100 mg·L-1)的人生皂苷能够抑制西洋参的生长[20]。由此可以说明,化感物质能够影响植物,即适宜浓度的化感物质可以维持植物正常的生理代谢延缓植物的衰老;但是当浓度超过一定的范围时,就会破坏正常的生理代谢,致使细胞死亡。
在正常条件下,抗氧化酶可以调控细胞内H2O2的水平,但在逆境胁迫中,当ROS积累过量,它的产生与消除的动态平衡就会被破坏,从而引起细胞损伤[21]。为了适应胁迫所造成的氧化损伤,植物会做出一系列的反应来保护其正常的生理代谢。抗氧化酶防御系统是抗氧化保护中一个极其重要的组成部分,且其防御能力大小取决于多种酶的活性和彼此间协调的综合结果[22]。一般研究认为,在逆境胁迫下植物生长发育好的植物有更高的抗氧化酶活性[23]。本试验中2.0 mmol·L-1 DHAP处理组SOD活性变化与盐胁迫下对豌豆、甘蔗、玉米[24]的研究结果一致,表明此条件下SOD对O2- 有更强的清除能力,减少了O2- 对细胞的损害作用。5.0 mmol·L-1时,SOD的活性与人参皂苷对西洋参的研究结果一致[20],可能的原因是在高浓度的DHAP作用下产生大量的H2O2,当其不能被迅速清除时细胞就会受到氧化损伤死亡。
SOD在歧化过程中产生H2O2可以氧化损伤细胞膜,因此需要快速清除H2O2。植物中APX和CAT活动途径可以将H2O2转化为H2O分子调节H2O2平衡。已有研究表明,GR和GPX通过ASA-GSH循环途径协助完成APX、POD和CAT的生理作用机制。在盐胁迫下对番茄[25]、甘蔗和玉米等的研究也表明,在逆胁迫下作物APX、POD和CAT相互协调完成其生理机制。由试验结果可看出,CAT、APX的活性在2.0 mmol·L-1 DHAP处理下均显著高于其他试验组,但在5.0 mmol·L-1 处理下结果与之相反。这表明,低浓度下CAT和APX的活性强于高浓度下的活性,因此增强它们对H2O2的清除,使植物细胞免受更严重的氧化损伤。该试验结果与伊文斯兰染色检测细胞活性的结果一致。
POD 是植物在逆境条件下酶促防御系统的关键酶之一。它不仅参与了清除H2O2的过程而且还参与了植物木质化和木栓化[26]。已有研究表明,在逆境中车前草[27]、向日葵[28]等抗逆性较弱植物的POD的活性较高,本试验结果与上述研究结果相同。引起此试验结果的原因是:POD的活性增强致使木质素积累加速了细胞的衰老;而适宜浓度的DHAP能够合理调控其生理机制,阻碍了天山云杉在生长发育过程中受到的氧化损伤。
植物的抗氧化酶是由植物自身代谢产生的一类调节植物生长的物质,在极低的浓度下也能产生生理效应,与植物的生长发育以及抗逆性密切相关[29]。不同浓度的DAHP对天山云杉幼苗生长过程中抗氧化酶活性的影响不同;抗氧化酶活性的变化可能会干扰活性氧生产和清除的平衡:因此,浓度的化感物质可能是引起天山云杉自然更新的原因之一。
4 结 论
通过对幼苗生长发育过程中根长、胚芽长和鲜质量的分析得出,低浓度的DHAP(c ≤ 2.0 mmol·L-1)能够促进幼苗的生长而高浓度的DHAP(2.0 mmol·L-1 < c ≤ 5.0 mmol·L-1)抑制天山云杉幼苗的生长。通过对天山云杉幼苗根细胞抗氧化酶活性的综合分析得出,DHAP作为化感物质能够诱导天山云杉生长过程中6种抗氧化酶的含量发生变化,DHAP处理浓度在( c ≤ 2.0 mmol·L-1)时,抗氧化酶SOD、CAT、APX、GPX、GR的活性随着DHAP浓度的升高而升高,POD的活性随着浓度的升高而下降;DHAP处理浓度在(2.0 mmol·L-1 < c ≤ 5.0 mmol·L-1)时,抗氧化酶SOD、CAT、APX、GPX、GR的活性在前3 d随着DHAP浓度的升高而降低,POD的活性随着浓度的升高而降低,3 d后6种抗氧化酶活性随着处理时间的延长变化规律紊乱。试验结果表明,天山云杉幼苗生长发育状况与6种抗氧化酶活性强弱密切相关,同时这6种抗氧化酶活性强弱与其受到胁迫因子的浓度有直接关系。
参考文献:
[1] CALLAWAY, R M, VIVANCO J M. Can plant biochemistry contribute to understanding of invasion ecology?[J].Trends Plant Science, 2006, 11(12): 574-580.
[2] CALLAWAY R M, ASCHEHOUG E T. Invasive plants versus their new and old neighbors: a mechanism for exotic invasion[J]. Science, 2000, 290(5491): 521-523.
[3] WEIDENHAMER J D, HARTNETT D C, ROMEO J T. Density-dependent phytotoxicity: distinguishing resource competition and allelopathic interference in plants[J]. Journal of Applied Ecology, 1989, 26(2): 613-624.
[4] YU J Q, SHOU S Y, QIAN Y R, et al. Autotoxic potential of cucurbit crops[J]. Plant Soil, 2000, 223(1/2): 149-153.
[5] ZENG R S, MALLIK A U, LUO S M. Allelopathy in Sustainable Agriculture and Forestry[M]. New York:Springer, 2008: 363-386.
[6] FERNANDEZ C,VOIRIOT S,MEVY J P, et al. Regeneration failure of Pinus halepensis Mill. The role of autotoxicity and some abiotic environmental parameters[J]. Forest Ecology and Management, 2008, 255(7) : 2928-2936.
[7] HALLIWELL B, FOYER C H. Properties and Physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography[J]. Planta ,1978, 139(1):9-17.
[8] WANG Q, RUAN X, PAN C D, et al. Need for sustainability policy-A case study of the National Forest Conservation Program (NFCP)in the western region of Tianshan Mountain,China[J].The Forestry Chronicle, 2006, 82(1) : 31-39.
[9] 张新时,张瑛山.乌苏林区天山云杉天然更新的初步研究[J].新疆农业科学,1963(1): 8-12.
[10] LI Z H, WANG Q, RUAN X, et al. Phenolics and plant Allelopathy[J]. Molecules, 2010, 15( 12): 8933-8952.
[11] BROZ A K, BROECKLING C D, DELAPEA C. Plant neighbor identity influences plant biochemistry and physiology related to defense[J]. BMC Plant Biology, 2010, 10(1):115.
[12] FALIK O, REIDES P, GERSANI M, et al. Self/non-self discrimination in roots[J]. Journal of Ecology, 2003, 91(4):525-531.
[13] WEIR T L, PARK S W, VIVANCO J M, Biochemical and physiological mechanisms mediated by allelochemicals[J]. Current Opinion Plant Biology, 2004, 7(4):472-479.
[14] TAM S L, IMONOVIOV M, HUTTOV J, et al. Aluminium stimulated hydrogen peroxide production of germinating barley seeds[J]. Environment and Experimental Botany, 2004, 51(3): 281-288.
[15] BAI R , MA F , LIANG D, et al. Phthalic aicd induces oxidative stress and alters the activity of some antioxidant enzymes in roots of Malus prunifolia [J]. Journal of Chemical Ecology, 2009,35(4):488-494.
[16] SOARES A R, FERRARESE M L,DE CASSIA SIQUEIRA-SOARES R, et al. The allelochemical L-DOPA increases melanin production and reduces reactive oxygen species in soybean roots[J]. Journal of Chemical Ecology, 2011,37(8):891-898.
[17] 张玉竹,刘润,潘存德,等. DHAP胁迫对天山云杉种子萌发过程中抗氧化酶活性影响的研究[J].新疆农业大学学报,2015,38(1):1-11.
[18] LEATHER G R, EINHELLING F A. Bioassays in the study of allelopathy II[M]//PUTNAM A R,TANG C S. The Science of allelopathy. New York: John Wiley,Sons,1986:133-145.
[19] LI X X, YU M F, RUAN X, et al. Phytotoxicity of 4, 8-dihydroxy-1-tetralone Isolated from Carya cathayensis Sarg. to various plant species[J]. Molecules, 2014,19(10): 15452-15467.
[20] ZHANG A H, LEI F J, FANG S W. Effects of ginsenosides on the growth and activity of antioxidant enzymes in American ginseng seedlings[J]. Journal of Medicinal Plants Research, 2011,5(14) :3217-3223.
[21] ZHOU Z S,WANG S J, YANG Z M. Biological detection and analysis of mercury toxicity to alfalfa plants[J]. Chemosphere, 2008,70(8):1500-1509.
