Cd2+和Cr3+对崇明东滩湿地土壤碱性磷酸酶的低剂量兴奋效应
2016-04-20范弟武周曼丽张倩楠朱咏莉韩建刚
范弟武,徐 莎,周曼丽,张倩楠,朱咏莉①,韩建刚②
(1.南京林业大学江苏省南方现代林业协同创新中心,江苏 南京 210037;2.南京林业大学生物与环境学院,江苏 南京 210037)
Cd2+和Cr3+对崇明东滩湿地土壤碱性磷酸酶的低剂量兴奋效应
范弟武1,2,徐莎1,2,周曼丽2,张倩楠2,朱咏莉1,2①,韩建刚1,2②
(1.南京林业大学江苏省南方现代林业协同创新中心,江苏 南京210037;2.南京林业大学生物与环境学院,江苏 南京210037)
摘要:为了明确Cd(2+)、Cr(3+)与碱性磷酸酶(ALP)活性之间的低剂量兴奋效应关系,以崇明东滩湿地土壤为对象,通过添加不同剂量的外源Cd(2+)(CdCl2)和Cr(3+)(CrCl3),使土壤中w(Cd(2+))分别为0、0.001、0.01、0.1、1、5、10、20、100和500 mg·kg(-1),w(Cr(3+))为0、0.5、5、50、100、500和5 000 mg·kg(-1),观测土壤ALP活性随时间(0、6、12、24、48、72和120 h)的变化特征。结果表明:(1)培养12 h后,Cd(2+)添加量为1 mg·kg(-1)时,ALP活性比对照高8.6%(P<0.05);当Cd(2+)添加量大于10 mg·kg(-1)时,酶活性受到明显抑制。Cr(3+)添加量为5 mg·kg(-1)时,ALP活性比对照显著升高22.8%(P<0.05);当Cr(3+)添加量大于100 mg·kg(-1)时,酶活性显著降低。这表明Cd(2+)和Cr(3+)与ALP之间存在典型的低剂量兴奋效应,但效应的表达与两者接触时间的长短密切相关。(2)以培养24 h的土壤样品为例,Cd(2+)添加量为1 和5 mg·kg(-1)时,ALP的催化效率(V(max)/Km),即最大反应速率(V(max))与Michaelis常数(Km)的比值为1.7;当Cd(2+)添加量增加到20 mg·kg(-1)时,V(max)/Km比降至0.8,而V(max)和Km的值均低于对照。Cr(3+)添加量为0.5和5 mg·kg(-1)时,V(max)/Km比为1.7;当Cr(3+)添加量增至100 mg·kg(-1)时,V(max)/Km比降为1.4,但V(max)和Km值均高于对照,这表明重金属与土壤酶之间的低剂量兴奋效应机理可能与其离子特性密切相关。
关键词:低剂量兴奋效应;碱性磷酸酶;重金属;滨海湿地
湿地土壤的重金属污染问题是当前环境科学领域的研究热点之一,湿地土壤被公认为是最重要的环境污染物汇聚地[1]。由于日趋严重的近海环境污染问题及可持续发展的需要,揭示湿地在重金属循环中的功能,认识重金属在湿地中的迁移和循环规律十分必要[2]。吕达等[3]利用污染负荷指数法对崇明岛东滩湿地重金属含量进行分析,结果显示崇明岛东滩湿地为中度污染。铬、镉等重金属在湿地土壤中分布广泛[4]。湿地土壤中的重金属对植物的生长发育、微生物群落,甚至对土壤酶都存在影响[5-6],研究崇明东滩湿地重金属对保护湿地环境及鸟类等生物的栖息地有重要作用。
低剂量兴奋效应指机体受低剂量污染胁迫时出现刺激作用,而受高剂量污染胁迫时表现出抑制效应[7]。目前有关污染物低剂量兴奋效应的研究主要围绕动物、植物和细菌等机体进行,相应的测试终点包括生长状况、繁殖率、致突变率等[8-9]。SHEN 等[10-11]在研究低剂量镉与菲复合污染的协同与拮抗机理时,选用土壤酶作为判断指标,但并没有对土壤酶本身可能存在的低剂量兴奋效应进行专门探讨,而土壤酶可能是潜在的重要的低剂量兴奋效应研究对象之一。
土壤酶是土壤组分中最活跃的有机成分之一[12],土壤酶活性与土壤中生物数量、生物多样性等密切相关,是土壤生物学活性的表现。有研究者认为可以将土壤酶作为土壤质量的生物指示器来评估重金属对土壤的污染程度[13],土壤酶并非个体,不受种群等尺度约束,可反映整个环境的功能效应。对土壤生态系统的营养物质循环、能量转化和净化污染物等方面有重要作用[14-15]。碱性磷酸酶(ALP)是一种专一性较好的磷酸酯水解酶,广泛分布在生态系统的各个角落,已经成为一种环境监测的指示物,具有重要的生态学意义[16]。
笔者以滨海湿地为原型区域,选择ALP活性为测试终点,研究不同培养时间下Cd2+和Cr3+对ALP活性的影响,同时对ALP酶促反应动力学特征进行探讨,以期明确Cd2+和Cr3+与湿地土壤ALP活性之间的剂量效应关系及机理。
1材料与方法
1.1区域概况
崇明东滩(北纬31°37′31″,东经121°23′33″)位于崇明岛东部,是目前长江口规模最大的潮汐滩涂湿地。区域盛行东亚季风,年均温度15.7 ℃,年均降水量1 123.7 mm。崇明东滩表层土壤重金属w(Cr)与w(Cd)平均值为71和0.23 μg·g-1,均超过上海潮滩背景值,在长江口滩涂、中国河口湿地和全球滨岸地区范畴内均处于居中地位。基于沉积速率和重金属含量计算得出的崇明东滩重金属Cr与Cd的年沉降量分别为312和1.04 t,总沉积通量为11 g·m-2·a-1[17]。
1.2土壤样品采集
2012年3月16日于崇明东滩湿地按照平行线采样原则,在中潮滩带采集0~20 cm表层土壤及其上覆水样品。土壤样品风干后用木棍碾压,过1.0 mm孔径尼龙筛,置于阴凉干燥处保存,水样置于4 ℃ 冰箱冷藏,其中水样与土壤样品的有机碳含量分别为2.2 mg·L-1和17.5 g·kg-1,pH值分别为7.9和8.2〔m(水)∶m(土)=2.5〕,土壤样品的有机碳含量和pH值测定均参照文献[18]。
1.3试验设计
称取2.0 g风干土于25 mL小玻璃瓶中,加入0.8 mL不同w(Cd2+)(0、0.001、0.01、0.1、1、5、10、20、100和500 mg·kg-1)和w(Cr3+) (0、0.5、5、50、100、500和5 000 mg·kg-1)至土壤最终质量含水率为40%,密闭后置于30 ℃恒温培养箱中培养,分别在0、6、12、24、48、72、120 h取样测定,每个时间点培养1组样品(含1个对照和2个平行)。
1.4ALP活性测定
取湿泥样约1.0 g于20 mL玻璃瓶中,加入pH值为8.4的Tris-HCl缓冲液3 mL。加入5 mmol·L-1对硝基苯磷酸二钠(pNPP)1 mL和0.5 mol·L-1CaCl2溶液1 mL,摇匀。37 ℃水浴1 h后,取出玻璃瓶,立刻加入0.5 mol·L-1NaOH 4.0 mL终止反应,过滤。取滤液5.0 mL于25 mL具塞比色管中,加入2 mol·L-1Tris-HCl缓冲液2 mL,定容,采用紫外分光光度计(UV-2550型)在400 nm波长下测定对硝基苯酚(p-NP)吸光度。ALP活性以1 kg土壤1 h生成的p-NP的量表示。

(1)
式(1)中,E为ALP活性,mmol·kg-1·h-1;c1和c0分别为处理组和对照组p-NP浓度,mmol·L-1;m为换算为干土后的土壤质量,g;t为培养时间,h。
1.5酶促反应动力学
称取2.0 g土样至于小玻璃瓶中,分别加入0.8 mL不同w(Cd2+)(1、5和20 mg·kg-1)、w(Cr3+)(0.5、5和100 mg·kg-1),密闭后置于30 ℃恒温培养箱中培养24 h。从培养箱取出后,加入pH值为8.4的Tris-HCl缓冲液3.0 mL,分别加入0、1.7、2、2.5、3.3、5和10 mmol·L-1pNPP溶液1 mL和0.5 mol·L-1CaCl2溶液1 mL,摇匀,37 ℃水浴1 h,测定ALP活性,根据Michaelis-Menten方程计算酶促反应速率v[19]。

(2)
式(2)中,v为酶促反应速率,mmol·kg-1·h-1;Km为米氏常数,mmol·L-1;Vmax为最大酶促反应速率,mmol·kg-1·h-1;[S]为底物浓度,mmol·L-1。
1.6统计方法
采用单因素方差分析法(SPSS 19.0软件)比较不同Cd2+和Cr3+添加量条件下酶活性的差异显著性。
2结果与分析
2.1重金属离子与土壤ALP活性之间的剂量效应关系
2.1.1Cd2+与土壤ALP活性之间的剂量效应关系
在不同Cd2+添加水平下(0.001~500 mg·kg-1),培养6 h之前样品的ALP活性与对照相比没有明显的剂量效应关系(图1)。当培养时间延长至12 h时,1 mg·kg-1Cd2+处理样品的ALP活性显著升高(P<0.05),酶活性比对照高8.6%;当Cd2+添加量增至5~500 mg·kg-1时,酶活性受到明显抑制。随着培养时间的延长(24~120 h),所有Cd2+添加量下ALP活性均受到不同程度的抑制,最高抑制率达55.9%(表1)。

图1 不同Cd2+添加量对土壤ALP活性的影响
2.1.2Cr3+与土壤ALP活性之间的剂量效应关系
不同Cr3+添加水平下(0.5~5 000 mg·kg-1),培养12 h之前土样的ALP活性与对照相比没有明显的剂量效应关系(图2)。当培养时间延长至24 h时,0.5~50 mg·kg-1Cr3+处理样品的ALP活性显著升高(P<0.05),酶活性比对照高8.30%~22.8%;随着Cr3+添加量增至100~5 000 mg·kg-1,酶活性受到明显抑制。随着培养时间的延长(48~120 h),所有Cr3+添加水平下(0.05~5 000 mg·kg-1)ALP活性均受到明显抑制,最高抑制率达60.3%(表2)。
2.2Cd2+、Cr3+对土壤ALP酶促反应动力学参数变化的影响
由表3可知,与CK相比,Cd2+添加量为1和5 mg·kg-1时,Km值无显著变化,Vmax值分别降低7.3%和11.5%;当Cd2+添加量增加到20 mg·kg-1时,Vmax和Km分别降低61.5%和10.7%。Cd2+添加量为1和5 mg·kg-1时,Vmax/Km比值均为1.7;当Cd2+添加剂量增加到20 mg·kg-1时,Vmax/Km比值为0.8,减少52.9%。
表1与对照相比各处理组Cd2+的促进率和抑制率
Table 1Promotion and inhibition rates of Cd2+in various treatments as compared with that in control
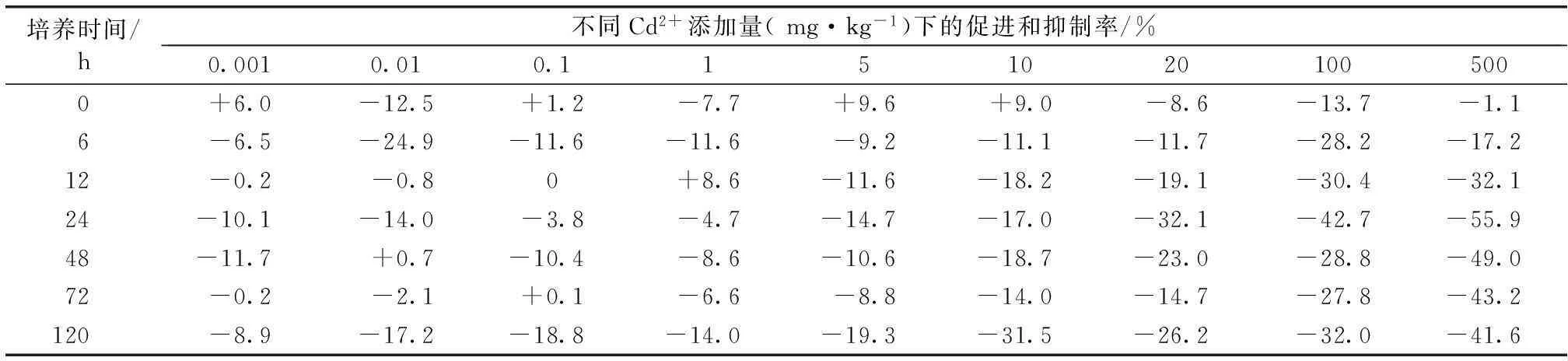
培养时间/h不同Cd2+添加量(mg·kg-1)下的促进和抑制率/%0.0010.010.11510201005000+6.0-12.5+1.2-7.7+9.6+9.0-8.6-13.7-1.16-6.5-24.9-11.6-11.6-9.2-11.1-11.7-28.2-17.212-0.2-0.80+8.6-11.6-18.2-19.1-30.4-32.124-10.1-14.0-3.8-4.7-14.7-17.0-32.1-42.7-55.948-11.7+0.7-10.4-8.6-10.6-18.7-23.0-28.8-49.072-0.2-2.1+0.1-6.6-8.8-14.0-14.7-27.8-43.2120-8.9-17.2-18.8-14.0-19.3-31.5-26.2-32.0-41.6
+为促进,-为抑制。

图2 不同Cr3+添加量对土壤ALP活性的影响
表2与对照相比各处理组Cr3+的促进率和抑制率
Table 2Promotion and inhibition rates of Cr3+in various treatments as compared with that in control

培养时间/h不同Cr3+添加量(mg·kg-1)下的促进率和抑制率/%0.55501005005000026.8-16.3-18.86.0-28.5-26.261.6-24.7-27.9-15.7-29.1-44.6124.0-5.0-8.44.0-22.8-59.02410.022.88.3-13.1-21.3-73.5482.2-6.7-8.3-17.3-30.2-60.372-4.1-11.5-13.9-12.9-21.9-49.5120-5.3-4.5-8.7-8.7-17.3-42.1
+为促进,-为抑制。
Cr3+添加量为0.5、5和100 mg·kg-1时,ALP的Km和Vmax值分别增加14.3%和12.5%、59%和13.5%、11.5%和32.3%。Cr3+添加量为0.5和5 mg·kg-1时,Vmax/Km比值均为1.7;当Cr3+添加量增加到100 mg·kg-1时,Vmax/Km比值为1.4,减少17.6%。
表3不同Cd2+、Cr3+添加量对ALP酶促反应动力学参数的影响
Table 3Effects of dosage of Cd2+and Cr3+on kinetic parameters of the promotive effects on ALP in the soil

处理组添加量/(mg·kg-1)Vmax/(mmol·kg-1·h-1)Km/(mmol·L-1)R2Vmax/KmCK 09.65.6 0.995*1.7Cd2+18.95.30.993*1.758.55.10.986*1.7203.74.50.956*0.8Cr3+0.510.96.40.984*1.7510.76.30.989*1.710012.78.90.992*1.4
Vmax为最大酶促反应速率,Km为米氏常数。*表示P<0.01。
3讨论
3.1Cd2+、Cr3+与土壤ALP活性之间的剂量效应关系
以土壤生态系统为试验模型,酶活性为测试终点,对土壤酶的低剂量兴奋效应进行探讨。以往研究表明,重金属对ALP活性总体表现为抑制作用[20]。笔者研究发现,Cd2+、Cr3+与土壤ALP活性之间存在典型的双相剂量效应关系,这与陆文龙等[21]研究结果相一致。土壤体系相对复杂,由有机质、土壤生物以及水分、空气和氧化的腐殖质等组成。王浩等[22]研究发现土壤有机质积累可显著增加有机质结合态重金属比例。许多研究表明植物残物分解而成的有机质可与重金属络合增加金属离子活性,降低土壤对重金属的吸附[23]。徐明岗等[24]研究发现黄棕壤在pH 值为4~7时不同吸附量下重金属的解吸量均随吸附量增加而增大,两者呈显著线性相关。随着土壤pH值升高,可交换态Cd含量逐渐降低,有机结合态Cd含量缓慢升高[25]。
郭雪雁等[26]研究认为时间是剂量效应关系中的一个重要组成部分。就土壤ALP而言,Cd2+和Cr3+与酶活性低剂量兴奋效应的表达与两者之间的作用时间长短密切相关(>12 h)。在较短作用时间内(0~12 h),土壤ALP活性在不同Cd2+、Cr3+添加量之间的变化没有明显的促进或抑制现象。相对而言,当作用时间延长至12~24 h时,才会出现酶活性显著升高现象,这表明酶与胁迫物接触后存在相互作用期,表现为响应的滞后,同时Cd2+、Cr3+对酶活性的促进幅度与低剂量兴奋效应研究的“30%~60%法则”[27-28]相比刺激效应幅度略低。略低的刺激效应幅度与响应时间的滞后可能与土壤模型的复杂性密切相关。王瑞兴等[29]研究发现,在被重金属污染的土壤样中添加底物,8 d后土壤中有效态重金属含量减少50%~70%。
3.2Cd2+、Cr3+对土壤ALP 低剂量兴奋效应的机制探索
一定剂量的Cd2+、Cr3+污染刺激了土壤酶活性增加,高剂量Cd2+、Cr3+污染对土壤酶活性的抑制作用非常显著,这与低剂量兴奋效应定义相吻合[7]。低浓度重金属对土壤ALP活性具有促进作用,一方面可能是由于低浓度重金属对土壤微生物生物量存在刺激作用,而当微生物受到刺激后,微生物对土壤中ALP活性具有促进作用。韩桂琪等[30]研究发现,低剂量重金属刺激了细菌等微生物生长,但高剂量则使得微生物生物量显著下降。另一方面可能由于酶作为蛋白质,重金属离子作为辅基,有利于酶活性中心与底物的配位结合,从而使酶分子与酶活性中心保持一定的专性结构,改变酶促反应的平衡性和酶蛋白的表面电荷,从而增强酶活性[31]。在高剂量重金属离子的影响下,酶活性下降,这与重金属对酶产生的抑制作用有关,反竞争性抑制是指抑制剂只与酶-底物的复合物结合,而不与游离酶结合的一种酶促反应抑制作用,特点为Vmax和Km都变小,但Vmax/Km比值不变。该现象的作用机理可能是重金属通过抑制土壤微生物的生长和繁殖,减少体内酶的合成和分泌,最终导致酶活性下降[32-33]。
酶促反应动力学研究有助于了解酶与底物结合机制与作用方式,以及酶的结构与功能的关系[34]。研究发现,Cd2+添加量为1和5 mg·kg-1时,Km值无显著差异,Vmax/Km比值则与对照相同,说明Cd2+对ALP与底物的结合(亲和力)几乎没有影响。随着Cd2+剂量增加,Vmax/Km比值降低。Cd2+对ALP活性变化影响的机理可能在于Cd2+充当了反竞争性抑制剂,即并未对酶本身产生抑制,而是对ALP与底物结合的产物形成抑制作用。这与徐冬梅等[35]研究结果一致,符合反竞争性抑制剂的特点。与对照相比,Cr3+的加入均显著降低ALP与底物的亲和力,且随着Cr3+浓度的增加,ALP与底物的亲和力逐渐降低。以此来看,低剂量Cr3+并不是作为反竞争性抑制剂,也未改变酶的催化效率,只是增加了最大反应速率。因此,重金属离子对土壤酶低剂量兴奋效应的机理可能取决于不同离子之间的特性。由此可以延伸到分子生物学角度对低剂量兴奋效应现象进行探索[36-38]。MORRE[38]研究发现刺激植物生长的低剂量兴奋效应的分子靶位是TIP/NOX蛋白质。但目前有关重金属对土壤的低剂量兴奋效应在分子水平上的作用机制尚不明确。
4结论
(1)Cd2+、Cr3+与湿地土壤ALP活性之间存在显著的双相剂量效应关系,但该剂量关系的表达与两者之间接触时间的长短密切相关。12 h后,低剂量Cd2+、Cr3+使土壤ALP活性显著升高;随着添加剂量的增加,酶活性受到明显抑制。
(2)低剂量Cd2+对ALP活性变化影响的机理是Cd2+充当了反竞争性抑制剂,即其并未对酶本身产生抑制,而是对ALP与底物结合后产物的形成产生抑制。相比较而言,低剂量Cr3+增加了ALP的最大反应速率。这表明重金属与土壤酶之间的低剂量兴奋效应机理可能与其离子特性密切相关。
参考文献:
[1]FORSMER U,WITTMANN G T W.Metal Pollution in the Aquatic Environment[M].Heidelberg,Berlin:Springer-Verlag,1983:1-2.
[2]钱嫦萍,陈振楼,毕春娟,等.潮滩沉积物重金属生物地球化学研究进展[J].环境科学研究,2002,15(5):49-52.
[3]吕达,郑祥民.崇明东滩湿地沉积物重金属污染的磁诊断[J].环境科学研究,2007,20(6):38-43.
[4]CHEN L,SONG C G,YIN Y Y,etal. Spatial Distribution and Risk Assessment of Heavy Metals in Sediments of Shuangtaizi Estuary,China[J].Marine Pollution Bulletin,2015,98(1/2):358-364.
[5]李其林.区域生态系统土壤和作物中重金属的特征研究[M].北京:中国环境科学出版社,2010:57-59.
[6]DAI J,BECQUER T,ROUILLER J H,etal.Heavy Metal Accumulation by Two Earthworm Species and Its Relationship to Total and DTPA Extractable Metals in Soils[J].Soil Biology & Biochemistry,2004,36(1):91-98.
[7]CALABRESE E J,BALDWIN L A.Toxicology Rethinks Its Central Belief[J].Nature,2003,421(6924):691-692.
[8]余月书,王斌,薛晚烟,等.低剂量农药对禾谷缢管蚜生殖力的低剂量兴奋效应及机理研究[J].上海农业学报,2015(2):71-74.
[9]魏雪涛,黄超峰,乔杨铮,等.重金属镉和铅对巨噬细胞和成纤维细胞的Hormesis效应[J].毒理学杂志,2005,19(3):235.
[10]SHEN G Q,LU Y T,ZHOU Q X,etal.Interaction of Polycyclic Aromatic Hydrocarbons and Heavy Metals on Soil Enzyme[J].Chemosphere,2005,61(8):1175-1182.
[11]SHEN G Q,LU Y T,HONG J B.Combined Effect of Heavy Metals and Polycyclic Aromatic Hydrocarbons on Urease Activity in Soil[J].Ecotoxicology and Environmental Safety,2006,63(8):474-480.
[12]MARX M C,WOOD M,JARVIS S C.A Microplate Fluorimetric Assay for the Study of Enzyme Diversity in Soils[J].Soil Biology & Biochemistry,2001,33(12/13):1633-1640.
[13]PANKHUST C E,DOUBE B M,GUPTA V S R,etal.Soil Biota:Management in Sustainable Fanning Systems[J].Applied Soil Ecology,1995,2(2):138-139.
[14]BANERJEE M R,BURTON D L.Impact of Sewage Sludge Application on Soil Biological Characteristics[J].Agriculture,Ecosystems and Environment,1997,66(3):241-249.
[15]关松荫,德生,张志明.土壤酶及其研究方法[M].北京:农业出版社,1986:230-233.
[16]CALDWELL B A.Enzyme Activities as a Component of Soil Biodiversity:A Review[J].Pedobiologia,2005,49(6):637-644.
[17]李雅娟.崇明东滩湿地的重金属积累效应及其对人类活动的响应[D].上海:华东师范大学,2012.
[18]鲍士旦.土壤农化分析[M].北京:农业出版社,2000:42-56.
[19]王镜岩,朱圣庚,徐长法.生物化学教程[M].北京:高等教育出版社,2008:148-168.
[20]杨红飞,严密,姚婧,等.铜、锌污染对油菜生长和土壤酶活性的影响[J].应用生态学报,2007,18(7):1484-1490.
[21]陆文龙,李春月.重金属镉对土壤酶活性影响的研究[J].吉林化工学院学报,2010,27(3):24-26.
[22]王浩,章明奎.有机质积累和酸化对污染土壤重金属释放潜力的影响[J].土壤通报,2009,40(3):538-541.
[23]SHUMAN L M.Effects of Nitrilo Triacetic Acid on Metal Adsorption Isotherms for Two Soils[J].Soil Science,1990,160(2):92-100.
[24]徐明岗,李菊梅,张青.pH对黄棕壤重金属解吸特征的影响[J].生态环境,2004,13(3):312-315.
[25]王洋,刘景双,郑娜.土壤 pH值对冻融黑土重金属锌赋存形态的影响[J].干旱区资源与环境,2010,24(1):163-167.
[26]郭雪雁,马义兵,李波.陆地生态系统中低剂量毒物刺激作用及拟合模型研究进展[J].生态学报,2009,29(8):4408-4419.
[27]CALABRESE E J,IAVICOLI I,CALABRESE V.Hormesis:Why It Is Important to Biogerontologists[J].Biogerontology,2012,13(2):215-235.
[28]CALABRESE E J.Hormesis Within a Mechanistic Context[J].Homeopathy,2015,104(2):90-96.
[29]王瑞兴,钱春香,昊淼,等.微生物矿化固结土壤中重金属研究[J].动能材料,2007,38(9):1523-1526,1530.
[30]韩桂琪,王彬,徐卫红,等.重金属Cd、Zn、Cu和Pb复合污染对土壤生物活性的影响[J].中国生态农业学报,2012,20(9):1236-1242.
[31]黄柯程,曾鑫年,黎卓莹.低剂量杀虫剂对昆虫的兴奋性效应[J].生态毒理学报,2010,5(1):26-31.
[32]黄璐琦,郭兰萍,张小波,等.Hormesis概念、机理及其在中药研究中的应用[C]∥中国药学会.2010年中国药学大会暨第十届中国药师周论文集.天津:[s. n.],2010:1-7.
[33]WANG H.Hormesis Effects and Implicative Application in Assessment of Lead-Contaminated Soils in Roots ofViciafabaSeedlings[J].Chemosphere,2010,80(9):965-971.
[34]张海龙,高东红.酶促反应动力学中抑制剂类型的判断方法[J].数学的实践与认识,2014,34(4):90-94.
[35]徐冬梅,刘广深,王黎明,等.重金属汞对土壤酸性磷酸酶的影响及其机理[J].环境科学学报,2004,24(5):866-870.
[36]VYSOYKIIA V I,ANATOLII A N,KORNILOVAH A A,etal.Molecular Mechanisms and Time-Dependent Dynamics of Hormesis,Antagonism and Radio Protective Effects at Combined Ionizing Irradiation of Biological Systems[J].Radiation Physics and Chemistry,2002,60(4/5):487-493.
[37]VERHEKE N,CLARK R F C,RATTAN S I S.Modulating Cellular Aging in Vitro:Hormetic Effects of Repeated Mild Heat Stress on Protein Oxidation and Glycation[J].Experimental Gerontology,2000,35(6/7):787-794.
[38]MORRE.A Protein Disulfide-Thiol Interchange Protein With NADH:Protein Disulfide Reductase (NADH Oxidise) Activity as a Molecular Target for Low Levels of Exposure to Organic Solvents Plant Growth[J].Human and Experimental Toxicology,1998,17(5):272-277.
(责任编辑: 陈昕)
Low-Dose Hormetic Effects of Cd2+and Cr3+on Alkaline Phosphatase in Wetland Soil in Dongtan of Chongming.
FANDi-wu1,2,XUSha1,2,ZHOUMan-li2,ZHANGQian-nan2,ZHUYong-li1,2,HANJian-gang1,2
(1.Collaborative Innovation Center of Sustainable Forestry in Southern China of Jiangsu Province, Nanjing Forestry University, Nanjing 210037, China;2.College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China)
Abstract:To explore low-dose hormetic effects (a biphasic dose-response characterized by a low dose benefit and a high dose inhibition) of Cd(2+) and Cr(3+)on activity of alkaline phosphatase in wetland soil, soil samples were collected from the wetland in Dongtan of Chongming, treated with different doses of Cd(2+) and Cr(3+), making the samples 0, 0.001, 0.01, 0.1, 1, 5, 10, 20, 100 and 500 mg·kg(-1) in Cd(2+) concentration and 0, 0.5, 5, 50 100, 500 and 5 000 mg·kg(-1) in Cr(3+) concentration, separately, and then incubated for 0, 6, 12, 24, 48, 72 and 120 hrs. After the incubation soil samples were analyzed for activity of alkaline phosphatase (ALP)in soils to determine characteristics of the temporal variation of the activity with the incubation. Results show that after 12 hours of incubation, ALP activity was 8.6% higher in the soil samples 1 mg·kg(-1) in Cd(2+) concentration than in CK, and was obviously inhibited in the soil samples 10 mg·kg(-1) in Cd(2+) concentration(P<0.05), while ALP activity was 22.8% higher in the soil samples 5 mg·kg(-1) in Cr(3+) concentration than in CK (P<0.05), but substantially lower in the soil samples 100 mg·kg(-1) or higher in Cd(2+) concentration, which indicates that the two types of heavy metals have some low-dose hormetic effects on ALP activity in the wetland soil, and the effects were closely related to duration of their contact. Meanwhile, after 24 hours of incubation, V(max )/Km (maximum reaction velocity/Michaelis constant) was 1.7 in the soil samples 1 and 5 mg·kg(-1) in Cd(2+) concentration and lowered down to 0.8 in the soil samples 20.0 mg·kg(-1) in Cd(2+) concentration with both V(max) and Km being lower than their respective ones in CK (soil samples 0 mg·kg(-1) in Cd(2+) concentration), and V(max)/Km was also 1.7 in the soil samples 1 and 5 mg·kg(-1) in Cr(3+) concentration, and 1.4 in the soil samples 100 mg·kg(-1) in Cr(3+) concentration, with both V(max) and Km being higher than their respective ones in CK. All the findings indicate that both V(max) and Km fall simultaneously in the presence of Cd(2+), but rise simultaneously in the presence of Cr(3+), and that the mechanism of low-case hormesis existing between heavy metals and soil enzymes may be closely related to properties of the heavy metal ions.
Key words:hormesis;alkaline phosphatase;heavy metal;coastal wetlands
作者简介:范弟武(1992—),男,安徽宣城人,硕士生,主要从事环境毒理学方面的研究。E-mail: 709719226@qq.com
DOI:10.11934/j.issn.1673-4831.2016.02.023
中图分类号:X53
文献标志码:A
文章编号:1673-4831(2016)02-0320-06
通信作者①E-mail: zhuyongli76@126.com ②E-mail: hanjiangang76@126.com
基金项目:国家自然科学基金 (41375149,41471191);江苏高校优势学科建设工程资助项目(PAPD);南京林业大学2015年度大学生实践创新训练计划(2015sjcx188)
收稿日期:2015-10-26
