雷利度胺治疗自体造血干细胞移植后复发套细胞淋巴瘤一例并文献复习
2016-04-19梁哲彬吴婷婷陈鑫丽刘文宾吴迪炯胡慧瑾俞庆宏沈一平
梁哲彬 吴婷婷 陈鑫丽 刘文宾 吴迪炯 胡慧瑾 俞庆宏 沈一平
·论著·
雷利度胺治疗自体造血干细胞移植后复发套细胞淋巴瘤一例并文献复习
梁哲彬1吴婷婷1陈鑫丽1刘文宾2吴迪炯2胡慧瑾2俞庆宏2沈一平2
周郁鸿2叶宝东2
目的 评价雷利度胺对自体造血干细胞移植(AHSCT)后复发难治性套细胞淋巴瘤的疗效。方法 回顾性分析浙江中医药大学附属第一医院血液科收治的1例行AHSCT后2次复发套细胞淋巴瘤患者的临床资料和治疗经过。先后应用雷利度胺联合地塞米松以及雷利度胺联合COD方案(环磷酰胺、长春瑞滨和地塞米松)治疗,并结合文献进行分析讨论。结果患者经以雷利度胺为主方案治疗后,疾病再次获得完全缓解,截至2015年11月初已经随访6个月,疾病未见复发。结论 雷利度胺对复发难治性套细胞淋巴瘤有良好的治疗效果,可以作为AHSCT后复发套细胞淋巴瘤患者有效的治疗手段。
雷利度胺; 自体造血干细胞移植; 套细胞淋巴瘤
套细胞淋巴瘤(mantle cell lymphoma,MCL)是一种特殊类型的B细胞非霍奇金淋巴瘤(non-Hodgkinlymphoma,NHL),占NHL的5%~10%。目前临床上尚无公认的标准治疗方案,且该疾病的治疗效果不佳,易复发,患者长期生存率较低[1]。尽管大剂量联合化疗后行自体造血干细胞移植(autologous hematopoietic stem cell transplantation,AHSCT)使部分患者预后有所改善,但是仍有不少患者在移植后复发,且后续其他治疗对复发患者疗效较差[2]。雷利度胺是继沙利度胺后新一代免疫调节剂,广泛应用于治疗血液及淋巴系统疾病[3]。本文回顾性分析浙江中医药大学附属第一医院血液科应用雷利度胺治疗1例行AHSCT后复发2次的MCL患者的临床资料,并结合相关文献报道,总结诊治经验,以期提高对该疾病的认识和临床疗效。
1 临床资料
患者男性,62岁,1990年因患肺鳞癌行左肺上叶切除,并行放疗(具体不详)。2012年6月因“发现左腋下无痛性肿块1周”至杭州市肿瘤医院就诊。患者无咳嗽、咳痰、胸痛、恶心及呕吐等症状,有夜间盗汗,睡眠质量差。查体示:双侧颈部及锁骨上未触及明显肿大淋巴结;双侧腹股沟分别可触及一条索状肿块,大小约1 cm×2 cm,质地中等,活动度可,无压痛;左腋下可触及一肿块,大小约4 cm×5 cm,质地中等,活动度差,无压痛。除上述体征外,未见其他明显阳性体征。血常规示:白细胞5.2×109/L,血红蛋白117 g/L,血小板162×109/L。行左腋下淋巴结活检,免疫组织化学检查结果示:CD5(+)、CD3(-)、CD20(+)、CD79a(+)、细胞周期蛋白D1(+)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)(+)、Ki-67 30%;病理报告示淋巴结MCL。骨髓常规和病理活检结果示:骨髓增生活跃,各阶段细胞比例、形态未见异常,未见淋巴瘤细胞侵犯。
2012年7月11日,患者于中国人民解放军第一一七医院行正电子发射计算机断层显像(PET-CT)检查示:淋巴瘤多结区累及,双侧腋下、后腹膜、脾脏及骨髓出现浸润。遂诊断为MCL。
自2012年7月起,患者于杭州市第一人民医院进行R-CHODE化疗方案治疗:利妥昔单抗700 mg,第1天;环磷酰胺1.3 g,第2天;表阿霉素80 mg,第2~3天;长春新碱2 mg,第2天;依托泊苷0.1 g,第2~6天;地塞米松20 mg,第2~6天,联合化疗6次;R-CMOD方案(利妥昔单抗700 mg,第1天;环磷酰胺1.3 g,第2天;米托蒽醌10 mg,第2~4天;长春地辛4 mg,第2天;地塞米松20 mg,第2~6天)化疗1次。完成上述化疗方案后,查体未见明显异常淋巴结肿大,复查PET-CT示:全身器官组织葡萄糖代谢活性未见明显增高,结合临床及影像学检查,提示淋巴瘤完全缓解。
2013年1月,患者来我院行自体干细胞移植术。干细胞动员采用我科常规方案[4]:环磷酰胺4 g/m2,分2 d用,于白细胞计数跌至最低点日(1月28日)开始使用粒细胞集落刺激因子5~10 μg·kg-1·d-1,至干细胞采集结束当天。分别于2013年1月30日、31日应用血细胞分离机(COBE SPECTRA,美国金宝公司)进行采集,共采集2次,共获得单个核细胞7.85×108/kg,其中CD34+细胞数为4.86×106/kg,-80 ℃冰箱冷冻保存。
2013年3月,给予患者SEAM方案:司莫司汀250 mg/m2,第1天;依托泊苷200 mg/m2,第2~5天;阿糖胞苷400 mg/m2,第2~5天;马法兰140 mg/m2,第6天。SEAM方案预处理48 h后回输自体造血干细胞,患者移植后14 d造血功能恢复,且移植过程中无相关严重并发症出现,之后每周门诊随访,未予药物治疗。
2014年6月27日,患者因咳嗽、发热(最高39.3 ℃)再次到我院就诊,查血常规示:白细胞4.2×109/L,血红蛋白99 g/L,血小板86×109/L;肺部CT检查示:左肺肺癌术后改变,左肺门出现占位性病变(5.8 cm×5.7 cm),左肺上叶前段支气管闭塞,尖后段支气管狭窄,考虑复发;左肺纤维灶;纵隔内及左侧心膈角淋巴结增大;心包积液,左侧胸腔积液,纵隔胸膜增厚;左侧胸壁皮下结节,转移待排;两侧膈脚旁及腹膜后多发淋巴结增大(见图1)。行纤维支气管镜活检,病理提示MCL,病理免疫组织化学结果示:肺癌相关抗原(+)、CD20(+)、CD79a(+)、B细胞特异性激活蛋白(pax-5)(+)、末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)(-)、CD2(-)、CD4(-)、CD5(+)、细胞周期蛋白D1(CyclinD1)(+)、CD8(-)、CD10(-)、CD43(+)、CD21(-)、CD7(-)、Bcl-2(+)、B淋巴细胞瘤-6(-)、细胞角蛋白7(cytokeratin7,CK7)(-)、甲状腺转录因子1(thyroid transcription factor-1, TTF-1)(-)、嗜铬粒素A(-)、突触素(-)、P53(40%+)、Ki-67(50%+)。骨髓穿刺涂片示:未见淋巴瘤细胞侵犯,染色体核型正常。
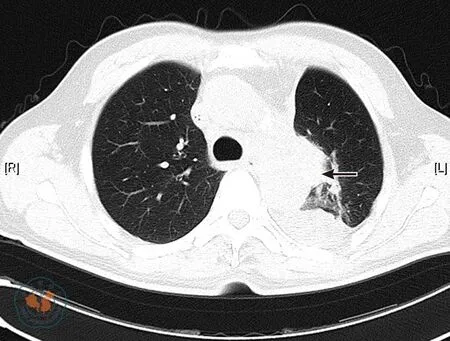
注: 左肺癌术后,左肺门可见软组织团块(箭头所示),最大层面大小约5.9 cm×3.8 cm
结合患者病史、临床症状、影像学检查及病理结果,明确诊断为MCL复发,考虑到患者一般状况差,难以耐受标准强度化疗,故给予雷利度胺(25 mg,第1~21天)联合地塞米松(20 mg,第1、8、15、22天)治疗。患者接受化疗后临床症状明显好转,咳嗽消失,体温恢复正常。治疗后1个月复查肺部CT示:左肺多处慢性炎症,左侧胸腔积液,心包积液,均较6月17日CT检查结果明显好转(见图2)。患者治疗过程中出现胸背一过性皮疹,未停药自行消退。骨髓抑制反应2级,仅为粒系,停药后恢复。之后患者由于个人问题,未进一步巩固治疗。

注: 左肺癌术后,与前片相比左肺门团块基本消失
2015年4月,患者因“腹胀1月余”再次到我院就诊。查体:中度贫血貌;全身皮肤未见皮疹及出血点;双侧颈部、腋下、腹股沟未触及淋巴结;胸骨区无明显压痛;双肺叩诊呈清音,双肺呼吸音清,未闻及干湿啰音;心率86次/min,心律齐;腹部稍膨隆,无明显压痛及反跳痛;肝肋下未及,脾脏肋下可及约10 cm,质硬,无触痛;双下肢轻度水肿。血常规示:白细胞1.3×109/L,血红蛋白70 g/L,血小板34×109/L。查骨髓穿刺涂片示:骨髓小粒可见;有核细胞增生活跃,粒细胞/红细胞比值为1.3;粒系增生活跃,占40.5%;红系增生活跃,占30.5%;幼稚淋巴细胞占13%;环片见巨核细胞104个,产板巨核细胞占6%,考虑淋巴瘤骨髓侵犯可能性大。
2015年4月24日,给予患者COD方案(环磷酰胺1.2 g,第1天;长春瑞滨30 mg,第1天;地塞米松15 mg,第1~5天)联合雷利度胺(25mg,第1~21天)治疗,期间患者出现血全细胞计数下降明显症状,全身明显皮疹伴瘙痒不适,予西替利嗪、咪唑斯汀、甲泼尼龙以及成分输血对症治疗。治疗1个月后,患者全身症状明显好转,皮疹消退,血常规恢复正常范围,脾脏肋下未及。复查骨髓穿刺涂片示:有骨髓小粒;有核细胞增生活跃,粒细胞/红细胞比值为0.5;粒系增生减低,占30.0%,各阶段中性粒细胞均减少;红系增生活跃,占56.6%,以中晚幼红细胞为主;淋巴细胞占8.5%;环片见巨核细胞65个,产板巨核细胞9个,血小板呈小簇分布,数量减少,提示疾病完全缓解。之后予雷利度胺(25 mg,第1~21天)联合地塞米松(20 mg,第1、8、15、22天)巩固治疗3个疗程。至2015年11月初,已经随访6个月,患者病情持续缓解。
2 讨 论
MCL是一种高度异质性疾病,具有惰性和侵袭性淋巴瘤的共同特点,且起病不明显,发展迅速,发现时疾病常已处于Ⅲ/Ⅳ期,多累及肝、脾、淋巴结、骨髓、外周血以及多个结外部位。患者在接受标准治疗方案后的中位生存时间为3~5年[5]。目前最新的报道可将其生存时间提高1倍以上,达5~6年[1]。超过95%的MCL患者由于存在t(11;14)(q13;q32)易位,导致CyclinD1过度表达[6-7],因此CyclinD1过度表达被认为是MCL特征性细胞遗传学改变,是诊断和鉴别MCL的重要依据。临床治疗方面,MCL作为高度恶性的NHL,目前标准的一线治疗包括R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松)等大剂量化疗和AHSCT,其最初反应率较高,总体有效率为60%~97%[2]。尽管如此,MCL复发率仍然较高,且易产生化疗耐药,故其总体预后较差。
本例患者确诊MCL时已累及脾脏、骨髓,疾病分期为Ⅴ期。最初按一线治疗方案共进行6次R-CHODE方案和1次R-CMOD方案化疗。为进一步提高远期生存率,患者至我院进行了AHSCT,术后恢复尚可。但是移植后仅15个月即复发,复发后的MCL预后极差,尤其是AHSCT后复发的患者,其中位生存期仅1~2年,且没有可供选择、疗效比较明确的治疗方案。
雷利度胺是沙利度胺的4-氨基-戊二酰基衍生物,作为新一代的免疫调节剂,其对多种血液及淋巴系统疾病有治疗作用,且不良反应相对较少。雷利度胺可以促进抗原提呈细胞摄取抗原,通过恢复树突细胞功能增强免疫应答,从而抑制调节性T细胞的活性,并通过促进IFN和IL-2释放,激活NK细胞和T细胞,增强其抗癌活性[3]。此外,雷利度胺还具有抗肿瘤细胞血管生成、免疫调节、直接抗肿瘤以及调节骨髓瘤微环境等作用[8]。有研究证明,肿瘤微环境在NHL的发病中有重要作用,因此雷利度胺可能可以用于治疗NHL[3]。
美国食品药品监督管理局根据一项134例复发性难治性MCL患者的Ⅱ期临床试验结果,在2013年批准了雷利度胺用于两种早期疗法治疗复发或进展的MCL患者[9]。在该研究中,所有患者曾单用或联用过利妥昔单抗、环磷酰胺、蒽环类抗生素。研究结果显示,经雷利度胺治疗后,患者总体反应率(overall response rates,ORR)为28%,完全缓解率(complete remission rate,CR)为7.5%,表明该药物对于治疗MCL有一定的作用[9]。此外,还有一项利用雷利度胺单药治疗15例复发性难治性MCL患者的研究,结果显示ORR为53%,CR为20%,中位无进展生存期(progression-free survival,PFS)为5.6个月[10]。另一项较大的调查研究中,研究人员选取57例复发性难治性MCL患者单用雷利度胺,其实际ORR和CR分别为35%和12%,中位PFS为8.8个月[11]。综上可知,雷利度胺单药治疗复发性难治性MCL有一定的疗效。此前Zaja等[12]报道用雷利度胺联合地塞米松治疗33例复发性难治性MCL患者,其ORR为52%,中位PFS为12个月,中位总生存期达20个月。由此可见,雷利度胺联合地塞米松治疗MCL较单药疗效更加明显。
本例患者AHSCT术后复发,综合考虑后,我们在疾病第1次复发时就采用雷利度胺联合地塞米松的方案治疗,取得了良好的临床疗效,肺部肿块在1个疗程后几乎完全消失。但是患者1年内再次复发,鉴于前次雷利度胺治疗对患者疗效明显,MCL第2次复发时对方案稍加改进,用雷利度胺联合COD方案治疗。期间患者出现血全细胞计数下降,并伴有严重的全身皮疹和瘙痒不适。雷利度胺治疗MCL最常见的3/4级不良事件(adverse events,AEs)是中性粒细胞减少(43%)、血小板减少(28%)以及贫血(11%);主要的1/2级AEs是皮疹,大约占22%,且一般可以用抗组胺药或低剂量类固醇控制[9]。故在使用雷利度胺治疗期间需定期检测血常规变化,当出现严重不良反应时应及时暂停用药。本文患者曾出现严重皮疹,全血细胞计数最低曾跌至:白细胞计数0.6×109/L,血红蛋白64 g/L,血小板计数9×109/L。我们先后使用了粒细胞集落刺激因子、西替利嗪、咪唑斯汀等对症治疗,并予输血支持治疗;患者血常规、皮疹等逐渐好转。后再次复查骨髓穿刺涂片,未见淋巴瘤细胞侵犯。
根据本例患者的诊治经过,结合目前相关文献,我们建议AHSCT后复发的MCL可以选择雷利度胺联合地塞米松方案作为挽救性治疗。然而后续治疗是用低剂量的雷利度胺维持治疗还是再进行多个疗程巩固治疗,还需要我们进一步探索。
1 Patricia PG, Martin Y, Adrian W. Mantle cell lymphoma: biology, pathogenesis, and the molecular basis of treatment in the genomic era[J]. Blood, 2011, 117(6):26-38.
2 Njue A, Colosia A, Trask PC, et al. Clinical efficacy and safety in relapsed/refractory mantle cell lymphoma: a systematic literature review[J]. Clin Lymphoma Myeloma Leuk, 2015, 15(1):1-12.
3 Ghosh N, Grunwald MR, Fasan O, et al. Expanding role of lenalidomide in hematologic malignancies[J]. Cancer Manag Res, 2015, 7:105-119.
4 叶宝东, 邵科钉, 陈丹, 等. 非清髓预处理后自体外周血造血干细胞移植治疗难治性重症肌无力远期疗效观察[J/CD]. 中华移植杂志:电子版, 2012, 6(2):105-108.
5 Michinori Ogura, Kiyoshi Ando, Tatsuya Suzuki, et al. A multicentre phase Ⅱ study of vorinostat in patients with relapsed or refractory indolent B-cell non-Hodgkin lymphoma and mantle cell lymphoma[J]. British Journal of Haematology, 2014, 165 (6):768-776.
6 Fu K, Weisenburger DD, Greiner TC, et al. CyclinD1-negative mantle cell lymphoma: a clinicopathologic study based on gene expression profiling[J]. Blood, 2005, 106(13):4315-4321.
7 Bertoni F, Rinaldi A, Zucca E, et al. Update on the molecular biology of mantle cell lymphoma[J]. Hematol Oncol, 2006, 24(1):22-27.
8 沈静, 刘卓刚. 来那度胺在血液和淋巴系统疾病治疗中的应用[J]. 实用药物与临床, 2014,(9):1188-1193.
9 Goy A, Sinha R, Williams ME, et al. Single-agent lenalidomide in patients with mantle-cell lymphoma who relapsed or progressed after or were refractory to bortezomib: phase Ⅱ MCL-001 (EMERGE) study[J]. J Clin Oncol, 2013, 31(29):3688-3695.
10 Habermann TM, Lossos IS, Justice G, et al. Lenalidomide oral monotherapy produces a high response rate in patients with relapsed or refractory mantle cell lymphoma[J]. Br J Haematol, 2009, 145(3):344-349.
11 Zinzani PL, Vose JM, Czuczman MS, et al. Long-term follow-up of lenalidomide in relapsed/refractory mantle cell lymphoma: subset analysis of the NHL-003 study[J]. Ann Oncol, 2013, 24(11):2892-2897.
12 Zaja F, De Luca S, Vitolo U, et al. Salvage treatment with lenalidomide and dexamethasone in relapsed/refractory mantle cell lymphoma: clinical results and effects on microenvironment and neo-angiogenic biomarkers[J]. Haematologica, 2012, 97(3):416-422.
(本文编辑:徐小明)
梁哲彬, 吴婷婷, 陈鑫丽, 等. 雷利度胺治疗自体造血干细胞移植后复发套细胞淋巴瘤一例并文献复习[J/CD]. 中华移植杂志: 电子版, 2016, 10(1):33-36.
Lenalidomide for the patient with mantle cell lymphoma who relapsed after autologous hematopoietic stem cell transplantation: a case report and review of the literature
LiangZhebin1,WuTingting1,ChenXinli1,LiuWenbin2,WuDijiong2,HuHuijin2,YuQinghong2,ShenYiping2,ZhouYuhong2,YeBaodong2.1TheFirstClinicalMedicalCollegeofZhejiangUniversityofTraditionalChineseMedicine,Hangzhou310053,China;2DepartmentofHematology,theFirstAffiliatedHospitalofZhejiangUniversityofTraditionalChineseMedicine,Hangzhou310006,China
YeBaodong,Email: 13588453501@163.com
Objective To evaluate the efficiency of Lenalidomide in relapsed/refractory mantle cell lymphoma. Methods A retrospective study was performed on 1 patient with relapsed mantle cell lymphoma after autologous hematopoietic stem cell transplantation(AHSCT). The patient was successively treated with Lenalidomide in combination with dexamethasone and COD(cyclophosphamide, vinorelbine and dexamethasone) respectively, and then discussed with literature. Results The patient achieved complete remission after Lenalidomide-based therapy, and now has been followed up for 6 months, and no recurrence of disease was found. Conclusions Lenalidomide has a good therapeutic effect for the relapsed/refractory mantle cell lymphoma,which can serve as an effective mean for relapsed mantle cell lymphoma after AHSCT.
Lenalidomide; Autologous hematopoietic stem cell transplantation; Mantle cell lymphoma
10.3877/cma.j.issn.1674-3903.2016.01.006
浙江省高校中青年学科带头人资助计划(GK2011,2012)
310053 杭州,浙江中医药大学第一临床医学院1; 310006 杭州,浙江中医药大学附属第一医院血液科2
叶宝东, Email: 13588453501@163.com
2015-12-01)
