子宫内膜异位症患者异位内膜组织中miR-556-3p、VEGF表达变化
2016-04-18易金玲沈艳丽冯文广刘雁林朱君
易金玲,沈艳丽,冯文广,刘雁林,朱君
(新疆医科大学第五附属医院,乌鲁木齐830011)
子宫内膜异位症患者异位内膜组织中miR-556-3p、VEGF表达变化
易金玲,沈艳丽,冯文广,刘雁林,朱君
(新疆医科大学第五附属医院,乌鲁木齐830011)
摘要:目的观察子宫内膜异位症(EM)患者异位内膜组织中miRNA(miR)-556-3p、血管内皮生长因子(VEGF)表达变化,分析miR-556-3p与VEGS表达的相关性。方法 选择EM患者36例为病例组,将病例组中卵巢异位内膜组织、腹膜异位内膜组织、在位内膜组织进一步分为病例1、2、3组。另选20例非子宫内膜病变患者,取正常子宫内膜组织为对照组。采用real-time PCR法检测miR-556-3p,Western blotting法检测VEGF蛋白,分析二者表达的相关性。结果病例1组、对照组miR-556-3p相对表达量高于病例2组、病例3组,病例3组miR-556-3p相对表达量高于病例2组(P均<0.05)。各组内增生期及分泌期内膜组织中miR-556-3p相对表达量差异无统计学意义。病例2组VEGF相对表达量高于其余3组,其中病例1组、病例3组VEGF相对表达量高于对照组(P均<0.05)。病例2、3组miR-556-3p与VEGF表达呈负相关关系(r分别为-1.687、-1.105,P均<0.05)。结论 EM患者异位内膜组织中miR-556-3p呈低表达、VEGF呈高表达,以腹膜异位内膜组织中表达变化最为明显。miR-556-3p、VEGF在EM患者腹膜异位内膜组织及在位内膜组织中表达呈负相关关系,二者可能与EM的发生发展有关。
关键词:子宫内膜异位症;微小RNA;微小RNA-556-3p;血管内皮生长因子
子宫内膜异位症(EM)是妇科常见的良性疾病,以痛经、月经异常、不孕等为主要症状。EM形成与发展的机制尚未完全阐明,大量研究发现EM发病与新生血管生成密切相关[1,2]。血管内皮生长因子(VEGF)是重要的血管生成因子,可直接作用于内皮细胞促使新生血管生成。miRNA是一种内生的非编码小RNA,可通过切断mRNA分子或抑制其翻译从而调控靶基因表达。研究[3]指出,miRNA表达模式异常导致的下游靶基因表达异常可能是EM发病的重要因素。本研究观察了EM患者卵巢、腹膜异位内膜组织和在位内膜组织中miRNA(miR)-556-3p、VEGF的表达变化,并分析miR-556-3p、VEGF表达的相关性。
1资料与方法
1.1 临床资料我院妇科2014年1~12月收治的Ⅲ、Ⅳ期EM患者36例(病例组),年龄(31.3±3.9)岁;孕次0次6例、1次19例、≥2次11例;均经腹腔镜手术或开腹手术观察及病理检查确诊,且同时出现卵巢及腹膜异位病灶;将病例组卵巢异位内膜组织、腹膜异位内膜组织、在位内膜组织进一步分为病例1、2、3组。选择同期收治的非子宫内膜病变患者20例,年龄(30.9±3.6)岁,孕次0次2例、1次11例、≥2次7例,取正常子宫内膜组织为对照组。患者月经周期规律,排除合并心血管系统及其他系统疾病患者、3个月内使用性激素治疗的患者、6个月内有妊娠和哺乳史者。病例组与对照组一般资料具有可比性。
1.2子宫内膜组织中miR-556-3p检测采用real-time PCR法。所有操作严格按说明书进行,并以U6为内参照。PCR反应条件:50 ℃ 2 min,95 ℃ 10 min,45个循环;95 ℃变性15 s,60 ℃退火及延伸30 s。实验重复3次,取均值,以2-ΔΔCt表示miR-556-3p相对表达量。
1.3子宫内膜组织中VEGF检测采用Western blotting法。先以RIPA裂解液提取组织蛋白,依次经制胶、上样、电泳、转膜、封闭等操作后,加入一抗(1∶1 000兔抗人VEGF和1∶1 000兔抗人GADPH)4 ℃孵育过夜,摇床摇动。TBST液清洗3次,每次5 min,后滴加经辣根过氧化物酶标记过的二抗,室温孵育1 h,摇床摇动。清洗,显色。以GADPH为内参照,用GIS1000分析软件对目的条带进行灰度值扫描分析,计算VEGF相对表达量。
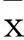
2结果
2.1各组miR-556-3p、VEGF表达比较病例1组、对照组子宫内膜组织中miR-556-3p相对表达量高于病例2组、病例3组,病例3组miR-556-3p相对表达量高于病例2组(P均<0.05)。病例2组子宫内膜组织中VEGF相对表达量高于其余3组,其中病例1组、病例3组VEGF相对表达量高于对照组(P均<0.05)。各组内增生期及分泌期内膜组织中miR-556-3p相对表达量差异无统计学意义(P均>0.05)。见表1、2。
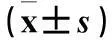
表1 各组子宫内膜组织中miR-556-3p、
注:与对照组相比,*P<0.05;与病例3组相比,#P<0.05;与病例1组相比,△P<0.05。
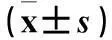
表2 各组增生期及分泌期子宫内膜组织中
2.2病例组子宫内膜组织中miR-556-3p与VEGF表达的相关性病例2、3组子宫内膜组织中miR-556-3p与VEGF表达呈负相关关系(r分别为-1.687、-1.105,P均<0.05)。
3讨论
EM为育龄妇女常见疾病,发病率为10%~15%[4]。虽然EM为良性疾病,但其有多种与恶性肿瘤类似的生物学行为[5]。EM的发生机制尚未明确,目前子宫内膜种植学说得到学者们广泛认可,但无法合理解释EM为何仅发生在一部分人群中。学者们经过进一步研究[6]认为EM发生是遗传因素、免疫因素、血管因素、雌激素及其受体等多因素共同作用的结果。近年来研究[7,8]表明,miRNA表达异常所致的表观遗传学紊乱可能是EM发生发展的重要机制。
miRNA是真核生物中广泛存在的一类单链小分子RNA,可调节细胞增殖、分化、凋亡等病理生理过程。研究表明,miRNA可能作为癌基因或抑癌基因参与多种肿瘤的发生和发展[9],其中miR-556-3p参与新生血管生成,VEGF是其靶基因[10]。本研究结果显示,不同月经周期的子宫内膜组织中miR-556-3p表达差异无统计学意义;病例1组、对照组子宫内膜组织中miR-556-3p相对表达量高于病例2组、病例3组,病例3组miR-556-3p相对表达量高于病例2组,提示miR-556-3p低表达可能与EM的形成有关,与张铭等[10]的结果一致。本研究中病例1组与对照组miR-556-3p表达差异无统计学意义,可能与组织细胞类型不同有关。
新生血管生成作为子宫内膜种植成功的重要条件,也被认为是EM形成的病理基础。研究发现,血管形成相关调控因子如VEGF、肿瘤坏死因子(TNF)等在EM的发生发展中发挥重要作用[11]。VEGF诱导的血管生成有利于月经期子宫内膜的修复。本研究结果显示,病例2组子宫内膜组织中VEGF相对表达量高于其余3组,其中病例1组、病例3组VEGF相对表达量高于对照组,提示VEGF对EM的发生有促进作用,且在腹膜异位病灶作用更强[12,13],这可能与腹膜异位内膜组织生长需要更多新生血管和营养物质有关。推测VEGF对EM的促进作用与下列因素有关[14]:促进新生血管生长和内膜细胞增殖;增加微血管通透性,使游离内膜组织获得更多的营养物质。
本研究还发现,病例2、3组子宫内膜组织中miR-556-3p与VEGF表达呈负相关关系,而病例1组中两者表达无相关性,出现这种情况的原因可能是一个生物学过程受到多个miRNA调控,不同的miRNA之间形成正负反馈共同调节疾病进展过程[10]。我们通过miRNA靶基因预测软件Targetscan6.2分析后发现,VEGF可能是miR-556-3p的靶基因。miR-556-3p低表达可能通过抑制相关mRNA降解或增加其翻译,上调VEGF表达,使新生血管生成增多,从而导致EM的形成和发展。
综上所述,EM患者异位内膜组织中miR-556-3p呈低表达、VEGF呈高表达,以腹膜异位内膜组织中表达变化最为明显。miR-556-3p的异常表达导致其靶基因VEGF表达增高可能是EM的重要发病机制。
参考文献:
[1] 王彦,郭维婵.血管生成在子宫内膜异位症形成中的研究进展[J].医学综述,2014,20(22):4111-4114.
[2] 蒋永容,陈川,张志敏,等.miRNA-122a靶基因预测及生物信息学分析[J]. 中国肿瘤临床,2011,38(16):931-934.
[3] Abe W, Nsau K, Nakada C, et al. miR-196b targets c-myc and Bcl-2 expression, inhibits proliferation and induces apoptosis in endometriotic stromal cells[J]. Hum Reprod, 2013,28(3):750-761.
[4] Sofo V, Gotte M, Lagana AS, et al. Correlation between dioxin and endometriosis: an epigenetic route to unravel the pathogenesis of the disease[J]. Arch Gynecol Obstet, 2015,292(5):973-986.
[5] 陈兵,梁立春,刘爽,等.VEGFR-3/CD31在子宫内膜异位症中的表达及临床意义[J].黑龙江医药科学,2014,37(4):1-4.
[6] 黎俊伶.子宫内膜异位症发病机制及药物治疗研究进展[J].右江医学,2013,41(3):431-433.
[7] Laudanski P, Charkiwicz R, Kuzmicki M, et al. MicroRNAs expression profiling of eutopic proliferative endometrium in women with ovarian endometriosis[J]. Reprod Biol Endocrinol, 2013,11(1):78-85.
[8] Braza-Boils A, Mari-Alexandre J, Gilabert J, et al. MicroRNA expression profile in endometriosis: its relation to angiogenesis and fibrinolytic factors[J]. Hum Reprod, 2014,29(5):978-988.
[9] Li C, Gao Y, Zhang K, et al. Multiple roles of microRNA-100 in human cancer and its therapeutic potential[J]. Cell Physiol Biochem, 2015,37(6):2143-2159.
[10] 张铭,张元珍,周春,等.子宫内膜异位症中miR-556-3p的异常表达及其与血管内皮生长因子的关系[J].中国优生与遗传杂志,2014,22(11):29-32.
[11] 李培硕,崔轶凡.TNF-α在子宫内膜异位症患者外周血中表达水平的Meta分析[J].中国妇幼保健,2014,29(18):3034-3036.
[12] 李水莲,莫超华.血管内皮生长因子在子宫内膜异位症中的表达及相关性研究[J].中国妇幼保健,2015,30(13):2094-2096.
[13] 王悦菲,黄娟,余星,等.上皮间质转化标记物及Snail在子宫内膜异位症中的表达[J].现代生物医学进展,2015,15(14):2718-2722.
[14] 魏静波,曲银娥.血管内皮生长因子及其受体在子宫内膜异位症中的表达和意义[J].中国免疫学杂志,2013,29(6):605-609.
(收稿日期:2015-11-09)
中图分类号:R711.52
文献标志码:B
文章编号:1002-266X(2016)07-0050-03
doi:10.3969/j.issn.1002-266X.2016.07.018
基金项目:新疆维吾尔自治区自然科学基金资助项目(2014211C123)。
