细黄链霉菌对黄芩抗根腐病的诱导反应
2016-04-17李堆淑
李堆淑
(商洛学院生物医药与食品工程学院,陕西商洛726000)
细黄链霉菌对黄芩抗根腐病的诱导反应
李堆淑
(商洛学院生物医药与食品工程学院,陕西商洛726000)
为研究细黄链霉菌诱导黄芩对黄芩根腐病菌的抑制效果,采用不同浓度细黄链霉菌发酵液、无菌水(CK)分别浸泡黄芩幼苗的根8h,幼苗移栽后在黄芩幼苗根部接种5mL黄芩根腐病菌菌悬液,待幼苗生长至4叶期时,不同时间内测定黄芩叶片的CAT、POD和AAO活性。结果表明,不同浓度细黄链霉菌发酵液对黄芩叶片中CAT、POD、AAO活性的影响比较显著,随着细黄链霉菌发酵液浓度的减小,黄芩叶片中CAT、POD、AAO活性总体的趋势先增加后减小;当细黄链霉菌发酵液稀释到50倍时,黄芩叶片中POD、AAO活性一直比其他浓度的发酵液诱导的黄芩叶片中POD、AAO活性强,而黄芩叶片中CAT活性除了在12h和24h外,其余时间均高于其他浓度的发酵液诱导处理。细黄链霉菌发酵液诱导黄芩,其体内的CAT、POD、AAO活性均高于CK,说明细黄链霉菌对黄芩根腐病菌的抗病性比较显著。
细黄链霉菌;黄芩;黄芩根腐病;诱导;抗病性
黄芩(Scutellaria baicalensis Georgi)为唇形科多年生草本植物,其茎叶和根均含有总黄酮,具有抗炎、抗菌、抗病毒、抗肿瘤、抗氧化、镇痛、解热等作用[1]。生产上,黄芩根腐病、根结线虫病、白粉病和叶枯病等蔓延较快,尤以黄芩根腐病危害较严重。黄芩根腐病为土传病害,病原菌为半知菌亚门腐皮镰孢霉菌,寄生在土壤中,待到条件适宜时先侵染幼苗根部和茎基部,造成根部腐烂,严重时导致全株死亡。根腐病病原菌产生的分生孢子可以通过水流或土壤进行扩散[2-3]。黄芩根腐病主要以化学农药防治,此方法虽见效快,但具残留污染环境。生物农药主要通过农用抗生素产生能抑制或杀死作物的病原菌的微生物次生代谢产物[4],生物农药防治病害不但无污染,而且对处理的生物几乎不产生影响,更不会破环生态平衡。应用根际细菌和植物的内生放线菌不但能拮抗病原菌而且能促进植物生长[5-7],细黄链霉菌(Streptmyces microflavus)是链霉菌属放线菌,对细菌、酵母菌、真菌都有抑制作用[8]。用诱导剂能诱导植物内源信号分子积累并传输至全株,导致植物产生一些抗病相关的酶而获得长期的抗性[911],达到防治病害的目的。目前,有关细黄链霉菌诱导黄芩,使其产生抗病性的研究还鲜有报道。因此,笔者用不同浓度的细黄链霉菌发酵液浸泡黄芩幼苗的根,研究黄芩在不同生长时间的过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸氧化酶(AAO)活性的影响,以探讨细黄链霉菌对黄芩根腐病菌的抗病性反应,为黄芩根腐病的生物防治提供参考。
1材料与方法
1.1试验材料
黄芩种子购于商洛天士力医药有限公司,黄芩根腐病菌由商洛学院生物医药与食品工程学院微生物实验室从黄芩根部分离鉴定,细黄链霉菌购于陕西省微生物研究所。培养基为PDA固体培养基、高氏一号(GA)固体培养基、种子培养基及发酵培养基。
1.2黄芩根腐病菌菌液和细黄链霉菌发酵液的制备
将活化的黄芩根腐病菌菌液浓度稀释为107cfu/mL的菌悬液,即得黄芩根腐病菌菌液。
将活化的细黄莲霉菌接种于装有100mL种子培养基的250mL锥形瓶中,在28℃、150r/min振荡培养5d,以20%的接种量转接到100mL发酵培养基的锥形瓶中,振荡培养5d,发酵液经0.22μm微孔滤膜过滤得滤液即为细黄链霉菌发酵液。
1.3黄芩幼苗的培养与采样
挑选饱满、大小一致的黄芩种子蒸馏水清洗,1%NaClO3消毒10min,再用蒸馏水冲洗,风干后放在铺有双层滤纸的干净培养皿中,每皿放100粒。于25℃的培养箱培养,保持种子湿润。待黄芩幼苗约5cm左右,分别用CK(无菌水)、细黄链霉菌发酵滤液浓度稀释为10倍,20倍,50倍,100倍的溶液浸泡黄芩幼苗根8h后,移栽至上口径为10cm的小花盆中用沙质土壤培养,然后在每株黄芩根部注入5mL的黄芩根腐病菌菌悬液,待幼苗生长至4叶期时,每隔12h采样酶活性测定。
1.4酶活性的测定
过氧化氢酶(CAT)活性测定采用比色法[12],样品在1min内240nm处吸光度每变化0.1为1个CAT酶活单位;过氧化物酶(POD)活性测定用愈创木酚法[13],抗坏血酸氧化酶活性测定用淀粉溶液及碘液滴定法[13]。
1.5数据处理
数据的统计分析采用Mircosoft office 2003 Excel和SPSS17.0进行。
2结果与分析
2.1黄芩幼苗的CAT活性
如图1所示,在不同时间诱导处理条件下,不同浓度的细黄链霉菌发酵液对黄芩幼苗的CAT活性均有显著的影响。各处理幼苗的CAT活性均大于CK,随着发酵液浓度的升高,黄芩幼苗的CAT活性也有所增加。在36h时,不同浓度处理的黄芩CAT活性均达到最高峰,但发酵液浓度稀释50倍的黄芩CAT活性的最高峰[139.12U/(g·min)]比CK处理的[101.24U/(g·min)]高37.42%,比稀释10倍处理的[110.27U/(g·min)]高26.16%,比稀释20倍处理的[136.34U/(g· min)]高2.00%,比稀释100倍处理的[115.61U/(g·min)]高20.34%,可见,细黄链霉菌发酵液最佳的诱导抗病效果为稀释50倍。经多重比较,CK和稀释10倍的黄芩发酵液CAT活性无显著差异(P=0.080>0.05);但CK和稀释10倍的黄芩发酵液CAT活性分别与稀释20倍、50倍及100倍间的差异显著(P<0.05);发酵液稀释20倍和50倍的黄芩CAT活性间无显著差异(P=0.531>0.05),但均与CK、稀释10倍、100倍间的差异显著(P<0.05);稀释100倍的黄芩CAT活性分别与CK、稀释10倍、20倍及50倍间的差异显著(P<0.05)。

图1 不同浓度的细黄链霉菌发酵液处理黄芩的CAT活性Fig.1 CAT activity of S.baicalensis seedlings inoculated with different concentrations of S.microflavus fermentation broth
2.2黄芩幼苗的POD活性
由图2可知,不同浓度的细黄链霉菌发酵液对黄芩幼苗的POD活性均有显著的影响。其中CK、发酵液浓度稀释10倍、20倍、50倍处理的黄芩POD活性均在24h时达到峰值,分别为279.56U/(g·min)、302.23U/(g·min)、312.61U/(g· min)、386.32U/(g·min),而发酵液浓度稀释为100倍处理的黄芩POD活性均在36h达到峰值,酶活为315.61U/(g·min)。可见,发酵液浓度稀释50倍处理的黄芩POD活性峰值最大,比CK、发酵液浓度稀释10倍、20倍、100倍处理的黄芩POD活性的峰值分别高38.19%、27.82%、23.58%和22.40%。说明,POD活性随着发酵液浓度的增加而增加,且高浓度的发酵液不利于黄芩幼苗的POD产生,低浓度的发酵液能促进黄芩幼苗产生POD。用多重因素分析,发酵液稀释10倍、20倍的黄芩POD活性无显著差异(P=0.289>0.05),而其分别与CK、发酵液稀释50倍、100倍差异显著(P<0.05);发酵液稀释20倍、100倍的黄芩POD活性无显著差异(P=0.114>0.05),而其分别与CK、发酵液稀释10倍、50倍差异显著(P<0.05);CK、发酵液稀释50倍的黄芩POD活性两两之间差异性显著,并且分别与其他发酵液浓度差异比较显著(P<0.05)。
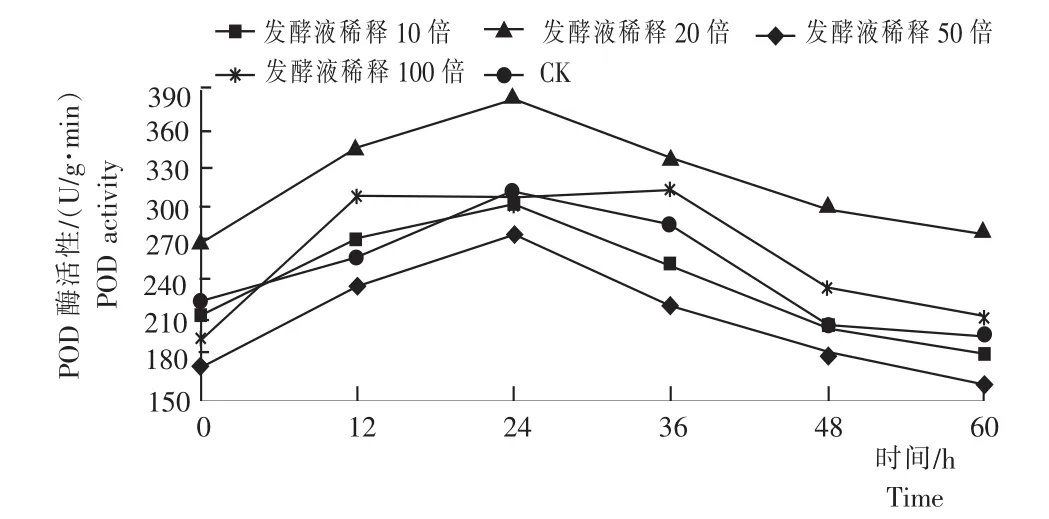
图2 不同浓度的细黄链霉菌发酵液处理黄芩的POD活性Fig.2 POD activity of S.baicalensis seedlings inoculated with different concentrations of S.microflavus fermentation broth
2.3黄芩幼苗的AAO活性
从图3看出,不同时间内细黄链霉菌对黄芩幼苗的抗坏血酸氧化酶(AAO)活性均有显著的影响,且均随着时间的增加其AAO活性逐渐增加,到36h时出现峰值。不同浓度的发酵液处理黄芩,其AAO活性均大于CK。发酵液稀释50倍黄芩幼苗的AAO活性[50.69U/(g·min)]峰值最高,比CK、稀释10倍、20倍、100倍黄芩幼苗的AAO活性峰值分别高25.97%、17.31%、8.22%、4.26%。说明,诱导促进黄芩幼苗的AAO活性细黄链霉菌发酵液最佳稀释浓度为稀释50倍。
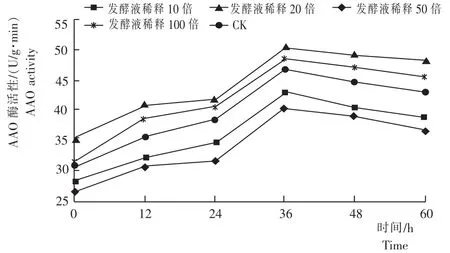
图3 不同浓度的细黄链霉菌发酵液处理黄芩的AAO活性Fig.3 AAO activity of S.baicalensis seedlings inoculated with different concentrations of S.microflavus fermentation broth
3结论与讨论
1)用诱导剂诱导植物,植物产生的SAR能提高植物的抗病性,如果病原菌侵染植物,植物体内的内源信号分子开始大量积累,信号分子开始向整个植株各个器官传输,然后启动相关防御基因的表达,使植物体内的防御酶系活化、植物保卫素、木质素合成及产生病程相关蛋白(PR蛋白),从而寄主植物可以获得长期的抗性。如植物没有受病原菌侵染,用诱导剂诱导后,同样植物体内能积累大量的内源信号分子,并且向全株传输,植物可以获得长期的抗性[1415]。本研究用不同浓度的细黄链霉菌发酵液分别诱导处理黄芩幼苗的根,幼苗移栽后在黄芩幼苗根部接种黄芩根腐病菌,待幼苗生长至4叶期时,不同时间内细黄链霉菌对其体内CAT、POD、AAO活性随着浓度的升高先上升后下降,同一浓度随着时间的增加先升高后下降。不同浓度细黄链霉菌发酵液处理黄芩,其体内的3种酶活性均高于CK,并且均是细黄链霉菌发酵液浓度稀释50倍的黄芩体内的3种酶活性最高。不同时间分别用CK和不同浓度的发酵液处理黄芩,其AAO活性两两之间差异显著(P<0.05),而CAT和POD活性在不同浓度和不同时间有差异显著的(P<0.05),也有不显著的(P>0.05)。过氧化氢酶是在生物正常细胞内清除氧自由基和生物防御系统的关键酶之一,病原菌感染后引起氧化应激在不同程度上激活了体内的抗氧化防御体系,产生抗病作用。CAT活性的升高可能是因植物体内的过氧化氢产物增多而启动的应激体制,当植物体内过氧化氢产物积累到一定水平时,超出了自身调节的值,酶活性就开始降低。POD活性对植株体内的内源激素合成有一定的调节功能。AAO活性表现出了“低浓度促进高浓度抑制”的浓度双重效应,因此,不同浓度的细黄链霉菌发酵液诱导黄芩,可以使黄芩植株增强防御反应,进而增强其抗病性。
2)陈杰等[16]筛选出的多产色链霉菌(S.polychromogenes)、球孢链霉菌球孢亚种(S.globisprus subsp.Globisporus)及锈赤蜡黄链霉菌(S.rubiginosohelvolus)对马铃薯土传病病原立枯丝核菌(Rhizoctonia solani)、茄病镰刀菌(Fusarium solani)及硫色镰刀菌均有较强的拮抗作用。段佳丽[17]通过田间试验,证实了生防放线菌防治丹参根腐病菌的效果显著,同时证明了放线菌剂作用的微生态机理。中生菌素除了能抑制病原菌,还能诱导水稻植株体内的PAL、POD、PPO等防御酶活性大幅提高,起到了防治病害的作用[18]。许英俊等[19]研究了生防菌接种后可提高草莓新叶和根系PPO活性,产生诱导抗性。薛磊[20]研究出了防治棉花黄萎病的高效多功能生防放线菌菌株。李增波等[21]研究表明,生防菌剂对草莓有较强的防病作用,同时还能使草莓植株健壮旺盛,根系发达,具有促生效果。这些研究结果与本研究结果基本一致。隋丽等[22]用放线菌769发酵液对水稻的抗性诱导机制做了研究,结果发现769菌株发酵液可抑制水稻体内过氧化氢酶(CAT)的活性,提高POD和PAL活性。此研究的生防放线菌抑制水稻体内CAT的活性与本研究的结果相反,还需要进一步探讨。
[1]梁 英,韩鲁佳.黄芩中黄酮类化合物药理学作用研究进展[J].中国农业大学学报,2003,8(6):9-14.
[2]苏淑欣,李 世,刘海光,等.黄芩病虫害调查报告[J].承德职业学院学报,2005(4):82-83.
[3]郭巧生.药用植物栽培学[M].北京:高等教育出版社,2004:287-290.
[4]陈敏纯,廖美德,夏汉祥.农用抗生素作用机理简述[J].世界农药,2011,33(3):13-16.
[5]杨海莲,孙晓璐,宋 未.植物根际促生细菌和内生细菌的诱导抗病性的研究进展[J].植物病理学报,2000,30(2):106-110.
[6]Conn V M,Walker A R,Franco C M M.Endophytic actinobacteria induce defense pathways in Arabidopsis thaliana[J].Molecular Plant-Microbe Interactions,2008,21:208-218.
[7]El-Tarabily K A,Nassar A H,Hardy G,et al.Plant growth promotion and biological control of Pythium aphanidermatum,apathogen of cucumber,by endophytic actinomycetes[J].Journal of Applied Microbiology,2009,106:13-26.
[8]谭之磊,王来福,肖湘政,等.细黄链霉菌005发酵条件优化及在玉米上的应用[J].中国土壤与肥料,2008 (2):61-64.
[9]范志金,刘秀峰,刘凤丽,等.植物抗病激活剂诱导植物抗性的研究进展[J].植物保护学报,2005,32(1):87-92.
[10]Sun A Z,Nie S J,Xing D,et al.Nitric Oxide-Mediated Maintenance of Redox Homeostasis contributes to NPR1-Dependent plant innate immunity triggered by lipopolysaccharides[J].Plant Pathol,2012,160 (2):1081-1096.
[11]Scalschi L,Vicedo B,Camanes G,et al.Hexanoic acid is a resistance inducer that protects tomato plants against Pseudomonas syringae by priming the jasmonic acid and salicylic acid pathways[J].Mol Plant Pathol,2013,14(4):342-355.
[12]高俊凤.植物生理学实验技术[M].北京:世界图书出版公司,2000:195-199.
[13]张龙翔.生化实验方法与技术[M].2版.北京:高等教育出版社,1997:179.
[14]程世亚,袁 澍,席德慧,等.植物系统获得性抗性的分子机理[J].生命的化学,2008,28(3):256-259.
[15]Garcia-Brugger A,Lamotte O,Vandelle E.Early signaling events induced by elicitors of plant defenses [J].Mol Plant Microbe In,2006,19(7):711-724.
[16]陈 杰,杨 琳,郭天文,等.马铃薯土传病原真菌拮抗放线菌的抗病促生作用[J].西北农林科技大学:自然科学版,2014,42(10):111-119.
[17]段佳丽.丹参根部病害发生微生态机制与放线菌促生作用研究[D].杨凌:西北农林科技大学,2013:79-81.
[18]朱茂山.番茄灰霉菌拮抗放线菌及抑菌活性物质研究[D].沈阳:沈阳农业大学,2014:15-17.
[19]许英俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响[J].西北农业学报,2007,16(6):146-153.
[20]薛 磊.棉花黄萎病生防链霉菌的抗病促生作用及其机制研究[D].杨凌:西北农林科技大学,2012:131-192.
[21]李增波,薛泉宏,粱军峰,等.一株生防放线菌AL-04的防病促生作用[J].农药,2009,48(1):74-76.
[22]隋 丽,徐文静,杜 茜,等.放线菌769发酵液对水稻体内主要防御酶活性的影响[J].吉林农业大学学报,2009,31(4):382-384,389.
(责任编辑:聂克艳)
Induced Reaction of Streptomyces microflavus to Fusarium solani in Scutellaria baicalensis
LI Duishu
(College of Biomedicine and Food Engineering,Shangluo College,Shangluo,Shaanxi 726000,China)
The cutellaria baicalensis seedlings’roots were first soaked with different concentration of S.microflavus fermentation broth and sterile water(CK)respectively,then the transplanted seedlings’roots inoculated with 5mL F.solani suspension and finally the CAT,POD and AAO activity of the S.baicalensis seedlings with four leaves was determined at different time to study the inhibition effect of S.baicalensis inducted with S.microflavus against F.solani.Results:The concentration of S.microflavus fermentation broth has the significant effect on CAT,POD and AAO activity of the S.baicalensis seedlings and the leaf CAT,POD and AAO activity represents a first increase and then decrease trend overall with decrease of S.microflavusfermentation broth concentration.The leaf POD and AAO activity still is higher than other treatments when S.microflavus fermentation broth is diluted to 50 times but the leaf CAT activity is higher than other treatments except for determination values at 12hand 24h.The leaf CAT,POD and AAO activity of S.baicalensis seedlings treated with S.microflavus fermentation broth is higher than CK,which indicates S.microflavus is of the significant resistance to F.solani of S.baicalensis.
Streptomyces microflavus;Scutellaria baicalensis;Fusarium solani;induction;resistance
S436.412.13
A
1001-3601(2016)02-0072-0089-04
2015-06-10;2016-01-14修回
陕西省教育厅科学研究计划项目“生防放线菌诱导商洛黄芩抗根腐病及促生性研究”(2013JK0737)
李堆淑(1977-),女,副教授,硕士,从事植物病理生理学及微生物研究。E-mail:lds1202@163.com
