藏灵菇源克鲁维酵母菌M3调节大鼠肠道菌群平衡的研究
2016-04-15董牧群熊利霞谢远红张红星连正兴北京农学院食品科学与工程学院微生态制剂关键技术开发北京市工程实验室食品质量与安全北京实验室北京006中国农业大学动物科技学院北京0009
董牧群,熊利霞,谢远红,张红星,刘 慧,*,贾 慧,连正兴(.北京农学院食品科学与工程学院,微生态制剂关键技术开发北京市工程实验室,食品质量与安全北京实验室,北京 006;.中国农业大学动物科技学院,北京 0009)
藏灵菇源克鲁维酵母菌M3调节大鼠肠道菌群平衡的研究
董牧群1,熊利霞1,谢远红1,张红星1,刘 慧1,*,贾 慧1,连正兴2
(1.北京农学院食品科学与工程学院,微生态制剂关键技术开发北京市工程实验室,食品质量与安全北京实验室,北京 102206;2.中国农业大学动物科技学院,北京 100091)
摘 要:利用从藏灵菇中筛选出的发酵性能优良且产胆盐水解酶的马克斯克鲁维酵母菌M3菌株,制备冻干菌粉作为受试物进行动物实验,探讨其对预防性高胆固醇血症大鼠肠道菌群平衡的作用。采用预防高胆固醇血症大鼠模型,将40 只无特定病原体(specific pathogen free,SPF)级3 周龄的大鼠分为高脂模型组、低剂量、中剂量和高剂量实验组进行实验。实验组分别灌胃低、中、高剂量的受试物,高脂模型组灌胃蒸馏水,连续7 周。结果表明,前5 周4 组大鼠粪便中乳酸杆菌(lactobacilli)、沙门氏菌(Salmonella)、产气荚膜梭菌(Clostridium perfringens)的数量处于平缓变化状态,且3 个实验组与高脂模型组相比无显著性差异;5 周时,3 个实验组大鼠粪便中乳杆菌的数量极显著高于高脂模型组(P<0.01),沙门氏菌的数量极显著低于高脂模型组(P<0.01),产气荚膜梭菌的数量显著低于高脂模型组(P<0.05);其中低剂量组的乳杆菌数量最高而沙门氏菌和产气荚膜梭菌数量最低,说明低剂量实验组优于中、高剂量实验组。显示藏灵菇源克鲁维酵母菌M3能够调节高胆固醇血症大鼠肠道有益菌的生长,并抑制有害菌的繁殖,具有良好的调节肠道菌群平衡的效果。
关键词:藏灵菇;马克斯克鲁维酵母菌;动物实验;肠道菌群平衡
引文格式:
董牧群,熊利霞,谢远红,等.藏灵菇源克鲁维酵母菌M3调节大鼠肠道菌群平衡的研究[J].食品科学,2016,37(5):197-201.DOI:10.7506/spkx1002-6630-201605035.http://www.spkx.net.cn
DONG Muqun,XIONG Lixia,XIE Yuanhong,et al.Regulatory effect of Kluyveromyces marxianus M3 isolated from Tibetan kefir on the intestinal flora balance in rats[J].Food Science,2016,37(5):197-201.(in Chinese with English abstract)
肠道菌群是一个复杂的微生态系统,在正常生理条件下参与维生素的合成、胆汁酸的降解、营养物质的消化及局部和全身的免疫[1]。肥胖、高脂血症、糖尿病等代谢性疾病及抗生素等药物的使用,均会引起肠道菌群失衡[2]。当肝脏发生病变时,会造成脂质代谢紊乱,肝细胞胆汁排泌减少,肠蠕动减慢,微绒毛损伤,消化道功能减弱,肠道清除、排空能力降低[3],肠道抗体、溶菌酶、黏液分泌减少,肠壁局部抵抗力下降[4],使得有害菌数量增长甚至占优势,造成严重的肠道菌群失衡。有研究报道,肝功能损害越严重肠道菌群失调越严重[5]。
课题前期采用高通量筛选技术,从藏灵菇中分离筛选并鉴定出发酵性能优良的马克斯克鲁维酵母菌(Kluyveromyces marxianus)M3,经实验证明K.marxianus M3可在生长代谢过程中产生高活力胆盐水解酶,且产量较高;又经体外实验证明其具有较强的耐胃肠道逆环境特性和良好的降胆固醇功效[6]。
目前,国内外对乳酸菌调节肠道菌群平衡的研究报道颇多,而对酵母菌调节肠道菌群平衡的研究少见报道。伍静等[7]利用抗生素干扰建立小鼠肠道菌群失衡模型,并利用乳酸杆菌制剂进行调节治疗。Angelakis等[8]研究了乳酸菌对小鼠体质量、肠道菌群的作用。Bruzzese等[9]利用乳酸菌对患有囊胞性纤维症的儿童进行随机临床实验,证明其对肠道菌群失衡和肠炎有恢复作用。童佩[10]探讨了布拉酵母调节儿童肠道菌群失调造成的便秘与腹泻的疗效。有关藏灵菇源马克斯克鲁维酵母菌促进有益菌的生长,调节肠道菌群平衡的研究尚未见报道。本实验通过对预防性高胆固醇血症大鼠灌胃不同剂量马克斯克鲁维酵母菌M3,检测大鼠粪便中乳酸杆菌(lactobacilli)、沙门氏菌(Salmonella)、产气荚膜梭菌(Clostridium perfringens)的活菌数量,研究马克斯克鲁维酵母菌M3调节预防性高胆固醇血症大鼠肠道菌群平衡的效果,旨在为开发研制酵母菌功能性食品提供科学理论依据。
1 材料与方法
1.1材料
1.1.1菌株
马克斯克鲁维酵母菌(Kluyveromyces marxianus)M3,从藏灵菇中筛选并鉴定为高产胆盐水解酶的菌株[11]。
优化发酵条件下对马克斯克鲁维酵母菌M3进行发酵培养,经离心浓缩和真空冷冻干燥后,得到活菌数量达108CFU/g的冻干菌粉,与温热蒸馏水以1∶5(m/V)的比例制备受试物。
1.1.2动物
40 只3 周龄无特定病原体(specific pathogen free,SPF)级断乳健康雌性Wistar大鼠,体质量130~150 g,由北京维通利华实验动物技术有限公司提供,动物许可证编号SCXK(京)2006-0009。
1.1.3动物饲料与灌胃剂量
SPF级高脂饲料(78.8%基础饲料、1%胆固醇、10%蛋黄粉、10%猪油、0.2%胆盐)、SPF级基础饲料(20.8%粗蛋白、4.5%粗脂肪、6.83%粗灰分、10%水分、4.4%粗纤维、1.23%钙、0.96%磷),均由北京科澳协力饲料有限公司提供,许可证编号SCXK(京)2009-0012。
低、中、高剂量实验组分别以体质量按照0.5、1.0、2.0 mL/(100 g• d)进行受试物灌胃,高脂模型组灌胃蒸馏水。
1.1.4培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯200.0、葡萄糖20.0、琼脂15.0。
乳酸细菌琼脂培养基(MRS)(g/L):蛋白胨10.0、牛肉粉5.0、酵母粉4.0、葡萄糖20.0、磷酸氢二钾2.0、乙酸钠5.0、柠檬酸三铵2.0、硫酸镁0.2、硫酸锰0.05、琼脂15.0,吐温-80 1.0 mL,pH值调至6.2±0.1。
亚硫酸铋琼脂培养基(BS)(g/L):蛋白胨10.0、牛肉粉5.0、葡萄糖5.0、磷酸氢二钠4.0、硫酸亚铁0.3、亚硫酸钠6.0、柠檬酸铋铵2.0、煌绿0.025、琼脂18.0,pH值调至7.5±0.1。
亚硫酸盐-多粘菌素-磺胺嘧啶琼脂基础培养基(sulfite polymixin sulphadiazine agar,SPS)(g/L):胰酪胨15.0、酵母粉10.0、柠檬酸铁0.5、琼脂15.0,pH值调至7.0±0.1。
Biolog鉴定仪专用[12]标准BUY(biolog universal yeast)培养基和YT微孔接种板。
1.2 仪器与设备
7080型日立全自动生化分析仪 日本日立公司;752紫外-可见分光光度计 北京东南仪城实验室设备厂;TGL-20M型高速台式冷冻离心机 上海卢湘仪离心机厂;Biolog MicroStation微生物快速鉴定仪 美国Biolog公司;Moticam1300数码显微摄像系统 Motic实业集团;DL-CJ-IND型无菌超净工作台 北京东联哈尔仪器制造有限公司;SKP-02.500型恒温培养箱 黄石恒丰医疗器械有限公司。
1.3方法
1.3.1饲养条件
实验大鼠于北京大学医学部动物实验室饲养。大鼠均饲养于SPF级环境,5 只/笼,自由采食、采水,室内通风条件良好,正常昼夜变化,相对湿度为40%~70%,室温18~24 ℃。
1.3.2分组与处理
实验大鼠适应性饲养7 d后,将大鼠分为高脂模型组、低剂量、中剂量和高剂量实验组,实验大鼠均饲喂高脂饲料,实验组灌胃受试物,高脂模型组灌胃蒸馏水,连续7 周。每周称体质量1 次,并依此调整灌胃量。
1.3.3粪便的采集
在动物实验第1、3、5、7周的第7天,轻轻挤压大鼠直肠部,分别收集新鲜粪便约2 g于无菌试管中,并立即将试管放入厌氧罐中。
1.3.4酵母菌的分离与鉴定
于10 mL PDA液体培养基中加入1 g大鼠粪便(采集于实验第1周),富集培养18~24 h,稀释后采用酸化PDA培养基(用0.1 g/mL的酒石酸水溶液调节灭菌后的PDA培养基至pH 3.5)进行涂布平板法分离,挑取表面光滑的乳白色圆形菌落,进行纯化培养,获得待鉴定菌种[12]。
鉴定流程:待鉴定菌种单个菌落→连续划线BUY平板→26 ℃培养24~48 h→用无菌纯净水制备菌悬液→浊度计调整浊度为(47±3)% T→接种于YT微孔接种板→26 ℃培养24~48 h→自动微生物鉴定仪读取鉴定结果。
1.3.5乳杆菌、沙门氏菌和产气荚膜梭菌的平板培养与计数
取1 g动物粪便于9 mL无菌生理盐水中匀浆混匀,稀释梯度为10-1~10-8,根据预实验结果,选择适当的3 个稀释度,分别取0.1 mL稀释液均匀涂布于相应的平板培养基上,每个稀释梯度设3 个重复。乳酸杆菌采用MRS培养基在(36±1) ℃厌氧条件下培养48 h后计数;沙门氏菌采用BS培养基(36±1) ℃条件下培养24 h后计数黑色、有金属光泽菌落;产气荚膜梭菌采用SPS培养基在(36±1) ℃厌氧条件下培养48 h后计数黑色菌落[13]。
培养后观察平板上菌落特征,挑取符合3 种肠道菌菌落形态的菌落,进行革兰氏染色并观察菌体形态。确定为所需菌种后计数菌落数量,计算每克湿粪便中3 种肠道细菌的活菌数量。
1.3.6调节肠道菌群平衡结果判断标准
采用方差分析法进行统计分析,根据给予受试物前后各组大鼠肠道菌群值的变化进行评价[14]:1)粪便中双歧杆菌和(或)乳杆菌增加,产气荚膜梭菌减少或不增加,拟杆菌、肠杆菌和(或)肠球菌减少或无明显变化;2)粪便中双歧杆菌和(或)乳杆菌增加,产气荚膜梭菌减少或不增加,拟杆菌、肠杆菌和(或)肠球菌明显增加,但增加幅度低于双歧杆菌和(或)乳杆菌增加的幅度。符合以上任一标准,并存在显著差异,即可判定受试物具有调节肠道菌群平衡的作用。
1.3.7菌落总数测定
参照GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[15]方法进行测定。
1.4数据处理
2 结果与分析
2.1酵母菌分离与鉴定结果
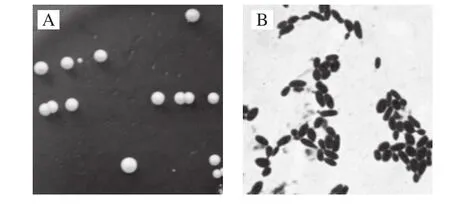
图1 分离酵母菌M3-ds的菌落形态及革兰氏染色图Fig.1 Colony morphology and Gram staining of M3-ds
利用从藏灵菇中筛选的马克斯克鲁维酵母M3菌株制备的冻干菌粉对大鼠进行灌胃实验后,从大鼠粪便中分离的酵母菌只有M3-ds菌株。由图1可知,酵母菌M3-ds在PDA培养基上的菌落呈乳白色,微隆起,表面光滑,不透明,有光泽的圆形菌落(图1A),革兰氏染色图显示其菌体形态(图1B)与马克斯克鲁维酵母菌M3(图2)相似(与课题前期实验结果相同[16]),经微生物快速鉴定仪鉴定为马克斯克鲁维酵母菌,由此进一步证明了藏灵菇源马克斯克鲁维酵母M3具有良好的耐受胃肠道逆环境能力[17]。
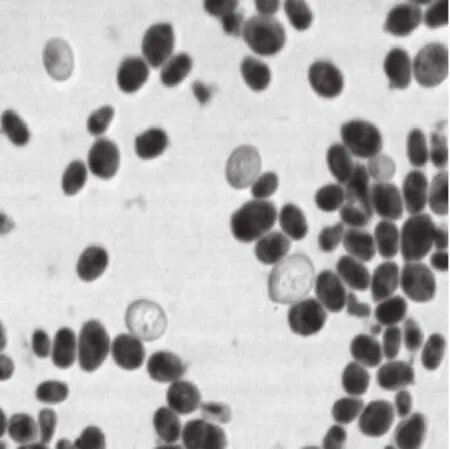
图2 马克斯克鲁维酵母菌M3革兰氏染色图Fig.2 Gram staining of M3
2.2藏灵菇源马克斯克鲁维酵母菌M3对大鼠体质量的影响

表1 藏灵菇源酵母冻干菌粉对大鼠体质量的影响(x =10)Table 1 Effect of lyophilized Kluyveromyces marxianus from Tibetan kefir on body mass of rats(x ,= 10)
由表1可知,大鼠的体质量随着喂养时间的延长,低、中、高剂量实验组大鼠体质量与高脂模型组基本无差异(P>0.05),表明藏灵菇源马克斯克鲁维酵母菌M3对大鼠体质量基本无影响。
2.3藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中乳杆菌数量的影响

±s,n==1100)Table 2 Effect of表2 藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中乳杆菌数量的影响(xf Kluyveromyces marxiannuuss M3 on total lactobacillii count in the intestinal tract of rats(x ± s,,n = 1100))lg(CFU/g)
在机体肠道内,作为人体和动物肠道内定殖且占绝对优势的一类生理活性菌,乳酸杆菌可通过产生乳酸、乙酸、过氧化氢等抗菌物质,对维持宿主肠道健康产生有益影响,因此乳酸杆菌数量的增加对维持肠道菌群平衡具有重要作用,且有利于提高机体健康水平[18]。由表2可知,实验初期4 组大鼠粪便中乳酸杆菌的数量相差无几。1~3周期间,高脂模型组大鼠粪便中乳酸杆菌的数量随着大鼠的成长未发生显著变化,增势缓慢;3个实验组乳杆菌的数量呈平缓上升趋势,增量较为明显。从第5周测得数据可知,3个实验组大鼠粪便中乳酸杆菌的数量极显著(P<0.01)高于高脂模型组,第5周时低剂量实验组数量最高,第7周时中剂量实验组数量最高。这可能是因为实验的前5周,藏灵菇源马克斯克鲁维酵母菌M3菌株开始在肠道中定殖并大量繁殖至占有一定优势,5周后开始发挥作用,促进了乳酸杆菌的繁殖。综上,藏灵菇源马克斯克鲁维酵母菌M3能够极显著提高大鼠肠道乳酸杆菌的数量,以低、中剂量效果最为明显。
2.4藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中沙门氏菌数量的影响
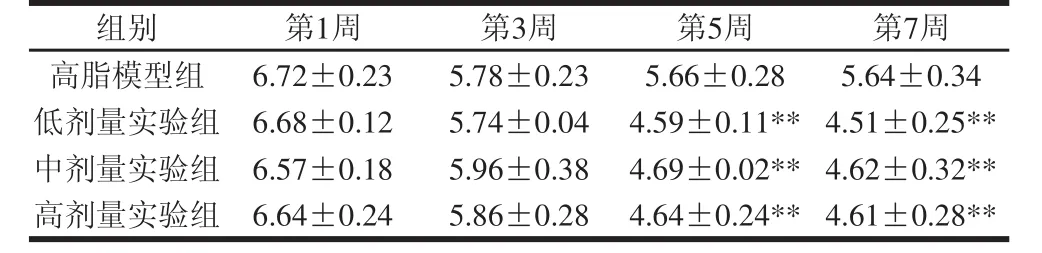
表3 藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中沙门氏菌数量的影响(x =10)Table 3 Effect of Kluyveromyces marxianus M3 on Salmonella count in the intestinal tract of rats(x ,= 10)lg(CFU/g)
在机体肠道微生态失衡时,致病菌如沙门氏菌大量增加,产生毒副作用,引起机体消化机能紊乱,危害机体健康[19]。由表3可知,实验初期4 组大鼠粪便中沙门氏菌的数量相差不大。前5周时,高脂模型组大鼠粪便中沙门氏菌的数量随饲喂时间的延长逐渐降低,3 个实验组的下降趋势与高脂模型组相比更加明显。5~7 周时,3 个实验组大鼠粪便中沙门氏菌的数量极显著低于高脂模型组(P<0.01),且低剂量实验组数量最低。这可能是因为从第5周开始藏灵菇源马克斯克鲁维酵母菌M3菌株在肠道中定殖、占优势,对沙门氏菌起到一定的抑制作用,并且随着时间的增加,肠道中乳酸杆菌数量也逐渐增加,也抑制了沙门氏菌的繁殖。综上,藏灵菇源马克斯克鲁维酵母菌M3能够极显著降低大鼠肠道沙门氏菌的数量,且低剂量效果最为明显。
2.5藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中产气荚膜梭菌数量的影响

表4 藏灵菇源马克斯克鲁维酵母菌M3对大鼠肠道中产气荚膜梭菌数量的影响(x ±s,n==1100)Table 4 Effect ofnus M33 oonn Clostriddiiuumm perfrinnggeennss count in the intestinal tract of rats(xf Kluyveromyces marxianus ± s,,n = 1100))lg(CFU/g)
在机体肠道内,产气荚膜梭菌属于致病菌,可分泌外毒素,引起胃肠道坏死性病变,若其数量达到一定水平,不利机体健康[20]。由表4可知,实验初期4 组大鼠粪便中气荚膜梭菌的数量差别不明显。前5 周,高脂模型组大鼠粪便中产气荚膜梭菌的数量随饲喂时间的延长逐渐降低;第5~7周期间,低剂量实验组大鼠粪便中产气荚膜梭菌的数量显著低于高脂模型组(P<0.05)。这应该是因为第5周后,藏灵菇源马克斯克鲁维酵母菌M3菌株一方面选择性地增加了有益菌乳酸杆菌的数量;另一方面,抑制了产气荚膜梭菌的生长。综上,藏灵菇源马克斯克鲁维酵母菌M3能够显著降低实验组大鼠产气荚膜梭菌的数量,且以低剂量效果尤为明显。
3 讨 论
机体肠道正常菌群失衡会造成肠道功能紊乱,对机体正常代谢和抗感染能力有影响,易引发肠道感染,出现便秘、腹泻等症状。维持肠道菌群平衡,对保持机体健康水平具有重要意义[21]。
Xie Yuanhong等[22]研究表明,高胆固醇血症模型建立成功时,高脂模型组大鼠血清胆固醇和甘油三酯水平较高,肝功能紊乱,肝脏组织病理切片表明肝脏发生病变;而实验组大鼠血清胆固醇和甘油三酯基本保持在正常水平,肝脏组织病理切片正常,肝脏未发生病变。当肝脏发生病变时,脂质代谢紊乱,肝细胞胆汁排泌减少,肠道清除、排空能力降低,肠道抗体、溶菌酶、黏液分泌减少,肠壁局部抵抗力下降,使得有害菌数量增长甚至占优势,造成严重的肠道菌群失衡。
通过对大鼠粪便中3 种具有代表性的肠道菌群,即乳酸杆菌(有益菌)、沙门氏菌(致病菌)和产气荚膜梭菌(致病菌)的活菌数量的测定,根据受试物调节肠道菌群平衡结果判断标准,可判定藏灵菇源克鲁维酵母菌M3对大鼠具有调节肠道菌群平衡的作用。这是因为藏灵菇源马克斯克鲁维酵母菌M3具有良好的耐受胃肠道逆环境特性[18],能够定殖在肠道中,并大量繁殖占有一定优势,使肠道中有益菌数量上升,有害菌数量下降,从而起到调节肠道菌群平衡的效果;同时,藏灵菇源克鲁维酵母菌M3产生高活力的胆盐水解酶,能有效降低血清总胆固醇(total choleiterol,TC)、甘油三酯(triglyceride,TG)的含量,从而减缓机体肝脏组织病变,维持肠道正常生理功能,使有害菌数量不占优势,亦起到调节肠道菌群平衡的功效。
参考文献:
[1]吴夏飞,连娜琦,陆春风,等.肠道菌群对慢性肝脏疾病影响的研究进展[J].中国药理学通报,2013,29(12):1644-1647.DOI:10.3969/j.issn.1001-1978.2013.12.004.
[2]王生,黄晓星,余鹏飞,等.肠道菌群失调与结肠癌发生发展之间关系的研究进展[J].中国药理学通报,2014,30(8):1045-1049.DOI:10.3969/j.issn.1001-1978.2014.08.003.
[3]张胜利,许君望,魏动娃.微生态制剂联合谷氨酰胺在肝硬化失代偿治疗中的疗效观察[J].中国现代医药杂志,2010,12(10):95-96.DOI:10.3969/j.issn.1672-9463.2010.10.039.
[4]杨林辉,蔡俊,陈东风.非酒精性脂肪性肝炎患者肠道菌群的变化及意义[J].临床肝胆病杂志,2012,28(2):124-126.
[5]LATA J,NOVOTNÝ I,PR¸BRAMSK˘ V,et al.The effect of probiotics on gut flora,level of endotoxin and Child-Pugh score in cirrhotic patients:results of a double-blind randomized study[J].European Journal of Gastroenterology & Hepatology,2007,19(12):1111-1113.DOI:10.1097/MEG.0b013e3282efa40e.
[6]刘慧,何欢,熊利霞,等.藏灵菇源克鲁维酵母K1菌株胆盐水解酶的特性研究[J].中国酿造,2010(11):69-73.DOI:10.3969/j.issn.0254-5071.2010.11.020.
[7]伍静,苏春萍,王显超,等.乳酸菌和双歧杆菌制剂对小鼠肠道菌群失调模型的调节作用[J].科学技术与工程,2013,13(16):4497-4500.DOI:10.3969/j.issn.1671-1815.2013.16.005.
[8]ANGELAKIS E,BASTELICA D,ben AMARA A,et al.An evaluation of the effects of Lactobacillus ingluviei on body weight,the intestinal microbiome and metabolism in mice[J].Microb Pathogenesise,2012,52(1):61-68.DOI:10.1016/j.micpath.2011.10.004.
[9]BRUZZESE E,CALLEGARI M L,RAIA V,et al.Disrupted intestinal microbiota and intestinal inflammation in children with cystic fibrosis and its restoration with Lactobacillus GG:a randomised clinical trial[J].PLoS ONE,2014,9(2):e87796.DOI:10.1371/journal.pone.0087796.
[10]童佩.布拉酵母双向调节儿童肠道菌群失调的疗效分析[J].新医学,2012,43(6):420-421.DOI:10.3969/g.issn.0253-9802.2012.06.024.
[11]刘慧,潘昌莉,张红星,等.克鲁维酵母菌产胆盐水解酶发酵条件的优化研究[J].中国酿造,2010(7):44-46.DOI:10.3969/j.issn.0254-5071.2010.07.012.
[12]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006:85-90; 263-274.
[13]李平兰.食品微生物学实验原理与技术[M].北京:中国农业出版社,2003:56-58.
[14]徐志毅.肠道正常菌群与人体的关系[J].微生物学通报,2005,32(3):117-120.DOI:10.3969/j.issn.0253-2654.2005.03.023.
[15]中华人民共和国卫生部.GB 4789.2—2010 食品安全国家标准 食品微生物学检验 菌落总数测定[S].北京:中国标准出版社,2010.
[16]刘慧,李平兰,宫品.开菲尔粒中酵母菌的分离及其发酵性能的研究[J].食品科学,2005,26(2):97-100.DOI:10.3321/j.issn:1002-6630.2005.02.018.
[17]刘慧,陈湘宁,张红星,等.藏灵菇酵母菌M3耐胃肠道逆环境特性及降胆固醇的实验研究[J].中国农学通报,2009,25(15):60-63 .
[18]白娜,张家超,郑艺,等.抗生素和高脂饮食对大鼠肠道乳杆菌多样性的影响[J].微生物学通报,2014,41(11):2310-2317.DOI:10.13344/j.microbiol.china.140093.
[19]周映华,胡新旭,卞巧,等.无抗发酵饲料对生长育肥猪生长性能、肠道菌群和养分表观消化率的影响[J ].动物营养学报,2015(3):870-877.DOI:10.3969/j.issn.1006-267x.2015.03.026.
[20]宫秀燕,刘顺德,韦明,等.凝结芽孢杆菌对感染产气荚膜梭菌肉鸡生长性能、肠道病变及免疫器官指数的影响[J].中国畜牧兽医,2015(2):478-486.DOI:10.16431/j.cnki.1671-7236.2015.02.038.
[21]GUARNER F,CASELLAS F,BURRUEL N,et al.Role of microecology in chronic inflammatory bowel diseases[J].European Journal of Clinical Nutrition,2002,56(Suppl 4):34-38.DOI:10.1038/sj.ejcn.1601662.
[22]XIE Yuanhong,ZHANG Hongxing,LIU Hui.Hypocholesterolemic effects of Kluyveromyces marxianus M3 isolated from Tibetan mushrooms on diet-induced hypercholesterolemia in rat[J].Brazilian Journal of Microbiology,2015,46(2):389-395.DOI:10.1590/S1517-838246220131278.
Regulatory Effect of Kluyveromyces marxianus M3 Isolated from Tibetan Kefir on the Intestinal Flora Balance in Rats
DONG Muqun1,XIONG Lixia1,XIE Yuanhong1,ZHANG Hongxing1,LIU Hui1,*,JIA Hui1,LIAN Zhengxing2
(1.Beijing Engineering Laboratory of Key Technology Development of Microecologics,Beijing Laboratory of Food Quality and Safety,College of Food Science and Engineering,Beijing University of Agriculture,Beijing 102206,China; 2.College of Animal Science and Technology,China Agricultural University,Beijing 100091,China)
Abstract:To evaluate the effects ofKluyveromyces marxianus M3,with good fermentation performance and high ability to produce bile salt hydrolase,isolated from Tibetan kefir on the intestinal flora balance in experimental hypercholesterolemic rats,40 rats(43 weeks old)were divided into 4 groups and fed a high fat diet supplemented with low,medium and high dose of freeze-dried K.marxianus M3 powder for a 7-week experimental period.According to our results,in the first five weeks,the numbers of 3 kinds of bacteria in rat feces gradually changed,and there was no significant difference between the three experimental groups and the high-fat model group; at the fifth week,the preventive hypercholesterolemia model was established successfully,the number of Lactobacillus in the three experimental groups was significantly higher than that in the high-fat model group(P < 0.01),while the number of Salmonella(P < 0.01)and Clostridium perfringens(P < 0.05)was significantly lower than in the high-fat model; among all experimental groups,the number of Lactobacillus in the low dose group was the highest while Salmonella and Clostridium perfringens were the lowest,showing that the effect of low dose was better than the medium and high doses.These results demonstrated that K.marxianus M3 could promote the growth of intestinal beneficial bacteria and inhibit the breeding of harmful bacteria in the hypercholesterolemic rats,having a good effect on the intestinal flora balance.
Key words:Tibetan kefir; Kluyveromyces marxianus; animal experiment; intestinal flora balance
中图分类号:book=198,ebook=205Q93.337
文献标志码:A
文章编号:1002-6630(2016)05-0197-05
DOI:10.7506/spkx1002-6630-201605035 10.7506/spkx1002-6630-201605035.http://www.spkx.net.cn
*通信作者:刘慧(1963—),女,教授,硕士,研究方向为食品微生物与发酵。E-mail:foodlh@263.net
作者简介:董牧群(1989—),女,硕士,研究方向为农产品贮藏与加工。E-mail:dmqtc@sina.com
基金项目:北京市自然科学基金项目(5092008);国家转基因生物新品种培育重大专项(2014ZX08008-005);北京市属高等学校高层次人才引进与培养项目(CIT&TCD20140315)
收稿日期:2015-10-31
