低温诱导球等鞭金藻3011脂肪酸去饱和酶基因片段的筛选及mRNA表达分析
2016-04-15王雪青天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室天津300134
王 婷,赵 培,李 楠,王雪青(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
低温诱导球等鞭金藻3011脂肪酸去饱和酶基因片段的筛选及mRNA表达分析
王 婷,赵 培,李 楠,王雪青*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:本实验通过设计特异引物序列,对经低温诱导处理的球等鞭金藻3011的脂肪酸去饱和酶基因片段进行筛选,以实时荧光定量聚合酶链式反应检测酶的表达量,探索低温对该多不饱和脂肪酸脱饱和酶基因表达量的影响。结果表明:用prime5设计包括内参基因在内的14 条引物,其中7 条引物具有特异性扩增,根据扩增效果对其扩增体系进行优化。结果表明:Des4、Des5、Des6、Des8、Des9和Des12 mRNA相对最大表达量分别为7.71、11.33、42.58、22.02、73.91和16.01。随温度的降低均呈现先增加后降低的趋势。根据SPSS 19.0统计分析,6 个基因在其mRNA相对表达量最大的诱导时间时,18 ℃的mRNA相对表达量与其在12、15、21 ℃ 3 个温度条件下的相对表达量相比具有极显著差异(P<0.01)。18 ℃条件下诱导24 h可以有效增加Des9基因在球等鞭金藻3011中的表达。此研究结果为人为调控微藻的多不饱和脂肪酸含量提供了一条可行的方法。
关键词:低温;脂肪酸去饱和酶;球等鞭金藻3011;实时荧光定量聚合酶链式反应;基因表达
引文格式:
王婷,赵培,李楠,等.低温诱导球等鞭金藻3011脂肪酸去饱和酶基因片段的筛选及mRNA表达分析[J].食品科学,2016,37(5):132-137.DOI:10.7506/spkx1002-6630-201605024.http://www.spkx.net.cn
WANG Ting,ZHAO Pei,LI Nan,et al.mRNA Expression analysis and screening of fatty acid desaturase gene in Isochrysis galbana 3011 under low-temperature induction[J].Food Science,2016,37(5):132-137.(in Chinese with English abstract)
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是指含有两个或两个以上双键且碳链长度为18~22 个碳原子的直链脂肪酸[1],研究显示其具有许多独特的生物活性[2-6],由于人体自身合成的PUFAs并不能满足自身需求,因此需从膳食中补充,因此研究和开发富含PUFAs的食品以及保健品具有重要意义。陆生的动、植物仅含有微量的二十二碳六烯酸(docosahexaenoic acid,DHA)和二十二碳五烯酸(eicosapntemacnioc acid,EPA),而海洋来源的动、植物中富含PUFAs,如深海鱼油,但产品由于存在一系列的问题[7-8],从而限制了其大规模应用。藻类是水体中处于食物链最低级的微小生物,藻体中含有优质的PUFAs,并且微藻易人工培养调控,因此研究和探索适合藻种合成PUFAs的培养条件,成为其产业化的关键环节。
温度是影响微藻生长的十分重要环境条件之一,也是很容易调控的外界环境因素。已经有研究报道,温度等环境因子可以影响栅藻、甲藻以及小球藻的PUFAs的组成及含量[9-13],而关于其影响球等鞭金藻(Isochrysis galbana)3011的PUFAs的组成及含量相关研究尚未见报道。
球等鞭金藻3011属于金藻门、普林藻纲、等鞭藻目,等鞭藻科的微藻,由于无细胞壁,易消化,且富含DHA、EPA以及多糖等活性物质,是贝类等经济动物的开口饵料。本研究以球等鞭金藻3011为材料,以实时荧光定量聚合酶链式反应(real-time fl uorescence quantitative polymerase chain reaction,real time-qPCR)技术研究不同温度处理对该藻去饱和酶基因mRNA表达影响,及温度调节去饱和酶表达的模式,为实现人工调控特定多不饱和脂肪酸的合成和积累提供理论指导,并为利用微藻产业化生产DHA、EPA提供一种可行的方法。
1 材料与方法
1.1菌株与试剂
球等鞭金藻3011 中国海洋大学赠予。
焦碳酸二乙酯(diethy pyrocarbonate,DEPC)、Trizol试剂 北京康为世纪有限公司;TOYOBO反转录试剂盒 日本Toyobo公司;SYBR Select Master Mix染料试剂盒 美国AB公司。
1.2仪器与设备
TGL-16G台式离心机 上海安亭科学仪器厂;real time-qPCR扩增仪、Gel DocTM凝胶电泳成像分析系统、ChemiDoc凝胶成像系统 美国Bio-Rad公司;UV-2550微量紫外分光光度计 日本岛津公司;实时荧光定量PCR仪 美国AB公司。
1.3方法
1.3.1RNA的提取与鉴定
利用Trizol试剂说明书的步骤取RNA,紫外-可见分光光度计测定RNA的纯度和浓度,琼脂糖凝胶电泳检测完整性。
1.3.2cDNA的合成及引物设计
使用TOYOBO反转录试剂盒进行反转录,使用primer5软件设计脂肪酸去饱和的参数和酶基因的序列,引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 引物名称和序列Table 1 Names and sequences of primers
1.3.3PCR及real time-qPCR扩增与检测
1.3.3.1PCR扩增
利用PCR检测引物特异性,体系如下:正、反引物浓度:200 nmol/L;cDNA模板:200 ng;10×buffer:5 øL;dNTP:200 mmol/L;Taq酶:2.5 U;ddH2O:39.5 øL。按照PCR扩增程序:95 ℃变性5 min,1 个循环;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,36 个循环;72 ℃延伸7 min,1 个循环;4 ℃保温,进行扩增。
1.3.3.2real time-qPCR检测
接种后培养至对数期,分别在21、18、15、12 ℃条件下诱导24、48、72、96 h(每组设有3 个平行样品),提取RNA,反转录成cDNA,按照SYBR®Select Master Mix染料试剂盒说明书进行real time-qPCR,体系如下:SYBR®Select Master Mix(2×)10 øL、正、反引物200 nmol/L、cDNA模板200 ng、水6.4 øL。反应程序:阶段1,95 ℃ 10 min;阶段2,95 ℃ 15 s,60 ℃ 1 min,40 个循环;熔解曲线阶段:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.4基因相对表达量的测定
利用SPSS 19.0软件对数据进行单因子显著性比较。
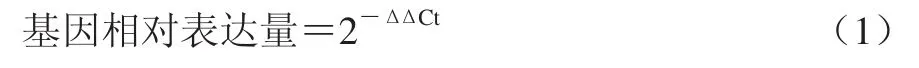

式中:2表示循环间扩增产物量的倍数变化;ΔΔCt表示处理样本和对照样本之间校正过的循环数变化。
2 结果与分析
2.1内参基因与序列的选择
可以作为real time-qPCR的内参有很多,例如:3-磷酸甘油醛脱氢酶(glyceraldehydes phosphate dehydrogenase,GAPDH)、β-肌动蛋白以及18S rRNA 等[14-15],18S rRNA含量稳定且序列保守是作为藻类的内参基因首选,故本实验将以18S rRNA作为real time-qPCR的内参。根据多不饱和脂肪酸的合成途径中关键多不饱合脂肪酸去饱和酶的作用,挑选出Des4、Des5、Des6、Des8、Des9、Des9E、Des12、Desω-3 8 个关键酶,根据全基因序列以及引物设计原则设计引物基因序列如表1所示。
2.2多不饱和脂肪酸去饱和酶(fatty acid desaturase,FAD)基因片段的筛选
多不饱和脂肪酸去饱和酶基因FAD18S、FAD4、FAD5’、FAD6、FAD8’、FAD9’和FAD12’扩增结果的熔解曲线具有相同性,都仅有一个锐利的峰,Tm值不是二聚体所在温度范围内,说明引物具有特异性,所以FAD18S可作为内参,其余的可作为实时荧光定量的引物;FAD5、FADω-3虽然有一个峰值,但峰并不锐利,表明这两条引物不具有特异性;FAD8、FAD6’引物不稳定,虽然有锐利的峰出现,可能存在非特异性的结合位点,影响实验结果,造成实验的误差;FAD9引物具有非特异性干扰,虽然存在一个锐利的峰,可依然有平缓的峰存在,非特异性的存在会影响Ct值,对结果造成误差;FAD9E出现的峰熔解温度Tm=65.74 ℃,Tm值在60~75 ℃,判定FAD9E为二聚体,所以以上引物则不能作为实时荧光定量引物。
利用琼脂糖凝胶电泳对FAD18S、FAD4、FAD5’、FAD6、FAD6’、FAD8’、FAD9’、FAD12’、FAD8、 FAD9、FAD5、FAD9E、FADω-3的特异性进行检测,如图1所示。

图1 real time-qPCR特异性产物电泳结果Fig.1 Electrophoresis of specific amplification products by real time-qPCR
由图1可知,FAD18S、FAD4、FAD5’、FAD6、FAD8’、FAD9’和FAD12’条带唯一,并没有杂带,具有特异性,与Marker片段大小相比,没有小于100 bp的条带,说明并没有二聚体的存在,且条带片段大小与引物设计相吻合,具有特异性。FAD5、FAD8和FADω-3引物条带模糊,且序列长度在100 bp左右,属于二聚体。FAD9E没有明显条带,没有结合位点。因此确定FAD18S、FAD4、FAD5’、FAD6、FAD8’、FAD9’和FAD12’的序列用于Des18S、Des4、Des5、Des6、Des8、Des9和Des12基因的合成。
2.3多不饱和脂肪酸去饱和酶基因片段序列比对
根据测序结果和不同藻种中已知的Des6全基因序列进行比对,所测序列与Huerlimann等[14]的实验所得球等鞭金藻去饱和酶基因序列相似度为97%(表2),与其他藻种基因序列对比并无相似性,确定引物设计的脂肪酸去饱和酶基因为球等鞭金藻全基因序列中多不饱和脂肪酸去饱和酶基因片段。实验序列和球等鞭金藻去饱和酶基因序列BLAST分析如表2所示,所测序列的第7~342个碱基与球等鞭金藻3011 Des6基因全序列的第77~337个碱基片段中仅有第10个碱基缺少,第256、260、261、297、299、300、311、358个碱基与已知序列碱基不相符,共占总基因片段的2.67%。

表2 球等鞭金藻3011基因片段与DDeess66全基因序列BLASTT对比分析Table 2 BLAST analysis of Isochrysis galbana 3011 FAD6 gene fragment and Des6 full sequence
2.4 温度调控对基因表达量的分析
样品在12、15、18、21 ℃条件下分别诱导24、48、72、96 h,将0 h的基因表达量设为1,作为对照组,利用SPSS 19.0软件进行显著性比较。
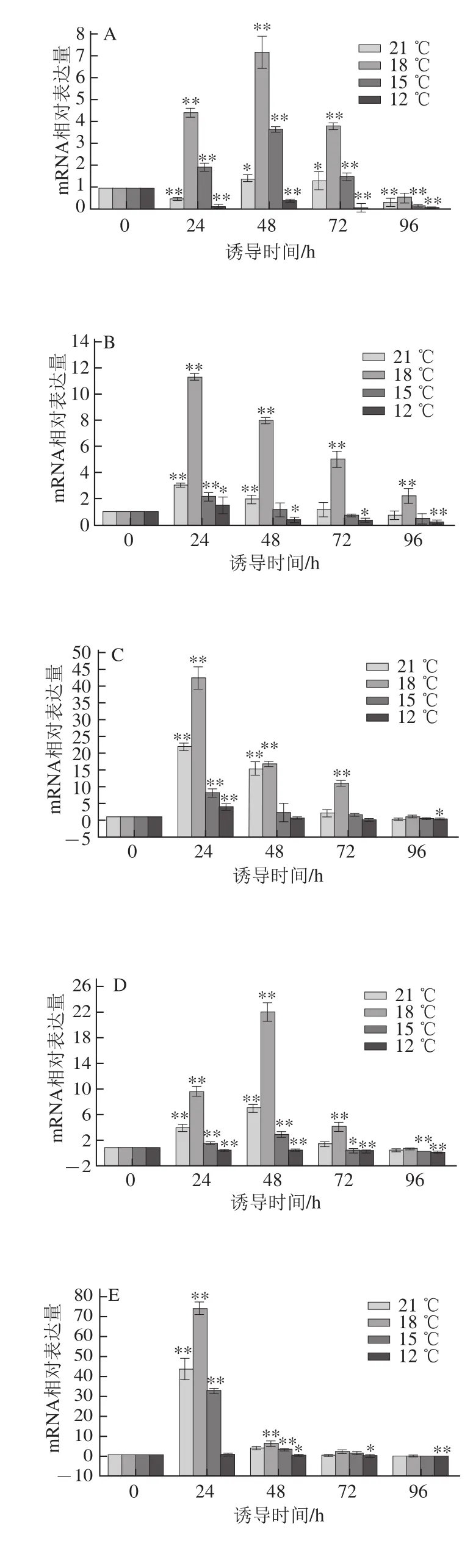
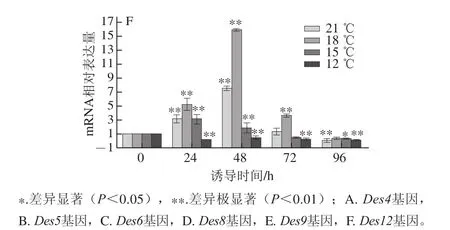
图22 DDeess44、DDeess55、DDeess66、DDeess88、DDeess99、DDeess1122基因mRNA相对表达量在不同温度下随时间变化对比结果Fig.2 Relative mRNA expression amounts of Des 4,Des 5,Des 6,Des 8,Des 9 and Des 12 at different temperatures as a function of induction time
由图2可知,Des4、Des5、Des6、Des8、Des9、Des12基因mRNA相对最大表达量分别为7.17、11.33、42.58、22.02、73.91和16.01。且对低温诱导反应最敏感的为Des9基因,Des4基因对低温诱导最不敏感。当诱导温度作为不变因素时发现:Des4、Des8和Des12基因的mRNA相对最大表达量出现在48 h处,Des5、Des6、Des9基因则是在24 h时出现了最大的mRNA相对表达量,6 个基因在24、48 h具有显著性差异,72、96 h时,显著性差异不大。6 个基因的mRNA相对表达量在相同诱导时间下,随着温度的降低呈现先增加后减小的趋势,18 ℃时6 个基因mRNA相对表达量最大;21、18、15 ℃条件下诱导72 h内Des9基因的mRNA相对表达量最大,12 ℃时诱导96 h内Des6基因的mRNA相对表达量最大,6 个基因在其mRNA相对表达量最大的诱导时间时,18 ℃条件下的mRNA相对表达量与其他3 个温度相比具有极显著性差异(P<0.01)。
相同温度下,当低温诱导至96 h(除了Des5基因在18 ℃和Des6基因在21、18、15 ℃)时,mRNA相对表达量几乎都小于对照组的值,表明机体通过改变酶的表达量来抵御冷胁迫属于短暂效应,并不能长时间存在。在相同时间下,18 ℃条件下mRNA相对表达量最大说明藻细胞对冷胁迫的抵抗能力有一定的范围,当超过藻细胞的承受范围则会加速藻细胞的凋亡。
3 讨论与结论
低温环境成为改变植物/微藻多不饱和脂肪酸组成和含量的重要外界因子[16-17]。适当的低温可使生物膜脂的流动性下降,机体通过主动的增加膜脂不饱和度以维持膜的正常流动性。在脂肪酸的合成过程中,去饱和酶和延长酶活力消涨变化,能够改变膜脂双层中饱和脂肪酸与不饱和脂肪酸的比例或者改变脂肪酸酰基链的长度、支链脂肪酸的比例以及环状脂肪酸的比例。
由本实验看出,培养环境低温诱导对多不饱和脂肪酸去饱和酶基因相对表达量不仅与温度有关,也与作用时间相关。当低温诱导过长,会导致有毒产物的出现,影响藻体的正常代谢活动,最终导致藻体的凋亡。同样,在适当的低温诱导会使酶的基因表达量增加,过低的温度不仅不会提高酶的基因表达量,甚至会导致酶的基因表达量下降。蓝藻中Des6、Des9、Des12和Desω-3基因已被证明具有冷调节性,低温下去饱和酶转录与翻译水平比最适温度培养的水平均有显著提高[18-19]。适当的低温导致去饱和酶基因表达量的增加,可以使细胞膜的成分改变,细胞膜的流动性维持在原来的水平。在小球藻中,当温度降低后转录水平逐渐提高,Des12基因和Des15基因的转录水平分别在诱导后的24 h和3 h可达到初始转录水平的3.2 倍和5.4 倍[20],和本实验得出不同脂肪酸去饱和酶基因最大表达量不一定在相同诱导时间的结论相同。Miyasaka[21]和An Meiling[22]等分别研究不同温度对衣藻和南极衣藻的基因表达量发现:前者的Des12基因在温度从25 ℃降到4 ℃时,其转录水平达到初始转录水平的2.3 倍,而温度从25 ℃升到38 ℃后,转录水平仅为初始转录水平的87%,后者的Des9、Des12和Desω-3基因在相对低温(0 ℃)下的基因表达量高于正常温度(8 ℃)下的基因表达量,且Des9和Des12基因在48 h出现最大表达量,Desω-3基因表达量最大值出现在24 h,而本实验Des9基因表达量最大值出现在24 h,这可能是种属间存在差异性。
Ca2+可以通过传感器感应温度的变化可将信号传递给调节分子,激活促分裂素原活化蛋白激酶(mitogenactivated protein kinases,MAPK)、转录因子(C-repeat binding factors,CBF)等信号通路,最后与去饱和酶基因的调控区域相互作用,激活转录,增加去饱和酶含量,导致不饱和脂肪酸的含量增加,从而恢复膜的流动性[23-24]。但是过低的温度刺激或者适当的低温诱导时间过长都会引起一些副产物的形成:丙二醛等,影响一些信号通路(MAPK、CBF等)的形成,中断信号的延伸。宫相忠等[25]的实验表明:在24 h时丙二醛的含量并无太大变化,48 h的含量是24 h含量的1.4 倍左右,之后呈现相对平缓的趋势。本实验得出:在不同温度和不同时间时去饱和酶基因表达量并不同,表明低温可以调控去饱和酶的基因的表达量。
本研究利用prime5设计出1 条内参和6 条符合扩增条件的特异性引物序列。以24 ℃作为对照,降低培养温度来研究温度对藻体脂肪酸去饱和酶基因表达量的影响:18 ℃条件下脂肪酸去饱和酶基因表达量最高,过低的温度会使脂肪酸去饱和酶基因表达量降低;Des5、Des6和Des9基因在24 h的mRNA表达量最大,Des4、Des8和Des12基因在48 h的mRNA表达量最大,诱导时间过长同样会使脂肪酸去饱和酶基因的表达量下降;Des9基因的mRNA表达量为73.91,对低温敏感度最高,Des4基因的mRNA表达量为7.17,对低温敏感度最小。根据测序和real time-qPCR显示结果表明调控温度能够影响球等鞭金藻3011的脂肪酸去饱和基因的表达量。
参考文献:
[1]NAPIER J A,SAYANOVA O.The production of very-long-chain PUFA biosynthesis in transgenic plants:towards a sustainable source of fish oils[J].Proceedings of the Nutrition Society,2005,64(3):387-393.DOI:10.1079/PNS2005447.
[2]丁兆坤,张海柱,许友卿.二十二碳六烯酸和二十碳五烯酸研究的综述[J].中国科技论文在线,2007,2(2):107-116.DOI:10.3969/j.issn.2095-2783.2007.02.006.
[3]孙晓艳,林艳丽,熊福银,等.二十碳五烯酸和二十二碳六烯酸的生物合成途径研究进展[J].生物技术通讯,2012,23(5):755-758.DOI:10.3969/j.issn.1009-0002.2012.05.032.
[4]YEHUDA S,RABINOVITZ S,CARASSO R L,et al.The role of polyunsaturated fatty acids in restoring the agin neuronal membrane[J].Neurobiology of Aging,2002,23(5):843-853.DOI:10.1016/S0197-4580(02)00074-X.
[5]张英俊,朱笃,黄国林.利用微藻培养生产多不饱和脂肪酸研究进展[J].食品科学,2006,27(11):609-613.DOI:10.3321/j.issn:1002-6630.2006.11.152.
[6]黄明发,吴桂苹,焦必宁.二十二碳六烯酸和二十碳五烯酸的生理功能[J].食品与药品,2007,9(2):69-71.
[7]温雪馨,李建平,侯文伟,等.微藻DHA的营养保健功能及在食品工业中的应用[J].食品科学,2010,31(21):446-450.
[8]陈殊贤,郑晓辉.微藻油和鱼油中DHA的特性及应用研究进展[J].食品科学,2013,34(21):439-444.DOI:10.7506/spkx1002-6630-201321085.
[9]LI X,HU H Y,ZHANG Y P.Growth and lipid accumulation properties of a freshwater microalga Scenedesmus sp.under different cultivation temperature[J].Bioresource Technology,2010,102(3):3098-3102.DOI:10.1016/j.biortech.2010.10.055.
[10]李文权,李芊,廖启斌,等.温度对四种海洋微藻脂肪酸组成的影响[J].台湾海峡,2003,22(1):9-13.DOI:10.3321/j.issn:1002-6630.2006.11.152.
[11]LI T,DAUENPEN M,XIAO Q.Molecular analysis of Δ6 desaturase and Δ6 enlogase from Conidioblus obscurus in the biosynthesis of eicosatetraenoic acid,a ω3 fatty acid with nutraceutical potentials[J].Applied Microbiology and Biotechnology,2011,90(2):591-601.DOI:10.1007/s00253-010-3060-y.
[12]蒋汉明,翟静,张媛英,等.温度对海洋微藻生长及脂肪酸组成的影响[J].食品研究与开发,2005,26(6):9-12.DOI:10.3969/j.issn.1005-6521.2005.06.003.
[13]徐建祥.利用微藻培养生产DHA的进展[J].食品工业科技,2003,24(11):88-90.DOI:10.3969/j.issn.1002-0306.2003.11.037.
[14]HUERLIMANN R,STEINIG E J,LOXTON H,et al.Effects of growth phase and nitrogen starvation on expression of fatty acid desaturases and fatty acid composition of Isochrysis aff.galbana(TISO)[J].Gene,2014,545(1):36-44.DOI:10.1016/j.gene.2014.05.009.
[15]DENG X D,LI Y J,FEI X W.The mRNA abundance of pepc2 gene is negatively correlated with oil content in Chlamydomonas reinhardtii[J].Biomass and Bioenergy,2011,35(5):1811-1817.DOI:10.1016/j.biombioe.2011.01.005.
[16]KARGIOTIDOU A,DELI D,GALANOPOULOU D.Low temperature and light regulate delta 12 fatty acid desaturases(FAD2)at a transcriptional level in cotton(Gossypium hirsutum)[J].Journal of Experimental Botany,2008,59(8):2043-2056.DOI:10.1093/jxb/ern065.
[17]LIU X Y,YANG J H,LI B,et al.Antisense-mediated depletion of tomato chloroplast omega-3 fatty acid desaturase enhances thermal tolerance[J].Journal of Integrative Plant Biology,2006,48(9):1096-1107.DOI:10.1111/j.1744-7909.2010.00957.x.
[18]JOHN B,ZHAN G X.Temperature sensing and cold acclimation[J].Current Opinion Plant Biology,2001,4(3):241-246.DOI:10.1016/S1369-5266(00)00167-9.
[19]SAKMOTO T,HIGASHI S C,WADA H J,et al.Low-temperatureinduced desaturation of fatty acids and expression of desaturase genes in the cyanobacterium Synechocoeeus sp.PCC7002[J].FEMS Microbiol Letters,1997,152(2):313-320.DOI:10.1016/S0378-1097(97)00217-6.
[20]SUGA K,HONJOH K,FURUYA N,et al.Two low-temperatureinduced Chlorella genes for Δ12 and ω3 fatty acid desaturase(FAD):isolation of Δ12 and ω3 fad cDNA clones,expression of Δ12 fad in Saccharomyces cerevisiae and express ion of ω3 fad in Nicotiana tabacum[J].Biochem,2002,66(6):1314-1327.DOI:10.1271/bbb.66.1314.
[21]MIYASAKA H,TANAKA S,KANABOSHI H.Cloning and expression of a gene encoding a putative chloroplast ω-6 fatty acid desaturase of marine chlamydomonas[J].Plant Biotechnology,2000,17(2):167-171.DOI:10.5511/plantbiotechnology.17.167.
[22]AN M L,MOU S L,ZHANG X W,et al.Temperature regulates fatty acid desaturases at a transcriptional level and modulates the fatty acid prole in the Antarctic microalga Chlamydomonas sp.ICE-L[J].Bioresource Technology,2013,134(1):151-157.DOI:10.1016/j.biortech.2013.01.142.
[23]MURATA N,WADA H.Acyl-lipid desaturases and their importance in the tolerance and acclimatization to cold of cyanobacteria[J].Biochemical Journal,1995,308:1-8.DOI:10.1042/bj3080001.
[24]迟晓元.微藻脂肪酸去饱和酶基因组的比较基因组学分析及重要基因功能的验证[D].青岛:中国科学院海洋研究所,2008:5.
[25]宫相忠,唐学玺,黄健,等.球等鞭金藻8701的耐低温机理[J].水产学报,2001,25(1):20-25.DOI:10.3321/j.issn:1000-0615.2001.01.005.
mRNA Expression Analysis and Screening of Fatty Acid Desaturase Gene in Isochrysis galbana 3011 under Low-Temperature Induction
WANG Ting,ZHAO Pei,LI Nan,WANG Xueqing*
(Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
Abstract:In the present study,the specific primers were designed for the screening of the fatty acid desaturase gene in Isochrysis galbana 3011 under low-temperature induction and for the determination of fatty acid desaturase by real time-qPCR.Results showed that of 14 primers designed using prime5,7 provided specific amplification.Based on amplification efficiency,the largest relative expression amounts of Des4,Des5,Des6,Des8,Des9 and Des12 were 7.71,11.33,42.58,22.02,73.91 and 16.01,respectively,all of which dropped after an initial rise with decreasing temperature.Statistical analysis performed using SPSS19.0 software indicated that there was highly significant difference between the relative expression amounts of 6 genes at 18 ℃ and those obtained at three other temperatures 12,15,21 ℃(P 0.01).The induction at 18 ℃ for 24 h could effectively increase the expression of Des9 in Isochrysis galbana 3011.This study has demonstrated a feasible method to manipulate the content of polyunsaturated fatty acids in microalgae.
Key words:low temperature; fatty acids desaturase; Isochrysis galbana 3011; real time fluorescence quantitative polymerase chain reaction(real time-qPCR); gene expression
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2016)05-0132-06
DOI:10.7506/spkx1002-6630-201605024 10.7506/spkx1002-6630-201605024.http://www.spkx.net.cn
*通信作者:王雪青(1964—),女,教授,博士,主要从事天然活性物质的研究与开发。E-mail:wxqing@tjcu.edu.cn
作者简介:王婷(1989—),女,硕士研究生,主要从事微藻生理生化研究。E-mail:xuantingqian@aliyun.com
基金项目:天津市高等学校科技发展基金计划项目(20120603);国家自然科学基金面上项目(31270050;31071522;31171674)
收稿日期:2015-01-25
