牛肾溶菌酶的分离纯化及部分酶学性质
2016-04-15唐云明西南大学生命科学学院淡水鱼类资源与生殖发育教育部重点实验室三峡库区生态环境教育部重点实验室重庆400715
傅 婷,万 骥,王 丹,唐云明(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
牛肾溶菌酶的分离纯化及部分酶学性质
傅 婷,万 骥,王 丹,唐云明*
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:将新鲜牛肾匀浆后,经由缓冲液提取,正丁醇除脂,硫酸铵分级沉淀,CM-Sepharose阳离子交换层析,Superdex-200凝胶过滤层析后得到电泳纯的牛肾溶菌酶。结果表明:该酶比活力为15 145.63 U/mg,回收率为29.13%,纯化倍数为231.05;分子质量约12.66 kD,为单亚基酶。最适反应温度为65 ℃,在65 ℃以下较稳定;最适pH 9.0,pH值在3.0~9.0范围内稳定性较好;测得最适条件下牛肾溶菌酶对溶壁微球菌的Km值为0.399 μg/mL;甲醇、乙醇、异丙醇和硫氰化钾(KSCN)对该酶有激活作用;十二烷基硫酸钠、Pb2+、Ag+对该酶有明显抑制作用。
关键词:牛肾;溶菌酶;分离纯化;酶学性质
引文格式:
傅婷,万骥,王丹,等.牛肾溶菌酶的分离纯化及部分酶学性质[J].食品科学,2016,37(5):126-131.DOI:10.7506/
spkx1002-6630-201605023.http://www.spkx.net.cn
FU Ting,WAN Ji,WANG Dan,et al.Isolation,purifi cation and partial characterization of lysozyme from bovine kidney[J].
Food Science,2016,37(5):126-131.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605023.
http://www.spkx.net.cn
溶菌酶,又叫细胞壁水解酶,是专门作用于细菌细胞壁使得细胞壁破裂,内容物逸出从而使细菌溶解的一种酶,在高等动植物组织及其分泌物、原生动物、昆虫和各种微生物中广泛存在[1]。溶菌酶应用广泛,它作为一种蛋白质,因其无毒副作用可用作食品防腐剂;因其抗病毒、抗肿瘤等药理特性,可用于出血和鼻炎等症状的治疗;此外,它作为重要的工具酶应用于基因工程和细胞工程领域,是实现细胞融合的必需酶[2]。在倡导“绿色食品”、“绿色生活”的当今社会,溶菌酶以其天然安全的特性引起人们的广泛关注[3],虽然近年来国内外科研工作者也对多种来源的溶菌酶做了大量研究工作[4-7],但是我国溶菌酶的研究尚处于起步阶段,来源仍以蛋清为主,很多问题例如开发新的溶菌酶资源、获得酶学性质稳定的溶菌酶、降低生产成本等还需进行深入研究[8]。牛肾作为一种牛副产品,价廉易得,牛肾溶菌酶含量较高、酶学性质稳定,本实验从牛肾中分离纯化溶菌酶,并对其部分酶学性质进行表征,为牛肾资源的开发利用、获得一条全新的溶菌酶取材途径及牛肾溶菌酶的深入研究提供理论依据。
1 材料与方法
1.1材料与试剂
新鲜牛肾,购于重庆市北碚区天生菜市场。
Superdex-200凝胶层析分子质量标准品 美国GE Healthcare公司;考马斯亮蓝R-250 美国Bio-Rad公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白质分子质量标准样品 北京索莱宝科技有限公司;甲叉-双丙烯酰胺、丙烯酰胺 瑞士Fluka公司;溶壁微球菌冻干粉 美国Sigma公司;其余试剂均为国产分析纯。
1.2方法
1.2.1牛肾溶菌酶粗酶液的制备
新鲜牛肾经去离子水洗净、剪除结缔组织和脂肪、剪碎后称取50 g,按1∶3(m/V)的比例加入50 mmol/L的磷酸盐缓冲液(pH 5.8),匀浆后放置在4 ℃冰箱中静置提取12 h,12 000 r/min离心30 min,收集上清,按10%的体积比加入预冷的正丁醇,放入4 ℃冰箱中静置2 h,12 000 r/min离心30 min,弃去正丁醇层,收集上清即得粗酶液。
1.2.2硫酸铵分级沉淀
向粗酶液中加入硫酸铵粉末至30%的饱和度,4 ℃条件下盐析2 h后离心30 min(12 000 r/min),收集上清;继续向上清液中加入硫酸铵粉末至70%的饱和度,4 ℃条件下盐析12 h后离心30 min (12 000 r/min),收集沉淀;用50 mmol/L 磷酸盐缓冲液(pH 5.8)溶解沉淀后再用2.5 mmol/L的磷酸盐缓冲液(pH 5.8)作透析液,于4 ℃冰箱中透析24 h后,即得初酶液。
1.2.3CM-Sepharose阳离子交换层析
先用50 mmol/L的磷酸盐缓冲液(pH 5.8)将CM-Sepharose离子交换层析柱平衡好后,取10 mL初酶液上柱,用0~0.5 mol/L的NaCl溶液(用50 mmol/L、pH 5.8的磷酸盐缓冲液配制)线性梯度洗脱,流速设置为0.5 mL/min,每管收集5 mL;测定各管溶菌酶活力和蛋白含量,收集活性较高的酶液,置于-20 ℃冰箱中保存备用。
1.2.4Superdex-200凝胶过滤层析
用生理盐水将Superdex-200层析柱水平衡好后,取1.2.3节中收集的样品4 mL上柱,用生理盐水洗脱,流速设置为0.3 mL/min,每管收集3 mL;测定各管溶菌酶活力和蛋白含量,收集酶活性较高的几管样品,4 ℃条件下透析脱盐24 h,冷冻干燥后即得牛肾溶菌酶纯品,置于-20 ℃冰箱中保存备用。
1.2.5溶菌酶活力测定
参照文献[9-10]方法(稍作改动)测定:采用浊度法[11]。用50 mmol/L磷酸盐缓冲液(pH 5.8)配制底物溶壁微球菌混悬液,调至光密度(OD450 nm)值在1.3左右。将底物溶壁微球菌悬液于25 ℃水浴中保温,取2.6 mL底物悬液,0.1 mL溶菌酶酶液,混匀后测定OD450 nm值,记下反应15 s和75 s时的读数OD1和OD2。测量条件下,每分钟OD450 nm下降0.001记为一个酶活力单位(U)。酶活力计算见下式。

1.2.6牛肾溶菌酶纯度鉴定及分子质量测定
用SDS-PAGE鉴定1.2.4节获得的牛肾溶菌酶的纯度及测定其亚基分子质量,制备质量分数为12%的分离胶和5%的浓缩胶,上样10 μL样品,经SDS-PAGE测得牛肾溶菌酶亚基分子质量。用凝胶过滤层析法计算牛肾溶菌酶全分子质量[11]。
1.2.7蛋白质含量的测定
采用考马斯亮蓝染料法与紫外分光光度法测定[11]。
1.2.8牛肾溶菌酶的部分酶学性质
1.2.8.1牛肾溶菌酶的最适温度和热稳定性
在不同温度(25~85 ℃,间隔10 ℃)下测定溶菌酶的酶活力,计酶活力最高值为100%,测定各温度下的相对酶活力,以确定牛肾溶菌酶的最适反应温度。将酶液分别置于不同温度(25~85 ℃,间隔10 ℃)下保温5、6、8、10、12 h,测定牛肾溶菌酶的酶活力,计保温5 h时测得的酶活力为100%,计算各温度下温育不同时间的相对酶活力,以研究牛肾溶菌酶的热稳定性。
1.2.8.2牛肾溶菌酶的最适pH值和pH值稳定性
在不同pH值(3.0~10.6)的缓冲体系(用不同pH值的缓冲液配制的底物混悬液)中测定牛肾溶菌酶的酶活力,计最高酶活力值为100%,测定各pH值条件下的相对酶活力,以确定牛肾溶菌酶的最适反应pH值。将酶液分别与等体积不同pH值的缓冲液混合后,室温孵育1 h,在1.2.5节定义条件下测定酶活力,计酶活力最高值为100%,测定各不同pH值缓冲液孵育后酶液的相对活力,以研究牛肾溶菌酶的pH值稳定性。
1.2.8.3牛肾溶菌酶米氏常数(Km)的测定
最适反应条件(65 ℃,pH 9.0)下,以不同质量浓度的溶壁微球菌(50~400 μg/mL)作为底物,测定牛肾溶菌酶的酶活力,并采用双倒数作图法[12],求得牛肾溶菌酶的Km值。
1.2.8.4不同有机溶剂对牛肾溶菌酶活性的影响
将酶液分别与不同体积分数的甲醇、乙醇、异丙醇等体积混合,常温孵育30 min,分别测定各条件下的酶活力,以等体积双蒸水稀释后该酶活力为100%,计算各条件下牛肾溶菌酶的相对酶活力。
1.2.8.5不同化合物对牛肾溶菌酶活性的影响
将酶液分别与不同浓度的硫氰化钾(KSCN)、抗坏血酸、尿素、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、SDS等体积混合,常温孵育30 min,分别测定酶活力,以等体积双蒸水稀释后该酶的活力为100%,计算各条件下该酶的相对酶活力。
1.2.8.6部分金属离子对牛肾溶菌酶活性的影响
将酶液分别与等体积不同浓度的金属离子(Zn2+、Co2+、Mg2+、Ag+、Ba2+、Cu2+、Fe3+、Mn2+、Li+、Pb2+)混合,常温下孵育30 min,分别测定酶活力,以等体积双蒸水稀释后酶液的活力为100%,计算各条件下该酶的相对酶活力。
2 结果与分析
2.1牛肾溶菌酶的分离纯化

图1 牛肾溶菌酶的CM-Sepharose阳离子交换层析图谱Fig.1 CM-Sepharose ion-exchange chromatography of lysozyme from bovine kidney
图1为牛肾溶菌酶的CM-Sepharose阳离子交换层析结果,酶活力峰主要集中于第34~42管,酶活力最高管是第36管;如图2所示,离子交换层析后收集的样品经Superdex-200凝胶层析后,酶活力峰主要集中在第46~54管,酶活力最高管是第49管;纯化后的牛肾溶菌酶通过SDS-PAGE分析,显示为单一条带(图3),证明牛肾溶菌酶经纯化后达到了电泳纯。表1为牛肾溶菌酶的整个分离纯化结果,最终得到牛肾溶菌酶的回收率为29.13%,纯化倍数为231.05,酶比活力为15 145.63 U/mg。
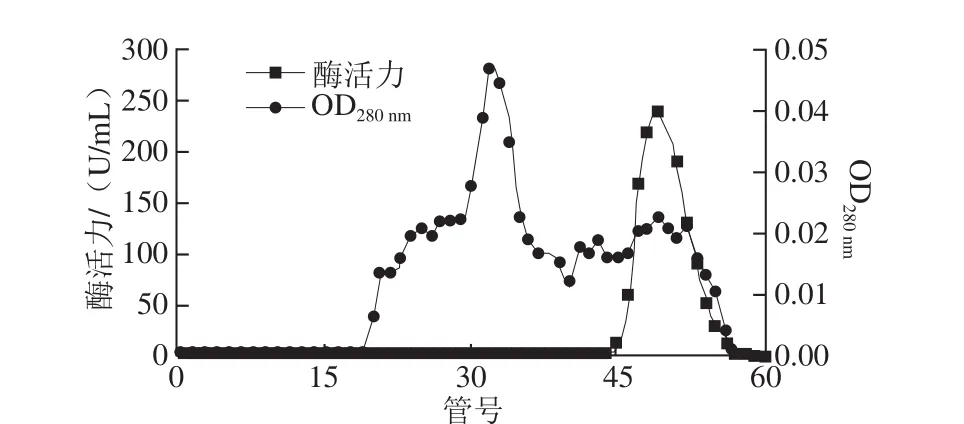
图2 牛肾溶菌酶的Superdex-200凝胶过滤层析图谱Fig.2 Superdex-200 gel filtration chromatography of lysozyme from bovine kidney
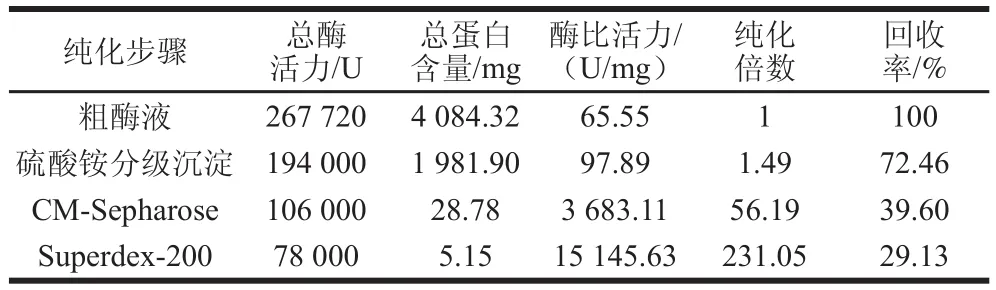
表1 牛肾溶菌酶的纯化结果Table 1 Summary of purification of bovine kidney lysozyme
2.2牛肾溶菌酶的纯度及分子质量
纯化后的牛肾溶菌酶经SDS-PAGE分析显示为单一条带(图3),经测定该酶亚基分子质量约为12.66 kD;Superdex-200凝胶过滤层析测得牛肾溶菌酶的全分子质量为12.43 kD,由此可推断该酶是单亚基酶。

图3 牛肾溶菌酶的SDS-PAGEE图谱Fig.3 SDS-PAGE of lysozyme from bovine kidney
2.3牛肾溶菌酶的部分酶学性质
2.3.1牛肾溶菌酶的最适温度和热稳定性
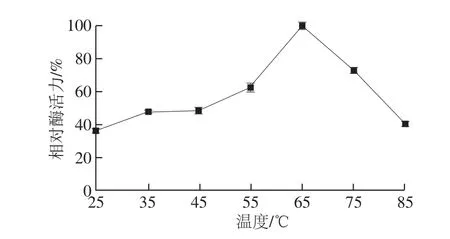
图4 温度对牛肾溶菌酶活力的影响Fig.4 Effect of temperature on the activity of lysozyme from bovine kidney
如图4所示,25~65 ℃时,酶活力随温度升高呈上升趋势,当温度高于65 ℃时酶活力随温度升高而呈下降趋势,因此该酶最适温度为65 ℃,其温度作用范围广,在85 ℃条件下其相对酶活力仍保持在40.5%。热稳定性实验结果如图5所示,该酶在25~65 ℃范围内较为稳定,耐高温,其在75 ℃条件下保温12 h后其相对酶活力仍保持在51.61%,该酶在85 ℃保温12 h后,酶活完全丧失。温度对酶促反应速率有两方面影响,包括:一是反应速率会随温度升高而增快,这与一般化学反应无异;其二,酶(核酸酶除外)作为一种蛋白质,随着温度的升高酶会逐渐变性,从而降低酶反应速率。当低于最适温度时,以前一种效应为主,当高于最适温度时,则以后一种效应为主[13]。
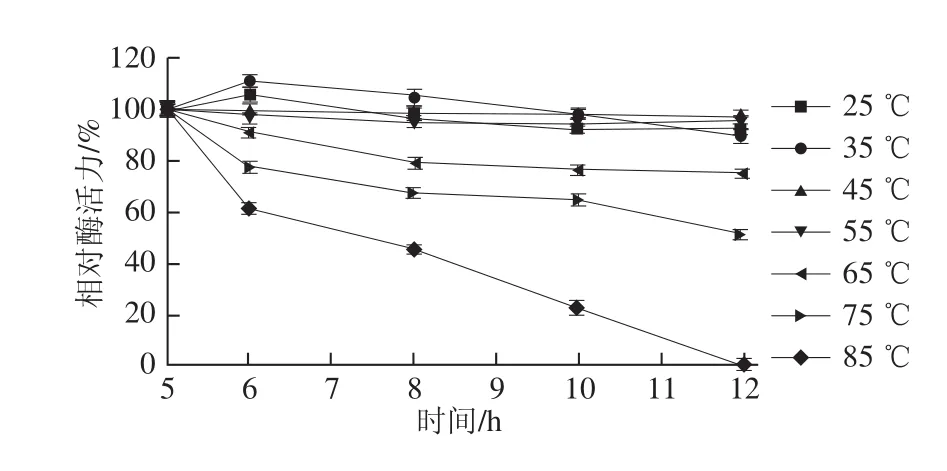
图5 牛肾溶菌酶的热稳定性Fig.5 Thermal stability of lysozyme from bovine kidney
2.3.2牛肾溶菌酶的最适pH值和pH值稳定性
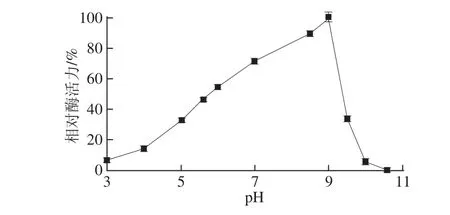
图6 pH值对牛肾溶菌酶活性的影响Fig.6 Effect of pH on the activity of lysozyme from bovine kidney
如图6所示,该酶的最适pH值为9.0,当pH值高于9.0时,其酶活急剧下降。图7为pH值稳定性实验结果,结果显示该酶在pH 3.0~9.0范围内活力均保持在较高水平(58.32%以上),且该酶在酸性环境中更为稳定,在pH值小于7的酸性条件下孵育1 h后,该酶的相对酶活力均高于73.65%。综合以上结果可推测,测定该酶最适pH值时,pH值对底物的影响起主要作用,由于底物溶壁微球菌在不同的pH值条件下呈现不同的状态(如活细菌数量),从而影响该酶活力[14],另外,可能与底物混悬液的均匀度有关,有研究发现,当混悬液中细胞集合成团块时,一部份底物很难被溶菌酶所作用到[15]。该酶稳定性结果说明,当该酶与不同的pH值缓冲液孵育1 h后测其剩余酶活力时,此时pH值对酶起主要作用,pH值可能是通过改变酶的带电状态来影响酶和底物的结合状态;过酸或过碱的极致环境也会影响酶的稳定性,从而使酶遭到不可逆的破坏,从而使酶活下降[16]。

图7 牛肾溶菌酶的pH值稳定性Fig.7 pH Stability of lysozyme from bovine kidney
2.3.3牛肾溶菌酶的米氏常数(Km)

图8 双倒数法测定牛肾溶菌酶的米氏常数Fig.8 Kmdetermination of lysozyme from bovine kidney
如图8所示,牛肾溶菌酶对溶壁微球菌的Km值为0.399 μg/mL。
2.3.4不同有机溶剂对牛肾溶菌酶活性的影响
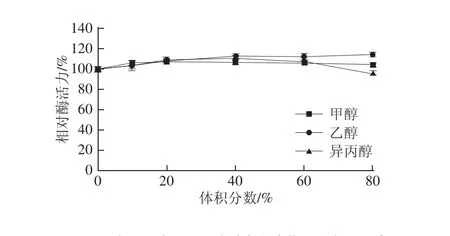
图9 甲醇、乙醇、异丙醇对牛肾溶菌酶活力的影响Fig.9 Effect of methanol,ethanol and isopropanol on the activity of lysozyme from bovine kidney
如图9所示,甲醇、乙醇、异丙醇这3 种有机溶剂对牛肾溶菌酶均有程度不等的激活作用。有研究表明,有机溶剂中的酶和水溶液中的酶同样具备高度的底物选择性,此外,还可能与下列几个特点有关:有机溶剂有促使热力学平衡向合成方向(如酯合成、肽合成等)移动的倾向;以有机溶剂作为介质的条件下,全部有水的副反应(如酸酐水解)均会受到抑制;在有机溶剂中发生微生物污染的概率较低;低水环境可用于稳定在水中寿命极短的酶反应中间体以及具有未知催化性质的构象异构体[17-18]。
2.3.5 不同化合物对牛肾溶菌酶活性的影响
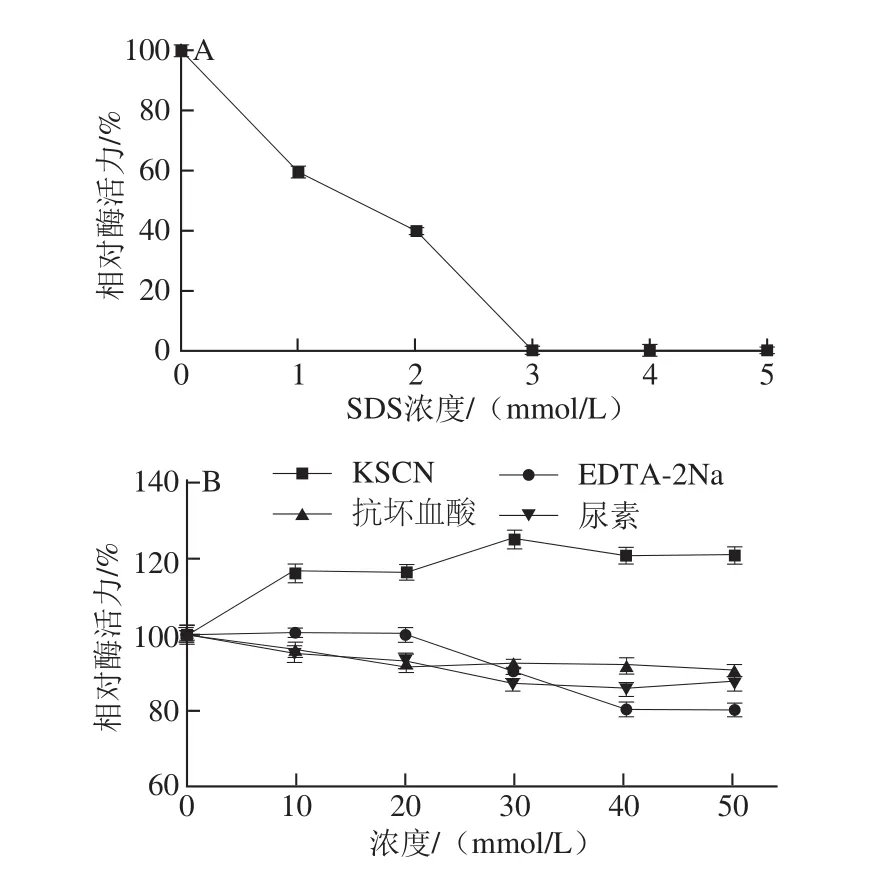
图10 不同化合物对牛肾溶菌酶活力的影响Fig.10 Effect of various compounds on the activity of lysozyme from bovine kidney
如图10所示,SDS对牛肾溶菌酶有很强的抑制作用,当浓度达到3 mmol/L时,酶几乎完全失活,因为SDS作为一种变性剂能够破坏酶蛋白分子中的疏水键和氢键,改变酶的空间结构,从而使酶活力降低[19];KSCN对牛肾溶菌酶有一定的激活作用,抗坏血酸、EDTA-2Na、尿素对牛肾溶菌酶影响不大。
2.3.6部分金属离子对牛肾溶菌酶活性的影响
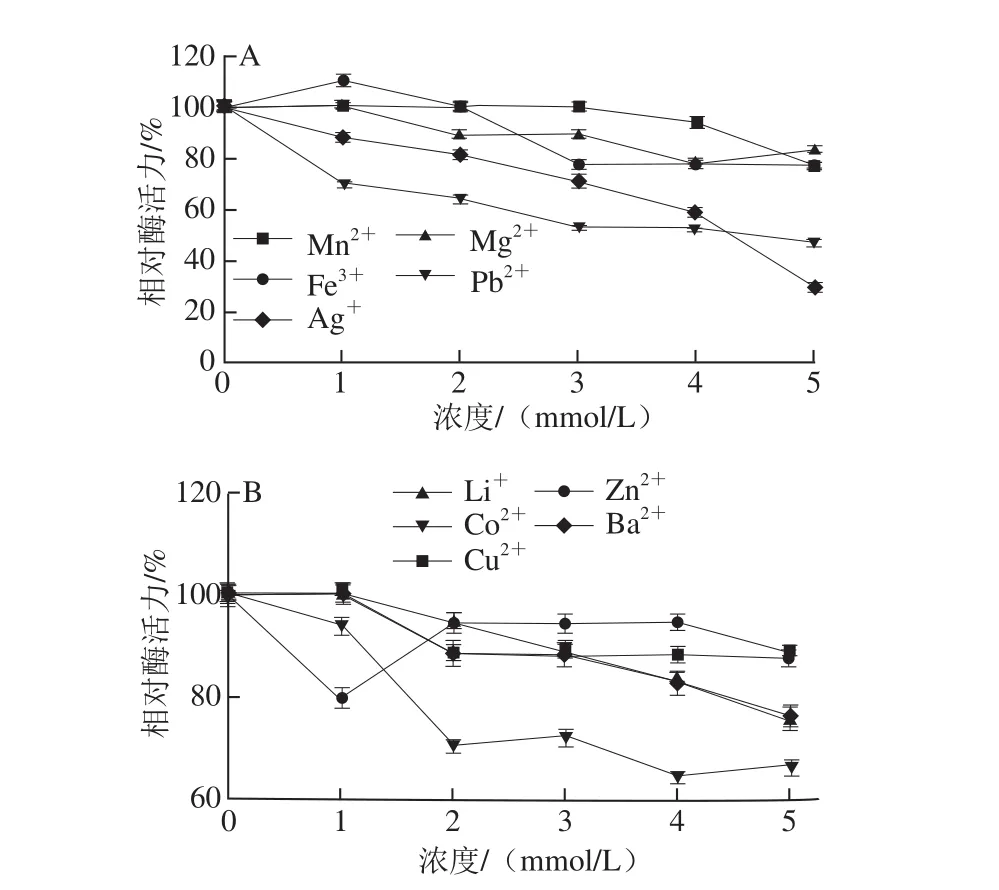
图11 不同金属离子对牛肾溶菌酶活力的影响Fig.11 Effect of metal ions on the activity of lysozyme from bovine kidney
如图11所示,Ag+、Pb2+对该酶抑制作用最强,当离子浓度达到5 mmoL/L时,剩余的相对酶活力分别为29.41%、47.06%,Co2+对该酶抑制作用次之;低浓度的Fe3+对该酶有一定的激活作用,随着浓度升高其抑制作用也增加,这可能是由于Fe3+的浓度会影响该酶本身的带电量,当Fe3+浓度较低时,对酶蛋白带电量影响微弱,酶分子空间结构未发生明显变化,并能促进底物与酶活性中心的结合,形成底物-酶-金属离子复合物,因而酶活性增强;当Fe3+浓度增大时,大量Fe3+聚集改变了酶蛋白自身的带电情况影响了酶分子的空间构型,从而酶活性逐渐受到抑制[20]。
3 讨 论
本实验以廉价易得,一年四季均可取材的牛肾为原材料,经一系列的纯化步骤得到了电泳纯的牛肾溶菌酶,纯化效果较好,其结果显示:酶比活力15 145.63 U/mg,纯化倍数231.05,回收率29.13%。利用此法分离纯化溶菌酶步骤简单,实验周期短,其回收率和纯化倍数均较高。回收率和纯化倍数均高于猪肾(16.89%、113.6)[21]、鸭卵清(28%、109.44)[22]、苦瓜(3.91%、164.61)[23],回收率低于菜心(34.1%),但纯化倍数高于菜心(197.4)[24]。
该酶最适温度为65 ℃,相比于藏绵羊肾(45 ℃)[25]、微生物(40 ℃)[26]、海参肠(35 ℃)[27]有很大差异,说明不同来源的溶菌酶其酶活性质也有所不同,这可能是由于生物体为了能满足生长代谢的需求、更好地适应周围的环境而表现出来的生物特异性,此为生物体基因不断进化并选择性表达的结果[28]。该酶最适pH值为9.0与菜心(5.8)[24]、海洋微生物(8.0)[29]、鸡蛋清(7.0)[30]、无花果(4.6)[21]、橡胶(5.0)[21]、木瓜(4.5)[21]来源的溶菌酶相比有较大相异。
本实验纯化的牛肾溶菌酶温度作用范围广,在85 ℃条件下其酶活力仍保持在40%以上,且耐热性好,在25~65 ℃范围内保温12 h,其酶活仍保持在74.42%以上。耐酸碱,该酶在pH 3.0~9.0范围内均能保持较高的酶活力(58.32%以上)。结果显示该酶在酸性环境中更加稳定,这与已有研究结果:溶菌酶在酸性环境中稳定,在碱性条件下不稳定[31-32]相吻合。通过以上比较可发现,牛肾来源的溶菌酶相比于已有研究的溶菌酶,具有耐高温、耐酸碱的优势,此类酶学性质稳定的天然溶菌酶具有极广泛的应用前景。
已有研究报道,溶菌酶的分子质量范围一般在14~18 kD。绿豆溶菌酶和鸡蛋溶菌酶的分子质量都在14.4 kD左右[33],本实验结果显示牛肾溶菌酶分子质量约为12.66 kD,小于猪肾(15 kD)[21]、海参肠(16 kD)[27],远小于海洋微生物溶菌酶(39 kD)[29]。牛肾溶菌酶对底物溶壁微球菌的Km值为0.399 μg/mL,远小于猪肾(13.5 mg/mL)、鸭卵清(86.4 μg/mL)、菜心(87 μg/mL),结果显示来源于牛肾的溶菌酶对溶壁微球菌有更好的亲和力。
甲醇、乙醇、异丙醇对牛肾溶菌酶活性均有不同程度的激活作用,这与之前报道的甲醇、乙醇、异丙醇会抑制鸭卵清溶菌酶的活性,且抑制强度随着有机溶剂体积分数的增大而增强[33]完全不同。一直以来,人们普遍认为“生物催化反应必须在水中进行”、“有机溶剂为酶的失活剂、变性剂”,直至1984年,Zaks等[34]提出这一观点:只要在合适的条件下,酶在作为非生物体系的有机溶剂中一样具备催化功能,本实验结果也是对此理论的又一印证。酶作为催化剂已广泛应用于食品、医药、轻纺、洗涤业、精细化工、有机合成等领域,其一般是在水溶液环境中发挥催化活性,但在这些领域中的许多有价值的产品通常是不溶的,目前酶工程正是利用改造酶本身或改造反应介质来解决这一难题[35],而牛肾来源的溶菌酶与某些有机溶剂具有良好的配伍性能这一天生优势恰好能满足后一种需求,为了更好利用牛肾溶菌酶的这一特性,还需对该酶非水酶学性质作进一步探究。
金属离子对牛肾溶菌酶活性有一定的影响,它可通过对酶去折叠及折叠的方式影响酶活性大小[19]。实验结果表明Ag+、Pb2+、Mg2+、Co2+对该酶均有不同程度的抑制作用,这与鸭卵清[19]和鸡蛋清[27]中关于Mg2+抑制溶菌酶活性相一致,与Ag+抑制海洋微生物溶菌酶活性的报道相符。而与Cu2+、Zn2+可抑制鸡蛋清、鸭卵清、海洋微生物溶菌酶不同的是,这两种离子对牛肾溶菌酶活性无显著影响。由此说明,来源不同的溶菌酶其酶活性质有显著差异。
通过以上分离纯化结果初步证明可考虑将牛肾作为一种全新的溶菌酶来源投入生产;通过对牛肾溶菌酶部分酶学性质的初探及对不同来源的溶菌酶酶学性质的比较,发现其与已有的溶菌酶有很大的酶学性质差异:对温度、酸碱比较稳定、与化合物、有机溶剂等都具有良好的配伍性能,由此决定了其不同的实际用途。因此为了更好地开发和利用牛肾溶菌酶,还有待在其酶学结构和抗菌功能上作进一步研究。
参考文献:
[1]张树政.酶制剂工艺[M].北京:科学出版社,1984:804-815.
[2]凤权,汤斌.溶菌酶分离纯化方法的研究进展[J].生物学杂志,2006,23(1):5-7.DOI:10.3969/j.issn.2095-1736.2006.01.002.
[3]孙慧君,张杰.溶菌酶的性质与应用[J].哈尔滨师范大学自然科学学报,2012,28(5):82-84.DOI:10.3969/j.issn.1000-5617.2012.05.027.
[4]HAWIGER J.Purifi cation and properties of lysozyme produced by Staphylococcus aureus[J].Journal of Bacteriology,1968,95(2):376-384.
[5]YU K H,KIM K H,LEE J H,et al.Comparative study on characteristics of lysozyme from the hemolymph of three lepidopteran larave Galleria mellonella,Bombyx mori,Agrius convolvuli[J].Developmental and Comparative Immunology,2002,26(8):707-713.DOI:10.1016/S0145-305X(02)00027-7.
[6]SPENCER A,LUDMILLA A,MOROZOV-ROCHE N W,e t al.Expression,purification,and characterization of the recombinant calciumbinding equine lysozyme secreted by the filamentous fungus Aspergillus niger:comparision with the production of hen and human lysozyme[J].Protein Expression and Purifi cation,1999,16(3):171-180.DOI:10.1507/endocrj.48.311.
[7]GAO X Y,YUAN S Q,MU H,et al.Primary studies on the bacteriostasis and fungistasis of lysozyme from Raphanus sativus[J].Journal of South China Agricultural University,1997,18(2):72-75.
[8]赵宁.鹌鹑蛋清溶菌酶的分离纯化及其性质研究[D].福州:福建农林大学,2009:13-18.
[9]侯启瑞,王金玉,谢凯舟,等.测定鸡蛋蛋清中溶菌酶含量和活力标准方法的建立[J].动物水产,2010,46(3):49-52.
[10]BEZEMER T M,RADERSMA R,GRIJPMA D W,et al.Zero-oder release of lysozyme from poly(ethylene glycol)/poly(butylenes terphthalate)matrices[J].Journal of Controlled Release,2000,64(1/3):92-179.DOI:10.1016/S0168-3659(99)00127-3.
[11]李建武,余瑞元.生物化学实验原理和方法[M].北京:北京大学出版社,1994:171-223.
[12]陈钧辉,陶力,朱婉华,等.生物化学实验[M].5版.北京:科学出版社,2004:204-205.
[13]吴兆鹏.重组毕赤酵母产α-葡聚糖酶发酵工艺的研究[D].广州:广东工业大学,2010:55-57.
[14]林霖,张宇,兰全学,等.溶壁微球菌对溶菌酶活性检测的影响[J].食品与安全检测,2013,38(3):296-301.DOI:10.13684/j.cnki.spkj.2013.03.002.
[15]中国科学院微生物研究所微生物细胞生物学研究组.死细菌和活细菌的细胞壁对溶菌酶敏感性的比较观察[J].微生物学报,1977,17(1):57-61.DOI:10.13343/j.cnki.wsxb.1977.01.003.
[16]沈诚.木聚糖酶酶学性质的研究以及在棉织物前处理中的应用[D].上海:东华大学,2011:33-35.
[18]罗贵民.有机溶剂中的酶催化反应[J].精细与专用化学品,1999(5):12-13.
[19]林建成,陈髸,林俊兵.有机溶剂及变性剂对南美白对虾体壁几丁质酶的影响[J].海洋通报,2007,26(4):61-64.DOI:10.3969/j.issn.1001-6392.2007.04.008.
[20]高亚鹏,苏茉,梁建荣,等.绿豆酸性磷酸酶的分离纯化和部分性质研究[J].中国粮油学报,2011,26(5):92-96.
[21]马尧,羊芹,杜泓璇.猪肾溶茵酶的纯化和部分性质研究[J].西南师范大学学报,2009,34(1):78-82.DOI:10.13718/j.cnki.xsxb.2009.01.009.
[22]成丽丽,邓玉,赵芯,等.鸭卵清溶菌酶的分离纯化及性质[J].食品科学,2012,33(17):198-202.
[23]常景立,汪少芸,周建武,等.苦瓜溶菌酶的分离纯化及特性研究[J].中国食品学报,2009,9(5):55-60.
[24]周泽文,李明启.菜心溶菌酶的提纯及酶学性质[J].生物化学杂志,1994,10(3):367-370.DOI:10.13865/j.cnki.cjbmb.1994.03.022.
[25]李建波,江明锋,王永.藏绵羊肾溶菌酶基因的克隆、表达、纯化和酶学特性研究[J].遗传育种,2014,50(3):14-17.DOI:10.3969/j.issn.0258-7033.2014.03.004.
[26]费国琴,李晓晖,宁喜斌.微生物溶菌酶酶学性质及抑菌特性研究[J].江苏农业科学,2012,40(9):286-288.DOI:10.3969/j.issn.1002-1302.2012.09.116.
[27]李英辉,丛丽娜,朱蓓薇.海参肠中溶菌酶的分离纯化及其酶学性质[J].大连工业大学学报,2008,27(3):193-196.DOI:10.3969/j.issn.1674-1404.2008.03.001.
[28]孙芳,任美凤,胡瑞斌,等.韭菜酸性磷酸酶的分离纯化和部分性质研究[J].食品科学,2013,34(17):187-191.DOI:10.7506/spkx1002-6630-201317040.
[29]邹艳丽,孙谧卜,王跃军.海洋微生物溶菌酶的纯化与性质研究[J].生物工程学报,2005,21(3):420-426.DOI:10.13345/j.cjb.2005.03.018.
[30]韩冷,韩妙君,冯婷.不同来源溶菌酶的性质比较[J].氨基酸和生物资源,2004,26(3):73-75.DOI:10.3969/j.issn.1006-8376.2004.03.022.
[31]HALPER J P,LATOVITZKI N,BERNSTEIN H,et al.Optical activity of human lysozyme[J].Proceedings of the National Academy of Sciences of the United States of America,1971,68(3):517-522.
[32]SOPHIANOPOULOS A J,VANHOLDE K E.Physical studies of muramidase(lysozyme).II.pH-dependent dimerization[J].The Journal of Biological Chemistry,1964,239(8):2516-2524.
[33]成丽丽.鸭卵清溶菌酶的分离纯化及部分性质与功能基团研究[D].重庆:西南大学,2012:15-26.
[34]ZAKS A,KLIBANOV A K.Enzymatic catalysis in organic media 100 degress C[J].Science,1984,224:1249-1251.
[35]杨君.有机相酶催化[J].江苏食品与发酵,1999,3(1):34-37.
Isolation,Purification and Partial Characterization of Lysozyme from Bovine Kidney
FU Ting,WAN Ji,WANG Dan,TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region,Ministry of Education,KeyLaboratory of Freshwater Fish Reproduction and Development,Ministry of Education,School of Life Science,Southwest University,Chongqing 400715,China)
Abstract:Electrophoretically pure lysozyme from bovine kidney was obtained through homogenization,buffer extraction,butanol degreasing,ammonium sulfate fractionation precipitation,CM-Sepharose ion-exchange chromatography and Superdex-200 gel filtration chromatography.Results showed that the specific activity of the purified lysozyme was 15 145.63 U/mg with a recovery rate of 29.13% and the enzyme was purifi ed 231.05 folds.The molecular weight of the lysozyme was approximately 12.66 kD,which consisted of a single subunit.The optimum temperature of the enzyme was 65 ℃ and it was stable at temperatures below 65 ℃; the optimum pH of this enzyme was 9.0 and it was stable in the range of pH 3.0–9.0.Its Kmtowards micrococcus lysodeikticus was 0.399 μg/mL.The enzyme activity was enhanced by methanol,ethanol,isopropanol and KSCN,and inhibited by SDS,Pb2+,and Ag+.
Key words:bovine kidney; lysozyme; isolation and purifi cation; enzymatic properties
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2016)05-0126-06
DOI:10.7506/spkx1002-6630-201605023 [17]居乃琥.21世纪酶工程研究的新动向[J].工业微生物,2001(1):37-45.10.3969/j.issn.1001-6678.2001.01.011.
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
作者简介:傅婷(1990—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:futing3526@126.com
基金项目:重庆市科委重点攻关项目(CSTC2011AB1027)
收稿日期:2015-04-26
